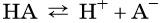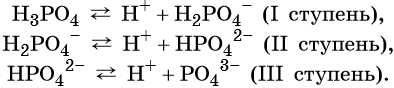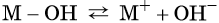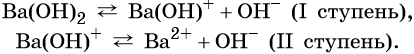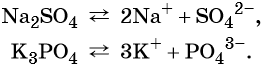Анионы и катионы это что такое
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Многоосновные кислоты диссоциируют ступенчато, например:
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
10. Степень диссоциации слабых электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия
Анионы и катионы это что такое
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Что такое катионы и анионы?
Справочные таблицы, в которых дана сероводородная аналитическая классификация анионов 1-3 групп, качественные реакции и групповые реагенты, а также аналитические сигналы на анионы.
Данная аналитическая классификация анионов основана на растворимости солей бария Ba2+ и серебра Ag+, и включает в себя 3 аналитические группы анионов.
Таблица аналитическая классификация анионов
Таблица аналитические сигналы на анионы первой группы
Таблица аналитические сигналы на анионы второй группы
| № | Реагенты | Анионы | ||
| Cl- | Br- | I- | ||
| 1. | AgNO3 в присутствии HNO3 | AgCl белый творожистый растворим в избытке NH4ОН | AgBr желто-белый, частично растворим в избытке NH4ОН, хорошо растворим в Na2S2O3 | AgI светложелтый, растворим в Na2S2O3 и в большом иодида калия |
| 2. | Хлорная вода в кислой среде | — | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
| 3. | диоксид марганца MnO2 в кислой среде | Свободный хлор, практически не окрашивает бензол-толуол | Свободный бром, окрашивает бензол-толуол в желто-оранжевый цвет | Свободный иод, окрашивает бензол-толуол в малиново-фиолетовый цвет |
Таблица аналитические сигналы на анионы третьей группы
| № | Реагенты | Анионы | |
| NO3- | NO2- | ||
| 1. | металлический алюминий или цинк (Al,Zn) в щелочной среде | выделяется аммиак NH3 | — |
| 2. | металлическая медь (Cu) | выделяются буро-желтые пары диоксида азота (NO2) | — |
| 3. | дифениламин | раствор окрашивается в синий цвет | раствор окрашивается в синий цвет |
| 4. | сильные кислоты (HCl, H2SO4) | — | выделяются желто- бурые пары окислов азота |
| 5. | перманганат калия(KMnO4) | — | раствор перманганата калия обесцвечивается |
Таблица аналитическая классификация анионов на окислительно-восстановительных свойствах
Эта аналитическая классификация анионов основана на их окислительно-восстановительных свойствах. Она также включает три аналитические группы анионов.
| № группы | Анионы | Групповой реагент | Результат действия реагента |
| 1. Анионы-окислители | BrO3-, AsO43-, NO3-, NO2- | KI в сернокислой среде | Выделение иода I2 |
| 2. Анионы-восстановители | S2-, SO32-, S2O32-, AsO33- | I2 | |
| S2-, SO32-, S2O32-, AsO33-, NO2-, C2O42-, Cl-, Br-, I-, CN-, NCS- | KMnO4 в сернокислой среде | Обесцвечивание раствора KMnO4 | |
| 3. Индифферентные анионы | SO42-, CO32-, PO43-, CH3COO-, B4O72- (BO2-) | Нет реагента | — |
Качественные реакции на неорганические вещества и ионы
Представим себе такую ситуацию: Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку.
При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет. В этих случаях придется отличать вещества с применением других реагентов. В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют: NaOH + HCl = NaCl + H2O
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок: 2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
Качественные реакции на катионы
Качественные реакции на анионы
Таблица растворимости
Растворимостью называется способность одного или нескольких веществ вступать в реакцию с другими веществами таким образом, чтобы в результате получалась однородная система. При этом оба вещества распадаются на молекулы, атомы или ионы.
Наравне с таблицей периодической системы Д. И. Менделеева, таблица растворимости является основным теоретическим пособием при изучении химии. Не все вещества взаимодействуют между собой одинаково.
Начинающие химики, учащиеся школ, колледжей и вузов не всегда могут запомнить степень растворимости в воде тех или иных веществ. Именно поэтому таблицу периодической системы Менделеева и таблицу растворимости можно увидеть в каждом кабинете или классе химии, каждой лаборатории.
То или иное сочетание веществ из таблицы может вступать в семь различных реакций с водой:
Чаще всего таблица растворимости применяется при решении уравнений с участием ионных реакций. Реакция возможна только в том случае, если конечный продукт малорастворим или нерастворим вообще.
Условные обозначения в таблице растворимости:
| Р | Вещество хорошо растворимо в воде |
| М | Малорастворимо |
| Н | Практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах |
| РК | Нерастворимо в воде и растворяется только в сильных неорганических кислотах |
| НК | нерастворимо ни в воде, ни в кислотах |
| Г | полностью гидролизуется при растворении и не существует в контакте с водой |
| – | вещество вообще не существует |
| Катионы | Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Что означает слово Катионы и анионы?
Катионы и анионы — это типы ионов, то есть атомы, которые приобрели или потеряли электроны через химические связи.
Атом, имеющий одинаковое количество протонов (положительный заряд) и электронов (отрицательный заряд), считается электрически нейтральным. Когда этот атом принимает или передает электроны, он называется ионом, который, в свою очередь, может быть:
Катион
Катион — это атом, который имеет положительный заряд, потому что в нем больше протонов, чем электронов.
Щелочные металлы (литий, натрий, калий, рубидий, цезий и францио), как правило, образуют катионы, поскольку в их валентном слое имеется только 1 электрон. Это означает, что энергия, необходимая для удаления этого электрона, очень мала, что делает эти элементы очень реактивными.
Катион представлен символом +, следующим за именем элемента. Количество потерянных электронов указывает на тип катиона:
Типы катионов также можно определить по количеству знаков +. Таким образом, элемент, представленный только +, является одновалентным катионом, в то время как другой элемент, представленный +++, является трехвалентным катионом.
Примеры катионов
Анион
Анион — это атом с отрицательным зарядом, потому что в нем больше электронов, чем протонов. Элементы семейства азота, калькогенов и галогенов имеют тенденцию образовывать анионы, потому что они легко принимают электроны.
Анион представлен символом — после имени элемента. Количество полученных электронов указывает на тип аниона:
Примеры анионов
Ионные Связи
Ионные или электровалентные связи представляют собой связи, которые возникают между катионами и анионами.
Элементы могут принимать, давать или делить электроны таким образом, чтобы их последний энергетический слой имел 8 электронов. Это известно как теория октетов.
Согласно теории октетов, атомы имеют тенденцию стабилизироваться, когда в валентном слое (последнем электронном слое) находится 8 электронов. Таким образом, будучи положительно заряженными, катионы связываются с отрицательно заряженными анионами. Таким образом, атомы дают или принимают электроны для достижения равновесия.
Связи, образованные между катионами и анионами, очень прочны и имеют тенденцию иметь следующие признаки:
Ионные связи образуют ионные соединения, такие как хлорид натрия (поваренная соль), образованный связью Na + (катион натрия) + Cl- (хлорид-анион) → NaCl.
Примеры ионных соединений
Некоторые примеры ионных соединений:
Катионный стол
Li +Fe + 2Na +Со + 2К +Ni + 2Rb +Sn + 2Cs +Pb + 2(NH 4 ) +Mn + 2Ag +Pt + 2Cu +Би + 3Hg +Al + 3Au +Cr + 3Mg + 2Au + 3Ca + 2Fe + 3Sr + 2Со + 3Ба + 2Ni + 3Zn + 2Sn + 4CD + 2Pb + 4Cu + 2Мн + 4Hg + 2Pt + 4
| литий | железистый |
| натрий | cobaltoso |
| калий | Niqueloso |
| рубидий | содержащий двухвалентное олово |
| цезий | Plumboso |
| аммоний | марганцевых |
| серебро | относящийся к платине |
| медь | висмут |
| Ртути | Нержавеющая сталь |
| Auroso | хром |
| магний | золотоносный |
| кальций | трехвалентного железа |
| стронций | кобальтовые |
| барий | Niquélico |
| цинк | оловянный |
| кадмий | свинцовый |
| двухвалентной | марганца |
| содержащий двухвалентную ртуть | платина |