Аногенитальная область что это
УЛУЧШЕНИЕ ИНТИМНОГО ЗДОРОВЬЯ
О светление/отбеливание аногенитальной области — это современные косметологические процедуры, направленные на депигментацию (осветление) определенных участков кожи в области промежности (малых и больших половых губ, задней спайки), ануса, внутренней поверхности бедер. Эти зоны часто осветляют исходя из личного понимания эстетичности.
Причин, по которым у женщин кожа в интимной зоне темнеет, может быть несколько:
Некоторым женщинам данная процедура может показаться необязательной, но для многих пациентов пигментация в аногенитальной области является серьезной проблемой. Сегодня в эстетической медицине всего мира отбеливание кожных покровов интимных зон является одной из востребованных косметологических услуг. Как правило, процедуру выполняют женщины, желающие выглядеть идеально во всех отношениях – ведь во время близости с половым партнером именно эти участки тела становятся объектом особого внимания.
Внимание! Не рекомендуется проводить осветление аногенитальной области кислотами в домашних условиях. Неправильные действия опасны ожогами и болезненными ощущениями.
Отбеливание интимных зон проводится при помощи лазерного аппарата AcuPulse. Суть данной методики заключается в том, что лазерный луч при воздействии вызывает стимуляцию выработки коллагеновых и эластиновых волокон в глубоких слоях кожи, что приводит к её уплотнению и сокращению. В результате воздействия, происходит разрушение пигментированных клеток, и кожа в аногенитальной зоне светлеет.
После проведенной процедуры кожные покровы в обработанном месте краснеют. Данное проявление проходит на 2-3 день, кожа в интимной зоне отшелушивается и светлеет.
Базовый курс омоложения кожи аногенитальной области составляет 2-3 процедуры с интервалом в 1 месяц.
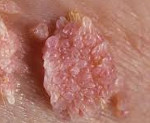
Аногенитальный кондиломатоз – это разрастание остроконечных кондилом в области анального отверстия и промежности. Проявляется ощущениями дискомфорта и инородного тела в области ануса, анальным зудом, ощущением влажности, болезненностью при дефекации. Патология становится источником психологических и сексуальных проблем. Существует риск травмирования образований с кровотечением и последующим инфицированием. Возможно злокачественное перерождение. Диагноз выставляется на основании данных осмотра, лабораторных и инструментальных исследований. Лечение включает удаление кондилом, назначение средств для стимуляции иммунитета.
МКБ-10
Общие сведения
Аногенитальный кондиломатоз – заболевание, характеризующееся возникновением в области заднего прохода и гениталий остроконечных кондилом, которые могут разрастаться до гигантских размеров и закрывать анальное отверстие. Скопление остроконечных кондилом напоминает по виду цветную капусту. Гигантскую кондилому еще называют опухолью Бушке-Левенштейна (ученые, впервые описавшие такое явление в 1925 году).
Причины
Аногенитальный кондиломатоз возникает в результате заражения вирусом папилломы человека 6 и 11 типов. Данный вирус весьма распространен, вызывает различного рода заболевания кожных покровов и слизистых оболочек. На сегодняшний день выявлено более 100 разновидностей вируса, провоцирующих разнообразные патологии (многообразные виды бородавок, кондилом, папиллом).
Вирус папилломы человека относят к одной из самых распространенных инфекций, передающихся половым путем. Более половины людей, живущих половой жизнью, являются носителями данного вируса (зачастую нескольких его типов). В большинстве случаев вирусоносительство протекает бессимптомно. Возникновение кондилом наблюдается не более чем в 1-2% случаев вирусоносительства соответствующего типа. Предполагается, что для появления остроконечных кондилом у людей, инфицированных ВПЧ 6 или 11 типов, необходимо также общее и местное ослабление иммунной защиты.
Статистика показывает высокую частоту заболеваемости перианальными кондиломами среди гомосексуалистов, однако локализация остроконечных кондилом в области ануса вовсе не обязательно является результатом анального полового контакта. При инфицировании вирус проникает в довольно обширную зону кожных и слизистых покровов в области гениталий, а перианальная область располагается в непосредственной близости как к половым органам мужчин, так и женщин.
Патогенез
Вирус папилломы человека, вызывающий аногенитальный кондломатоз, располагается в клетках глубоких слоев кожи и слизистых оболочек половых, не проникая в кровоток. По мере обновления покровных тканей и продвижения глубоких слоев к поверхности вместе с клетками мигрирует и вирус, который достигнув поверхности кожи, вызывает развитие клинических симптомов. Вышедший к поверхности вирус становится способным к заражению. Инфицирование вирусом, вызывающим остроконечные кондиломы, происходит контактным путем. Чаще всего заражение происходит при половых контактах (вагинальных, анальных, значительно реже – оральных). Заражение бытовым образом, видимо, возможно, но для утверждения вероятности такого способа передачи не хватает достаточных доказательных данных.
От инфицирования вирусом до возникновения и разрастания остроконечных кондилом может пройти как несколько недель, так и несколько лет. Вирус в это время развивается в глубоких слоях и не выходит на поверхность. Такое бессимптомное носительство обычно мало заразно. Локализация остроконечных кондилом чаще всего в области гениталий (у мужчин на головке полового члена, у женщин на малых и больших половых губах), но нередко и у женщин, и у мужчин кондиломы разрастаются в области анального отверстия. Такие кондиломы и называют перианальными.
Симптомы кондиломатоза
Заболевание проявляется возникновением и разрастанием в области ануса сосочковидных образований, ощущением дискомфорта, присутствия инородного тела в зоне промежности. Зачастую в области заднего прохода имеет место мацерация (мокнутие) кожи. Большие кондиломы могут механически повреждаться, в результате возникает болезненность и кровянистое отделяемое.
Большие кондиломы способны секретировать жидкость с неприятным запахом, в толще гигантских разрастаний могут появляться свищеобразные ходы. Присоединение воспаления способствует развитию симптомов общей интоксикации (лихорадка, слабость, головная боль). Перианальные кондиломы могут расти с довольно большой скоростью, однако выраженная болезненность для данного заболевания не характерна. Если имеют место интенсивные боли в области ануса, необходимо предположить какую-либо сопутствующую патологию (геморрой, анальная трещина, парапроктит и др.).
Осложнения
Аногенитальный кондиломатоз имеет склонность к развитию рецидивов, как в случае проведения консервативного лечения, так и после хирургического удаления разрастаний. В случаях формирования гигантских кондилом и возникновения разрастаний в анальном канале есть некоторая вероятность развития плоскоклеточного рака, поэтому удаленные кондиломы подвергаются гистологическому исследованию, а больные с опухолями Бушке-Левенштейна (гигантскими кондиломами) подлежат тщательному осмотру и обследованию.
Кроме того, крупные кондиломы могут повреждаться и кровоточить, область, пораженная кондиломатозом склонна к развитию воспалительного процесса. Вследствие длительного существования разрастаний в области ануса продолжительная мацерация кожи способствует ее раздражению и развитию перианального дерматита.
Диагностика

С целью выявления кондилом в анальном канале врач-проктолог производит пальцевое исследование. Показанием к нему является обнаружение даже небольших образований в перианальной области. При обследовании анального канала остроконечные кондиломы прощупываются как мелкие узелки плотной консистенции. Гигантские перианальные кондиломы довольно часто сопровождаются поражением слизистой оболочки анального канала. С той же целью (выявление остроконечных кондилом в анальном канале) производят аноскопию.
У ВИЧ-инфицированных лиц с развивающимся синдромом иммунодефицита кондиломы склонны быстро разрастаться до гигантских размеров, образуя скопления, напоминающие цветную капусту (опухоль Бушке-Левенштейна). Такие опухоли являются фактором риска развития плоскоклеточного рака, в особенности у больных ВИЧ-инфекцией. Гистологическое исследование может выявить в крупных узлах этой опухоли инвазивные компоненты рака. У больных с подозрением на злокачественное новообразование обязательно производится ректороманоскопия. Часто во время этого исследования отмечают гиперемию (иногда зернистость) слизистой прямой кишки. В самой прямой кишке (выше аноректальной линии) остроконечных кондилом не отмечается.
При выявлении аногенитального кондиломатоза все больные подвергаются исследованию для выявления ВИЧ и сифилиса (RPR-тест). Подтверждение диагноза производится на основании цитологического и гистологического исследования биоптатов кондилом. Кроме того, в крови методом ИФА могут обнаруживаться антитела к вирусу папилломы человека. Проводится также выделение ДНК вируса из клеток пораженной ткани методом ПЦР-диагностики.
Дифференцируют остроконечные кондиломы в основном с кондиломами сифилитическими и контагиозным моллюском. Контагиозный моллюск обычно проявляется белесоватыми разрастаниями в виде несливающихся бляшек с влажной плоской поверхностью. Сифилитические кондиломы подозревают в случае выявления положительной реакции Вассермана. Окончательная диагностика производится после получения результатов серологического анализа. выявления тех или иных антител и после заключения венеролога. При выявлении остроконечных кондилом производится обследование по поводу ВИЧ и других инфекций, передающихся половым путем. В дифференциальной диагностике кондиломатоза и злокачественных новообразований основную роль играет цитологическое исследование.
Лечение аногенитального кондиломатоза
Современная медицина не знает способов окончательного уничтожения вируса папилломы человека, поэтому лечение направлено на избавление от симптомов и предупреждение развития рецидивов осложнений. Оперативное удаление кондилом не исключает последующей передачи вируса партнеру, поскольку пациент остается вирусоносителем, и при поверхностном расположении в коже зараженных клеток может являться источником инфицирования. Развитие рецидивов после лечения перианальных кондилом случается у 30% больных.
Тактику лечения выбирают индивидуально в зависимости от размеров, количества, локализации остроконечных кондилом, сопутствующих урогенитальных инфекций и общего состояния организма. Консервативному лечению подлежат небольшие перианальные кондиломы, не сливающиеся в конгломераты. Кондиломы прижигают с помощью раствора подофиллотоксина (нанося его на пораженную кожу специальной палочкой, идущей в комплекте с препаратом). Следует избегать попадания препарата на непораженные участки кожи. С целью подавления размножения вируса и предотвращения рецидивов назначают местные противовирусные средства (подофиллотоксин, бромнафтохинон). Средства местного действия сочетают с общей иммуностимулирующей терапией.
Наиболее радикальной методикой избавления от перианальных кондилом является их хирургическое удаление. Разрастания иссекают в пределах неизмененных тканей, удаляют с помощью углеводородного лазера, применяют методы химической цитодеструкции (концентрированные растворы едких кислот, цитотоксические препараты). Однако методики удаления кондилом в подавляющем большинстве случаев не ведут к предупреждению их повторного развития, поскольку вирус папилломы человека продолжает развиваться в глубоких слоях окружающих тканей. Кроме того, прижигание химическими реагентами кондилом в анальном канале нецелесообразно, поскольку недостаточно эффективно и ведет к развитию осложнений (местного воспаления, зуда, мокнутия и эрозирования слизистой).
Регулярные курсы общей терапии с помощью интерферона и его индукторов, иных иммуностимуляторов способствуют предупреждению развития перианальных кондилом снова, после их удаления. Сразу по окончании лечебного курса комбинированной иммунотерапии количество пациентов с положительной ДНК-пробой на ВПЧ снижается в полтора-два раза. Особо стоит отметить положительную роль иммунотерапии в профилактике озлокачествления разрастаний с высоким канцерогенным риском. Риск онкогенности у больных, получивших иммунотерапевтическое лечение, также снижается почти в два раза.
Лечение аногенитальных кондилом назначается как непосредственно обратившемуся лицу, так и его половому партнеру. На время лечения рекомендовано отказаться от половых контактов. Комбинированная терапия, сочетающая методы цитодеструкции имеющихся разрастаний с назначением иммуностимулирующих средств общего действия, представляет собой наиболее эффективную схему лечения, способствующую улучшению качества жизни и снижению вероятности повторного развития клинических проявлений заболевания.
Оперативное удаление перианальных кондилом, как правило, проводится под местной анестезией и относится к малотравматичным вмешательствам. Общий наркоз и продолжительное послеоперационное наблюдение требуется при необходимости удаления обширных разрастаний. При многочисленных кондиломах, а также при гигантских разрастаниях, возможно их хирургическое удаление в несколько этапов. Одномоментное иссечение больших кондилом в практической проктологии обычно не применяется, поскольку образующиеся обширные дефекты тканей с трудом заживают и могут приводить к деформациям перианальной области.
Прогноз и профилактика
Вне зависимости от методики удаления кондилом вероятность рецидивов аногенитального кондиломатоза во всех случаях практически одинакова. Профилактикой рецидивирования патологии является комплексное лечение с применением противовирусных средств и иммунной терапии, а также поддержание иммунитета, регулярное проведение курсов терапии под контролем специалиста. При выявлении в морфологической структуре кондилом злокачественных клеток прогноз неблагоприятный.
Комбинированная терапия заболеваний шейки матки, ассоциированных с вирусом папилломы человека
Папилломавирусная инфекция привлекла особое внимание в последнее время в связи с ролью этой группы вирусов в развитии рака. Доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки, было отмечено Нобелевско
Папилломавирусная инфекция привлекла особое внимание в последнее время в связи с ролью этой группы вирусов в развитии рака. Доказательство того, что некоторые типы вируса папилломы человека (ВПЧ) способны вызывать рак шейки матки, было отмечено Нобелевской премией по медицине 2008 года.
На сегодня известно более 200 типов ВПЧ. Вирусы, поражающие аногенитальную область, условно разделяют на две группы: высокого и низкого онкогенного риска. Клиническую значимость такого деления типов ВПЧ иллюстрирует табл. 1. Из нее видно, что злокачественные новообразования гениталий, а также дисплазии средней и тяжелой степени ассоциированы именно с ВПЧ высокого онкогенного риска (например, 16-й и 18-й типы). По данным Прилепской В. Н. и соавт. [1], в 58% случаев обнаружения ВПЧ у женщин с различной генитальной патологией присутствуют типы высокого онкогенного риска — 16 и 18.
Классификация
К ВПЧ-поражениям относят аногенитальные бородавки — остроконечные кондиломы, вульгарные бородавки, плоские кондиломы. Необходимо помнить, что различные виды бородавок (кондилом) — это лишь часть спектра поражений, вызванных ВПЧ. Существуют еще субклиническая и латентная формы инфекции, а также ВПЧ-ассоциированные заболевания — интраэпителиальные неоплазии (ИН) различных степеней. В частности, известно, что более чем у 60% женщин с аногенитальными бородавками имеется сопутствующая цервикальная ИН (CIN) в субклинической форме [2]. Помимо CIN с ВПЧ могут быть ассоциированы ИН вульвы (VIN), полового члена (PIN) и анальной области (AIN) [3].
В мировой практике используются различные классификации папилломавирусной инфекции и ассоциированных с ней заболеваний. Ориентировочная классификация представлена Handley J. et al. [4]:
ВПЧ-инфекция
1. Клинические формы (видимые невооруженным глазом или невидимые, но при наличии соответствующей симптоматики):
2. Субклинические формы (невидимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании):
3. Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
Кроме этого, в литературе при описании поражений шейки матки, ассоциированных с ВПЧ, применяют классификацию по Папаниколау — в зависимости от степени изменений в мазках выделяют 5 классов. ВОЗ рекомендует использовать Терминологическую систему Бетесда (TBS) — норма, ASC-US, LSIL, HSIL, карцинома. Однако TBS не исключает использование терминов CIN и «дисплазия». Для удобства понимания терминологии врачами и единообразия в определении подходов к диагностике и лечению патологии шейки матки в табл. 2 приведено соотношение терминов различных морфологических классификаций.
Эпидемиология
По оценкам Центра по контролю заболеваемости (CDC) в США ВПЧ инфицируются до 5,5 млн человек в год [5]. В Европе в год регистрируется 554 000 случаев, вызванных этими вирусами: в том числе цервикальных неоплазий легкой степени (CIN I), генитальных бородавок, цервикальных неоплазий средней и тяжелой степени (CIN II и III), рака шейки матки. Таким образом, в сутки по этой причине умирает до 40 человек [Gross et al., 2008]. По данным российских ученых папилломавирусная инфекция гениталий встречается у 44,3% женщин, обращающихся в гинекологические клиники [6].
Диагностика
Комплексная диагностика заболеваний, ассоциированных с ВПЧ, предполагает клинико-визуальный осмотр, кольпоскопическое исследование, тестирование на ВПЧ, использование цитологических и/или гистологических методов.
Лечение
Согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, лечение аногенитальных ВПЧ-поражений направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Именно такой подход приведен во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией (CDC, Европейских рекомендациях, рекомендациях ВОЗ). Такой подход представлен и в рекомендациях Российского общества дерматовенерологов и косметологов.
Как для лечения клинических проявлений ВПЧ-инфекции, так и ассоциированных с ней заболеваний (в первую очередь это касается CIN II и CIN III) применяют деструктивные методы — хирургические, физические (крио-, электро- или лазеротерапия, радиоволновая хирургия) и химические. При CIN I тактика может различаться в зависимости от величины поражения шейки матки, наличия другой патологии и возможностей самой пациентки [7]. При небольшом поражении чаще рекомендуют оставить женщину под наблюдением и периодически выполнять обследования — тесты на ВПЧ, кольпоскопию, цитологию. Очень важно при этом диагностировать и лечить воспалительные, дисгормональные и другие заболевания урогенитального тракта. Большую роль в определении тактики ведения больных в этих случаях имеет желание пациентки и ее возможность регулярного посещения врача для проведения обследования.
Более эффективным методом лечения при патологии шейки матки, ассоциированной с ВПЧ, является комбинация деструкции с адъювантной противовирусной и иммуномодулирующей терапией. Применение активаторов противовирусного иммунитета позволяет повысить эффективность лечения за счет снижения частоты рецидивов, а также воздействия непосредственно на репродукцию вируса.
Одним из немногих иммунотропных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ, является Изопринозин. Он также входит в Европейскую классификацию методов лечения аногенитальных бородавок [8]. В настоящее время накоплен огромный опыт применения Изопринозина, так как используется он с 70-х годов XX века и зарегистрирован в большинстве стран Европы.
Изопринозин (инозин пранобекс) — иммуномодулятор, стимулирующий противовирусную защиту организма. Препарат нормализует дефицит или дисфункцию клеточного иммунитета, индуцируя созревание и дифференцировку Т-лимфоцитов и Т1-хелперов, потенцируя индукцию лимфопролиферативного ответа в митогенных или антиген-активных клетках. Изопринозин моделирует цитотоксичность Т-лимфоцитов и натуральных киллеров, функцию Т8-супрессоров и Т4-хелперов, а также повышает количество иммуноглобулина G и поверхностных маркеров комплемента. Препарат повышает синтез интерлейкина-1 (ИЛ-1) и интерлейкина-2 (ИЛ-2), регулирует экспрессию рецепторов ИЛ-2, существенно увеличивает секрецию эндогенного гамма-интерферона и уменьшает продукцию интерлейкина-4 в организме, а также усиливает действие нейтрофильных гранулоцитов, хемотаксис и фагоцитоз моноцитов и макрофагов [9–14].
Помимо иммунотропного, Изопринозин обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Таким образом, Изопринозин прямо и косвенно, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию инфекции.
Одним из показаний применения препарата являются инфекции, вызванные ВПЧ: остроконечные кондиломы, папилломавирусная инфекция вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, Изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней или 5 дней в неделю последовательно в течение 1–2 недель в месяц в течение 3 месяцев.
В работе Забелева А. В. и соавт. [15] показано исчезновение атипичного эпителия после проведения курсов Изопринозина женщинам с ВПЧ-ассоциированными плоскоклеточными ИН низкой степени. Изопринозин назначали по 1 г 3 раза в сутки в течение 5 дней, 3 курса с интервалом 1 месяц.
Аналогичные результаты — улучшение морфологической картины эпителия вульвы — показаны в исследовании Sun Kuie Tay [16]. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо, — у 16,7% (рис. 1).
В другом исследовании при монотерапии Изопринозином по 3 г в сутки у 44 женщин с CIN I (длительность лечения 10 дней) и CIN II (длительность лечения 21 день) установлено, что выраженный клинический эффект наблюдался у 88,6% пациенток — полностью исчезало поражение эпителия экзоцервикса, что подтверждалось кольпоскопически и гистологически [17] (рис. 1).

.gif)
.gif)
.gif)
.gif)