Антидиуретический эффект что это
Антидиуретический гормон
Вазопресси́н, или антидиурети́ческий гормо́н (АДГ) — гормон гипоталамуса, который накапливается в задней доле гипофиза (в нейрогипофизе) и оттуда секретируется в кровь. Секреция увеличивается при повышении осмолярности плазмы крови и при уменьшении объёма внеклеточной жидкости. Вазопрессин увеличивает реабсорбцию воды почкой, таким образом повышая концентрацию мочи и уменьшая её объём. Имеет также ряд эффектов на кровеносные сосуды и головной мозг.
Содержание
Структура
Состоит из 9 аминокислот: Cys-Tyr-Phe-Gln-Asn-Cys-Pro-(Arg или Lys)-Gly. У большинства млекопитающих в позиции 8 находится аргинин (аргинин-вазопрессин, AVP), у свиней и некоторых родственных животных — лизин (лизин-вазопрессин, LVP). Между остатками Cys1 и Cys6 формируется дисульфидная связь.
Синтез и секреция
Большая часть гормона синтезируется крупноклеточными нейронами супраоптического ядра гипоталамуса, аксоны которых направляются в заднюю долю гипофиза («нейрогипофиз») и образуют синаптоподобные контакты с кровеносными сосудами. Вазопрессин, синтезированный в телах нейронов, аксонным транспортом переносится к окончаниям аксонов и накапливается в пресинаптических везикулах, секретируется в кровь при возбуждении нейрона.
Типы рецепторов и внутриклеточные системы трансдукции гормонального сигнала
Все вазопрессиновые рецепторы являются классическими мембранными рецепторами, связанными с гетеротримерными G-белками.
V1A и V1B-рецепторы связаны с Gq-белками и стимулируют фосфолипазно-кальциевый механизм передачи гормонального сигнала.
Физиологические эффекты
Почки
Вазопрессин является единственным физиологическим регулятором выведения воды почкой. Его связывание с V2-рецепторами собирательной трубки приводит к встраиванию в апикальную мембрану ее главных клеток белка водных каналов аквапорина 2, что увеличивает проницаемость эпителия собирательной трубки для воды и ведёт к усилению её реабсорбции. В отсутствие вазопрессина, например при несахарном диабете, суточный диурез у человека может достигать 20 л., тогда как в норме он составляет 1.5 литра. В экспериментах на изолированных почечных канальцах вазопрессин увеличивает реабсорбцию натрия, тогда как на целых животных вызывает увеличение экскреции этого катиона. Каким образом разрешить это противоречие, до настоящего времени не ясно.
Конечным эффектом действия вазопрессина на почки являются увеличение содержания воды в организме, рост объёма циркулирующей крови (ОЦК) (гиперволемия) и разведение плазмы крови (гипонатриемия и понижение осмолярности).
Сердечно-сосудистая система
Через V1A-рецепторы (англ.) русск. вазопрессин повышает тонус гладкой мускулатуры внутренних органов, в особенности ЖКТ, повышает сосудистый тонус и таким образом вызывает увеличение периферического сопротивления. Благодаря этому, а также за счёт роста ОЦК, вазопрессин повышает артериальное давление. Однако, при физиологических концентрациях гормона, его сосудодвигательный эффект невелик. Вазопрессин имеет гемостатический (кровоостанавливающий) эффект, за счёт спазма мелких сосудов, а также за счёт повышения секреции из печени, где находятся V1A-рецепторы, некоторых факторов свёртывания крови, в особенности фактора VIII (фактор Виллебранда) и уровня тканевого активатора плазмина, усиления агрегации тромбоцитов. В больших дозах АДГ вызывает сужение артериол, что приводит к увеличению АД. Развитию гипертензии способствует так же наблюдающееся под влиянием АДГ повышение чувствительности сосудистой стенки к констрикторному действию катехоламинов. В связи с этим АДГ и получил название вазопрессин.
Центральная нервная система
Регуляция
Главным стимулом для секреции вазопрессина является повышение осмолярности плазмы крови, обнаруживаемое осморецепторами в самих паравентрикулярном и супраоптическом ядрах гипоталамуса, в области передней стенки третьего желудочка, а также, по-видимому, печени и ряда других органов. Кроме того, секреция гормона повышается при уменьшении ОЦК, которое воспринимают волюморецепторы внутригрудных вен и предсердий. Последующая секреция AVP приводит к коррекции этих нарушений.
Вазопрессин химически весьма сходен с окситоцином, поэтому может связываться с рецепторами к окситоцину и через них оказывает утеротоническое и окситоцическое (стимулирующее тонус и сокращения матки) действие. Однако его аффинность к OT-рецепторам невелика, поэтому при физиологических концентрациях утеротонический и окситоцический эффекты у вазопрессина гораздо слабее, чем у окситоцина. Аналогично, окситоцин, связываясь с рецепторами к вазопрессину, оказывает некоторое, хотя и слабое, вазопрессиноподобное действие — антидиуретическое и сосудосуживающее.
Уровень вазопрессина в крови повышается при шоковых состояниях, травмах, кровопотерях, болевых синдромах, при психозах, при приёме некоторых лекарственных препаратов.
Заболевания, вызванные нарушением функций вазопрессина
Несахарный диабет
При несахарном диабете уменьшается реабсорбция воды в собирательных трубочках почек. Патогенез заболевания обусловлен неадекватной секрецией вазопрессина — АДГ (несахарный диабет центрального происхождения) или сниженной реакцией почек на действие гормона (нефрогенная форма, почечный несахарный диабет). Реже причиной несахарного диабета становится ускоренная инактивация вазопрессина вазопрессиназами циркулирующей крови. На фоне беременности течение несахарного диабета становится более тяжёлым из-за повышения активности вазопрессиназ или ослабления чувствительности собирательных трубочек.
Больные несахарным диабетом выделяют за сутки большое количество (>30мл/кг) слабоконцентрированной мочи, страдают от жажды и пьют много воды (полидипсия). Для диагностики центральной и нефрогенной форм несахарного диабета используют аналог вазопрессина десмопрессин — он оказывает лечебное действие только при центральной форме.
Синдром неадекватной секреции антидиуретического гормона
Этот синдром обусловлен неполным подавлением секреции АДГ при низком осмотическом давлении плазмы и отсутствии гиповолемии. Синдром неадекватной секреции антидиуретического гормона сопровождается повышенным выделением мочи, гипонатриемией и гипоосмотическим состоянием крови. Клинические симптомы — летаргия, анорексия, тошнота, рвота, мышечные подёргивания, судороги, кома. Состояние пациента ухудшается при поступлении в организм больших объёмов воды (внутрь или внутривенно); напротив, ремиссия наступает при ограничении употребления воды.
Синдром Пархона, или Несахарный антидиабет
Елена Шведкина о состоянии, при котором в организме задерживается слишком много жидкости
Синдром Пархона — редкое заболевание. Оно характеризуется избыточной секрецией антидиуретического гормона (АДГ) из гипофиза или другого источника, что приводит к снижению концентрации ионов натрия в крови (гипонатриемии) и задержке жидкости в тканях, т. е. к водной интоксикации.
Синдром Пархона встречается не более чем в 1 % случаев всех выявленных гипонатриемий. Вообще, гипонатриемия выявляется у 15–20 % пациентов, госпитализированных в связи с неотложными показаниями, и в 20 % госпитализированных в критическом состоянии. Распространенность гипонатриемии среди амбулаторных пациентов намного ниже и составляет приблизительно 4–7 %. В Международной классификации болезней синдром Пархона имеет шифр Е22.2.
Комплекс симптомов синдрома Пархона впервые был выделен в отдельную патологию румынским ученым, эндокринологом Константином Пархоном в 1938 году, за что болезнь и получила свое именное название. Пархон сообщил о редком клиническом синдроме, по симптоматике противоположном несахарному диабету. Напомним, что при несахарном диабете имеет место полиурия (выделение до 15 литров мочи в сутки) и полидипсия (жажда), а при синдроме Пархона, напротив, жажда и полиурия отсутствуют. Отсюда появилось второе название синдрома Пархона — «несахарный антидиабет». Кроме того, Пархон первым связал синдром с избытком АДГ. В авторском описании заболевание характеризовалось олигурией, отсутствием жажды и появлением отеков. Впоследствии термином «синдром Пархона» стали обозначать идиопатическую форму синдрома неадекватной секреции АДГ.
В дальнейшем, в 1957 году, синдром гиперсекреции АДГ был детально описан группой ученых под руководством американского эндокринолога Фредерика Барттера у пациентов с бронхогенной карциномой.
Регуляция водного баланса в норме
В организме секрецию вазопрессина (АДГ) активируют:
В крови АДГ не связывается белками плазмы, он ассоциирован с тромбоцитами, которые выполняют таким образом транспортную функцию.
В тканях-мишенях есть два типа мембранных рецепторов к АДГ — V1 и V2. Стимуляция V1‑рецепторов, локализованных на мембране эндотелиальных и гладкомышечных клеток кровеносных сосудов, вызывает сужение сосудов. Стимуляция V2‑рецепторов клеток дистальных отделов почечных канальцев повышает реабсорбцию воды и концентрирование мочи. АДГ является единственным гормоном, способным стимулировать канальцевую реабсорбцию воды и при этом не задерживать натрий в организме. АДГ также стимулирует всасывание воды и в железах внешней секреции, и в желчном пузыре.
Этиология
Синдром гиперсекреции АДГ может развиваться при различных заболеваниях и приеме некоторых лекарственных средств. Так, при поражении центральной нервной системы развитие синдрома обусловлено увеличением выработки АДГ гипофизом. Злокачественные новообразования могут сами вырабатывать АДГ вне зависимости от гипоталамо-гипофизарного звена, при этом гиперсекреция АДГ развивается в рамках паранеопластического синдрома, однако чаще имеет легкую, стертую форму течения и выявляется достаточно поздно, поэтому не может стать маркером опухолевого роста на ранней стадии. Другая часто встречающаяся причина гиперпродукции АДГ — синдром приобретенного иммунодефицита (СПИД). При СПИДе синдром неадекватной продукции АДГ может быть следствием бактериальных либо вирусных инфекций легких и ЦНС. Синдром Пархона чаще развивается у пожилых людей и больных с хронической соматической патологией.
Основные причины гиперсекреции АДГ
| Поражение ЦНС | Инсульт Кровоизлияние Новообразования Инфекции Гидроцефалия Гипофизэктомия транссфеноидальным доступом Красная волчанка Острая перемежающаяся порфирия |
| Злокачественные новообразования | Мелкоклеточный рак легкого Рак глотки, тимома Рак поджелудочной железы Рак мочевого пузыря Лимфома, саркома Рак других органов (предстательной железы, двенадцатиперстной кишки, яичников, мезотелия) |
| Поражение дыхательной системы за счет стимуляции J-рецепторов | Инфекции (пневмонии, абсцесс, туберкулез) Бронхоэктазы Искусственная вентиляция легких |
| Прием лекарственных препаратов | Психотропные препараты (нейролептики, трициклические антидепрессанты, селективные ингибиторы обратного захвата серотонина, карбамазепин) Неврологические препараты (наркотические анальгетики, амфетамины) Ингибиторы ацетилхолинэстеразы Противоопухолевые препараты (винкристин, винбластин, циклофосфамид) Эндокринологические препараты (окситоцин, десмопрессин, клофибрат) |
| Инфекционные заболевания опосредованно через ИЛ-6 | Заболевания ЦНС и дыхательной системы СПИД |
| Идиопатические |
Патофизиология
В основе синдрома лежит дисбаланс жидкости в организме: поступление воды превышает её выведение. У большинства пациентов постоянно секретируются АДГ или АДГ-подобные пептиды, несмотря на гипоосмолярность плазмы. Гиперпродукция АДГ ведет к задержке воды, снижению осмолярности плазмы, почечной потере натрия и гипонатриемии, но низкий уровень натрия в плазме и гиперволемия не вызывают компенсаторного, адекватного снижения синтеза АДГ. Гиперволемия подавляет продукцию альдостерона, усугубляя тем самым потерю натрия.
В условиях гиперволемии усиливается секреция предсердного натрийуретического фактора, что также способствует выведению натрия. Таким образом, патофизиологическую основу синдрома неадекватной продукции АДГ составляют: потеря натрия с мочой; гипонатриемия, подавляющая центр жажды; гиперволемия, ведущая к водной интоксикации.
Клиническая картина
Синдром Пархона редко развивается самостоятельно, и в первую очередь пациента беспокоят проявления основного заболевания. Ведущие клинические проявления — симптомы нарушения сознания, редко (при выраженной гипонатриемии и водной интоксикации) возможны увеличение массы тела и образование отеков, обусловленные задержкой воды, вследствие олигурии. Выраженность клинических проявлений определяется степенью гипонатриемии.
Лабораторные исследования
Определяют концентрацию натрия в крови, осмоляльность крови и мочи, исследуют почечную экскрецию натрия. Диагностика синдрома Пархона основана на обнаружении гипонатриемии, гипоосмоляльности плазмы и гиперосмоляльности мочи (>300 моем/кг).
Дифференциальный диагноз
При проведении дифференциальной диагностики в первую очередь необходимо исключить заболевания печени, почек, сердца, надпочечниковую недостаточность и гипотиреоз. Наибольшие трудности возникают при попытке дифференцировать диагноз с синдромом идиопатических отеков — заболеванием, имеющим много клинически сходных симптомов, но иную патофизиологическую природу (патогенез связан с рядом нейрогенных, гемодинамических и гормональных изменений, ведущих к нарушению регуляции водно-солевого гомеостаза). Этот синдром характеризуется развитием периферических или распространенных отеков. АДГ повышен у всех больных с синдромом Пархона, тогда как при идиопатических отеках повышение АДГ наблюдается редко, также и гипонатриемия, и гиперволемия никогда не наблюдаются при идиопатических отеках.
Лечение
Основными целями лечения синдрома Пархона являются нормализация осмоляльности и концентрации натрия в плазме, устранение гипергидратации.
Для лечения острых и выраженных проявлений синдрома назначается гипертонический раствор хлорида натрия (3 %) в сочетании с диуретиком, скорость повышения концентрации натрия 0,5–1,0 ммоль/л в час до достижения концентрации 125 ммоль/л.
Для купирования легкой хронической гипонатриемии эффективной мерой является умеренное ограничение приема жидкости до 800–1000 мл/сут.
Прогноз
Прогноз в целом благоприятный, но зависит от характера основного заболевания и причины, вызвавшей неадекватную секрецию АДГ. Тяжелые формы синдрома Пархона могут приводить к летальному исходу в результате тяжелой водной интоксикации.
Антидиуретический эффект что это
В нейрогипофизе не образуются, а лишь накапливаются и секретируются в кровь нейрогормоны супраоптического и паравентрикулярного ядер гипоталамуса — вазопрессин и окситоцин. Оба гормона находятся в гранулах в связанном состоянии со специальными белками — нейрофизинами. В процессе секреции содержимое гранул путем экзоцитоза поступает в кровь.
Регуляция секреции и физиологические эффекты вазопрессина
Секреция вазопрессина зависит от его синтеза в гипоталамических нейронах и регулируется тремя типами стимулов:
1) сдвигами осмотического давления и содержания натрия в крови, воспринимаемыми интероцепторами сосудов и сердца (осмо-, натрио-, волюмо- и механорецепторы), а также непосредственно гипоталамическими нейронами (центральные осморецепторы);
2) активацией гипоталамических ядер при эмоциональном и болевом стрессе, физической нагрузке,
3) гормонами плаценты и ангиотензином-II, как содержащимся в крови, так и образуемым в мозге.
В крови вазопрессин не связывается белками плазмы, но ассоциирован с тромбоцитами, выполняющими по отношению к гормону транспортную функцию.
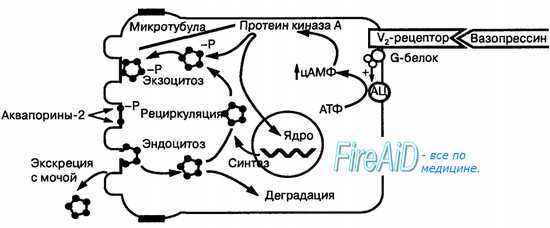
Связывание вазопрессина с V2-рецептором на базолатеральной мембране через мембранный G-белок активирует аденилатциклазу (АЦ), что ведет к образованию вторичного посредника — цАМФ. Последний через активацию протеинкиназы А вызывает фосфорилирование молекул аквапоринов в агрефорах, их взаимодействие с белками микротубул и путем экзоцитоза встраивание аквапоринов в апикальную мембрану. Протеинкиназа А путем активации генома повышает синтез агрефор с аквапоринами. Аквапорины из апикальной мембраны путем эндо-цитоза интернализуются и повергаются рециркуляции или деградации, особенно в отсутствие вазопрессина, а также экскретируются с мочой.
Эффекты вазопрессина реализуются за счет связывания пептида в тканях-мишенях с двумя типами мембранных рецепторов — V1 и V2.
Стимуляция V1-рецепторов, локализованных на мембране эндотелиальных и гладкомышечных клеток стенки кровеносных сосудов, через вторичные посредники инозитол-3-фосфат и кальций-кальмодулин вызывает сужение сосудов, что соответствует названию «вазопрессин». Это влияние в физиологических условиях выражено слабо из-за низких концентраций гормона в крови, но играет существенную роль в изменениях кровообращения при стрессе, шоке, артериальной гипертензии. Через v1-рецепторы вазопрессин повышает чувствительность механорецепторов в каротидных синусах к изменениям артериального давления и этим способствует баро-рефлекторной регуляции артериального давления.
Стимуляция V2-рецепторов базолатеральной мембраны клеток дистальных отделов почечных канальцев через вторичный посредник цАМФ вызывает повышение проницаемости стенки канальцев для воды, ее реабсорбцию и концентрирование мочи, что соответствует второму названию вазопрессина — «антидиуретический гормон». Вазопрессин является единственным гормоном, способным стимулировать канальцевую реабсорбцию воды без задержки натрия. Эффект вазопрессина на транспорт воды связан с особыми транспортными белками «аквапоринами». Только аквапорины 2-го типа являются вазопрессинозависимыми. При наличии в крови гормона вазопрессина (рис. 6.9), он связывается на базолатеральной мембране клеток эпителия почечного канальца с V2-рецептором, следствием чего является активация аденилатциклазы, образование цАМФ, активация протеинкиназы А. Последняя вызывает фосфорилирование молекул аквапори-на-2 в цитоплазматических пузырьках (агрефорах), их транспорт с помощью микротубулярных белков динеина, динактина и миозина-1 к апикальной мембране, где специальные рецепторные молекулы (синтаксин-4, рецепторы-мишени пузырьков и др.) обеспечивают встраивание молекул ак-вапорина-2 в мембрану и формирование водных каналов. Протеинкиназа А является также регулятором синтеза белка аквапорина 2 в ядре клеток эпителия. Поступающая в клетки через водные каналы молекул аквапори-на-2 вода по микротубулярной системе клеток перемещается к базолатеральной мембране, где постоянно встроены вазопресин-независимые белки аквапорины 3-го и 4-го типа. Через них вода выходит в интерстициаль-ную жидкость по осмотическому градиенту (рис. 6.10). В отсутствие вазопрессина молекулы аквапорина-2 подвергаются эндоцитозу (интернализа-ция) в цитоплазму, где вновь способны к рециркуляции, т. е. новому циклу активации, транспорта и встраивания в мембрану, или подвергаются разрушению. Вазопрессин стимулирует всасывание воды и в железах внешней секреции, в желчном пузыре.
Нейропептид вазопрессин поступает по аксонам экстрагипоталамической системы в другие отделы мозга (лимбика, средний мозг) и участвует в формировании жажды и питьевого поведения, механизмах терморегуляции, в нейрохимических механизмах памяти, формировании биологических ритмов и эмоционального поведения.
Вазопрессин стимулирует секрецию кортикотропина в аденогипофизе, подавляет выделение лютропина при стрессе. Метаболические эффекты вазопрессина заключаются в стимуляции гликогенолиза в печени, стимуляции секреции инсулина, повышении синтеза в печени антигемофиличе-ского глобулина А, продукции фактора Виллебрандта.
Недостаток вазопрессина проявляется резко повышенным выделением мочи низкого удельного веса, что называют «несахарным диабетом», а избыток гормона ведет к задержке воды в организме.
Антидиуретический гормон
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Антидиуретический-гормон.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Антидиуретический-гормон.jpg?fit=825%2C550&ssl=1″ />
Антидиуретический гормон поддерживает кровяное давление, объем крови и содержание воды в тканях, контролируя количество воды и, следовательно, концентрацию мочи, выводимой почками.
Альтернативные названия антидиуретического гормона:
Что такое антидиуретический гормон?
Антидиуретический гормон вырабатывается специальными нервными клетками, находящимися в области у основания мозга, известной как гипоталамус. Нервные клетки транспортируют гормон по своим нервным волокнам (аксонам) в гипофиз, где гормон попадает в кровоток.
Антидиуретический гормон помогает контролировать артериальное давление, воздействуя на почки и кровеносные сосуды. Его самая важная роль — сохранить объем жидкости в организме за счет уменьшения количества воды, выделяемой с мочой.
Это достигается за счет того, что вода из мочи попадает обратно в организм в определенной области почек. Таким образом, в кровоток возвращается больше воды, повышается концентрация мочи и уменьшается потеря воды.
Более высокие концентрации антидиуретического гормона вызывают сужение кровеносных сосудов, что увеличивает кровяное давление. Дефицит жидкости в организме (обезвоживание) можно окончательно восстановить только за счет увеличения потребления воды.
Как контролируется антидиуретический гормон?
Высвобождение антидиуретического гормона из гипофиза в кровоток контролируется рядом факторов. Снижение объема крови или низкое кровяное давление, возникающее во время обезвоживания или кровотечения, обнаруживается датчиками (рецепторами) в сердце и крупных кровеносных сосудах. Они стимулируют высвобождение антидиуретических гормонов.
Секреция антидиуретического гормона также происходит, если концентрация солей в кровотоке увеличивается, например, в результате недостаточного питья воды в жаркий день. Это обнаруживается специальными нервными клетками в гипоталамусе, имитирующими высвобождение антидиуретического гормона из гипофиза. Если концентрация солей достигает аномально низкого уровня, это состояние называется гипонатриемией.
Антидиуретический гормон также выделяется при жажде, тошноте, рвоте и боли и поддерживает объем жидкости в кровотоке во время стресса или травмы. Алкоголь препятствует высвобождению антидиуретического гормона, вызывающего увеличение выработки мочи и обезвоживание.
Что произойдет, если у меня будет слишком много антидиуретического гормона?
Что произойдет, если у меня будет слишком много антидиуретического гормона?
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/%D0%A7%D1%82%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%BE%D0%B9%D0%B4%D0%B5%D1%82-%D0%B5%D1%81%D0%BB%D0%B8-%D1%83-%D0%BC%D0%B5%D0%BD%D1%8F-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D1%81%D0%BB%D0%B8%D1%88%D0%BA%D0%BE%D0%BC-%D0%BC%D0%BD%D0%BE%D0%B3%D0%BE-%D0%B0%D0%BD%D1%82%D0%B8%D0%B4%D0%B8%D1%83%D1%80%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B3%D0%BE-%D0%B3%D0%BE%D1%80%D0%BC%D0%BE%D0%BD%D0%B0.jpg?resize=900%2C600&ssl=1″ alt=»Что произойдет, если у меня будет слишком много антидиуретического гормона?» width=»900″ height=»600″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?resize=825%2C550&ssl=1 825w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-антидиуретического-гормона.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Что произойдет, если у меня будет слишком много антидиуретического гормона?
Высокий уровень антидиуретического гормона заставляет почки удерживать воду в организме. Существует состояние, называемое синдромом несоответствующей секреции антидиуретического гормона (SIADH; тип гипонатриемии). При нем избыток антидиуретического гормона выделяется, когда он не нужен (дополнительную информацию см. В статье о гипонатриемии).
При этом состоянии чрезмерная задержка воды разжижает кровь, что приводит к характерно низкой концентрации соли. Чрезмерный уровень антидиуретического гормона может быть вызван побочными эффектами лекарств и заболеваниями легких, грудной клетки, гипоталамуса или гипофиза. Некоторые опухоли (особенно рак легких) могут продуцировать антидиуретический гормон.
Что произойдет, если в организме будет слишком мало антидиуретического гормона?
Низкий уровень антидиуретического гормона заставляет почки выделять слишком много воды. Объем мочи увеличится, что приведет к обезвоживанию и падению артериального давления. Низкий уровень антидиуретического гормона может указывать на повреждение гипоталамуса или гипофиза или на первичную полидипсию (компульсивное или чрезмерное употребление воды).
При первичной полидипсии низкий уровень антидиуретического гормона представляет собой попытку организма избавиться от лишней воды. Несахарный диабет — это состояние, при котором вырабатывается слишком мало антидиуретического гормона (обычно из-за опухоли, травмы или воспаления гипофиза или гипоталамуса) или почки к нему нечувствительны. Несахарный диабет связан с повышенной жаждой и выделением мочи.