Апоптоз что это кратко и понятно
Апоптоз
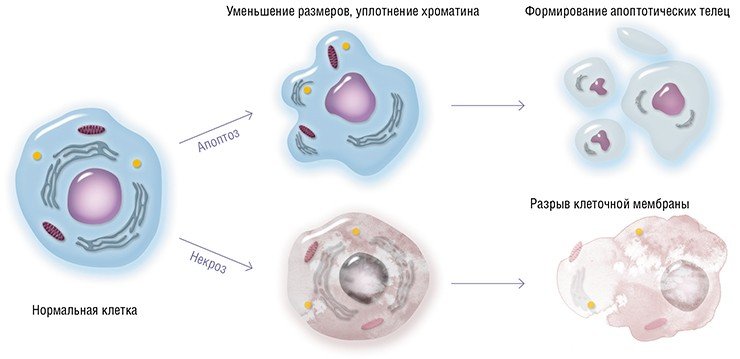
Апоптоз – это гибель клеток организма, запрограммированная генетически. При апоптозе клетки «аккуратно» разбираются и удаляются, впоследствии не развивается воспалительный процесс (в отличие от некроза клеток). Каждый день около 5% клеток организма подвергаются апоптозу, и вместо них образуются новые клетки. Весь процесс гибели клетки в результате апоптоза занимает около 20-120 минут, после истечения этого времени от клетки не остается и следа.
Благодаря этому процессу удаляются дефектные и нежелательные клетки организма, если апоптоз будет снижен, то велик риск развития и роста опухолей.
Некроз – это тоже форма клеточной гибели, но имеет существенные отличия от апоптоза:
Примеры апоптоза:
Внешнее влияние на процесс апоптоза
Внешние факторы действительно могут воздействовать на апоптоз, если они повреждают ДНК. Активируют апоптоз также повреждения клетки, нарушения регуляции клеточного роста, вирусные инфекции. Апоптоз, словно защитный щит, включается при потенциальной угрозе для организма, удаляя поврежденные клетки, которые могут причинить вред.
При этом независимо от причины апоптоза, его конечный путь регулируется только генами, внешние факторы и различные состояние организма могут только влиять на ускорение или замедление начальных стадий апоптоза.
Если в организме наблюдается усиленный апоптоз, то это может провоцировать раннее старение и развитие болезни Альцгеймера. Также доказано, что усиленный апоптоз наблюдается при нейротрофических заболеваниях, СПИДе, некоторых болезнях крови.
Если же апоптоз снижен (из-за избытка белка, ингибирующего апоптоз, или при недостатке гена, который следит за целостностью генома при митозе), то возрастает риск роста клеток злокачественных образований, эти клетки накапливаются, то есть растут и развиваются опухоли.
Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
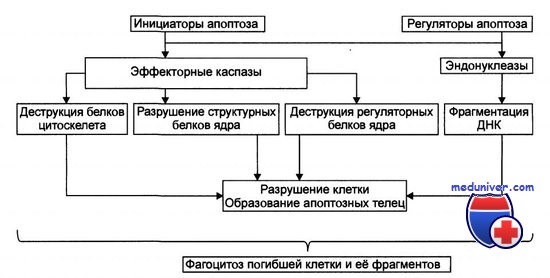
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
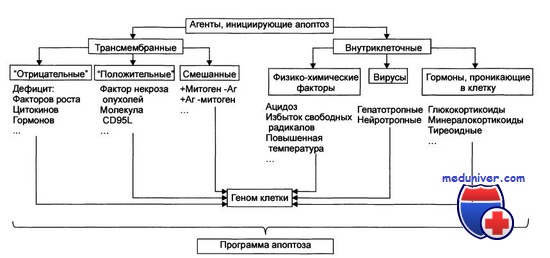
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
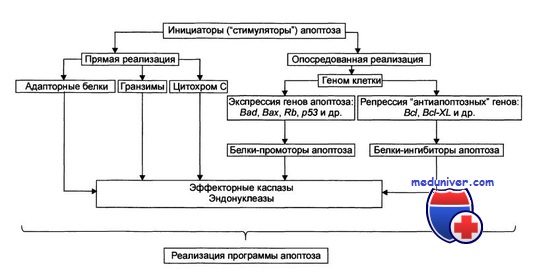
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Литература
Апоптоз что это кратко и понятно
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
На молекулярном уровне при апоптозе происходит саморазрушение генома на мельчайшие фрагменты, осуществляемое ферментами самой клетки; в итоге при электрофорезе образующихся клеточных компонентов в полиакриламидном геле выявляется характерная «лестница» из фрагментов ДНК.
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»
Апоптоз: заказное самоубийство
Само название этого типа клеточной смерти – апоптоз, что в переводе с греческого означает «падающие листья», говорит о том, что он является такой же естественной и неотъемлемой чертой многоклеточного организма, как сезонная смена листвы для деревьев. Апоптоз запускается, когда клетка имеет серьезные повреждения, ведущие к нарушению ее функций: в результате слаженной работы специальных систем, необратимо повреждающих основные клеточные структуры, такая клетка заканчивает жизнь «самоубийством».
Все клетки многоклеточных существ несут в себе потенциальную способность к апоптозу, так же как японские самураи всю жизнь носят с собой меч. И если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности
Регулярная, генетически запрограммированная гибель отдельных клеток необходима для нормального функционирования организма в целом. Все клетки многоклеточных существ обладают аппаратом апоптоза, так же как японские самураи всю жизнь носят с собой меч. Однако у этого естественного процесса есть и обратная сторона: если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими.
Нарушения в запуске апоптоза ведут к возникновению ряда серьезных заболеваний, в том числе аутоиммунных и онкологических. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности.
Ферменты-киллеры
Итак, клетка выполнила свои функции, «постарела» и готова к самоуничтожению во благо всему организму. Кто же выполняет это «заказное» самоубийство?
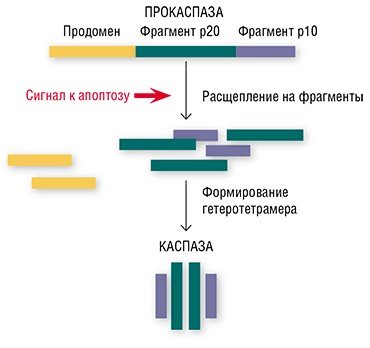
Оказывается, в этом «детективе» про апоптоз имеются и свои затаившиеся киллеры. В этой роли выступают особые ферменты – каспазы, имеющиеся в каждой клетке (Salvesen, 2002; Nicholson, 1999; Lavrik et al., 2005). Обычно каспазы присутствуют в клеточной цитоплазме в виде неактивных предшественников (прокаспаз). Прокаспазы не проявляют никакой активности, мирно сосуществуя в клетке вместе с другими белками, однако при поступлении сигнала на самоуничтожение они превращаются в настоящие белки-убийцы.
«Смена имиджа» безобидных прокаспаз происходит так: белок расщепляется на три фрагмента, один из которых (продомен) отщепляется, а остальные соединяются с двумя аналогичными фрагментами другой прокаспазы. Благодаря такой структурной перестройке образуется активный гетеротетрамер каспазы, в котором аминокислоты формируют центр фермента, выполняющий каталитическую функцию (Salvesen, 2002).
Образовавшиеся активные каспазы наконец показывают свое настоящее лицо: они начинают расщеплять все белки, которые содержат остатки аминокислоты аспарагина (при условии, что рядом располагаются определенным образом остатки еще трех других аминокислот). В результате такой «подрывной» деятельности в клетке оказываются поврежденными сотни белков. К числу наиболее известных мишеней каспаз относятся белки цитоскелета (структурного каркаса клетки); белки, отвечающие за репарацию (восстановление) поврежденной ДНК; структурные белки оболочки клеточного ядра, а также ряд других жизненно важных белков. Все это приводит к нарушению всех процессов жизнедеятельности клетки.
В то же время каспазы активируют ряд белков, которые участвуют в выполнении программы самоликвидации. Например, белка, который разрезает ДНК на большие фрагменты, – этот процесс, после которого целостность ДНК необратимо уничтожается, является характерной чертой апоптоза.
Сигнал на запуск
Но каким же образом клетка узнает, что ей пора самоликвидироваться? Кто и как дает указания киллерам-каспазам?
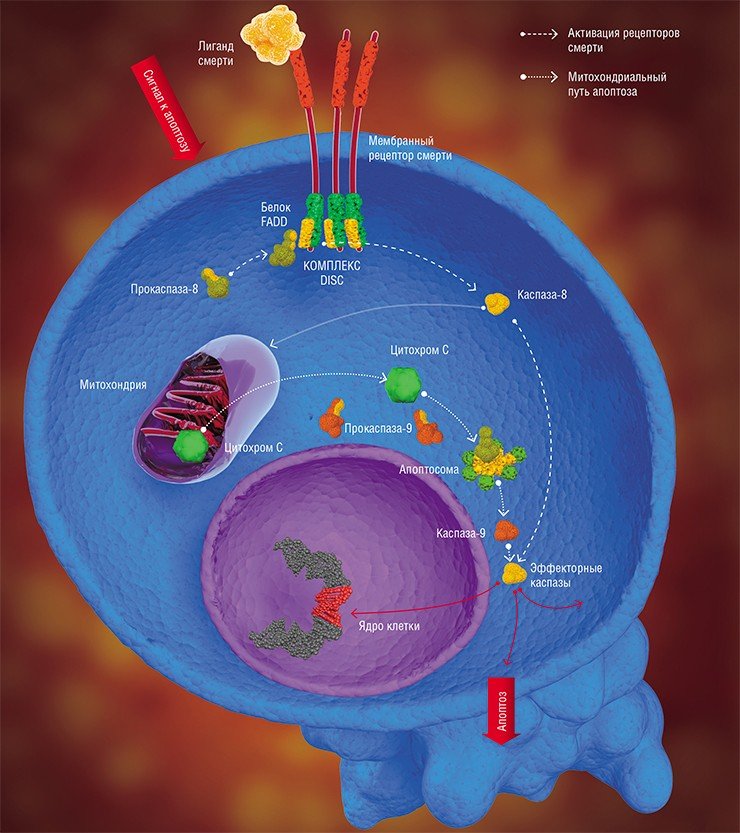
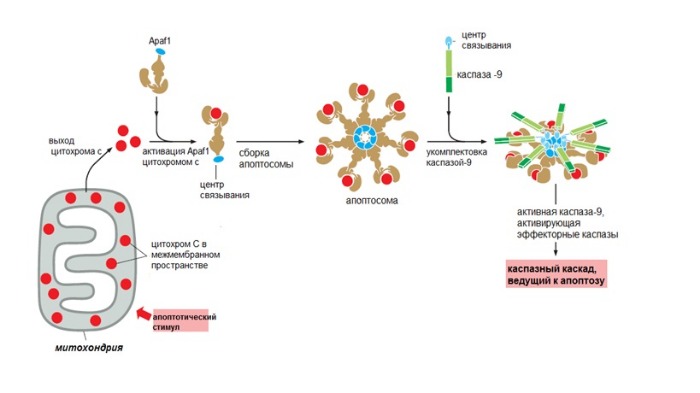
Митохондриальный путь инициируется в результате интенсивного воздействия на клетку ряда повреждающих факторов. Однако каким образом эти повреждения трансформируются в митохондриальный апоптотический сигнал, пока в деталях не установлено. Тем не менее достоверно известно, что первым шагом на этом пути является выход из митохондрий («энергетических фабрик» клетки) цитохрома С – небольшого белка, содержащего комплекс с железом, который является компонентом митохондриальной дыхательной цепи (Green et al., 2004).
Выход цитохрома С инициирует образование в цитоплазме клетки крупного белкового комплекса – апоптосомы, в которую, помимо самого митохондриального белка, входят прокаспаза-9 и белок АПАФ-1. Именно апоптосома и является настоящим «мафиозным боссом» митохондриального пути апоптоза, который дает сигнал киллерам-каспазам.
Речь идет об очень интересном явлении – самоактивации прокаспазы. Такое может произойти лишь в том случае, когда две молекулы этого белка, ориентированные определенным образом относительно друг друга, образуют димер. Именно такие уникальные пространственные условия, необходимые для димеризации и каталитической активации фермента, и предоставляет прокаспазе-9 апоптосома. Образовавшаяся в результате активная каспаза-9 расщепляет эффекторные каспазы (каспазу-3 и каспазу-7), а дальше все происходит по стандартной схеме апоптоза (Green et al., 2004).
В случае рецептор-зависимого сигнального пути инициация апоптоза начинается с другого белкового комплекса, который образуется непосредственно на самом рецепторе смерти (Krammer et al., 2007; Lavrik et al., 2005).
К настоящему времени семейство таких рецепторов включает шесть представителей, в том числе рецептор такого широко известного белка, как фактор некроза опухоли. Все рецепторы смерти имеют одинаковый фрагмент из 80 аминокислот – так называемый домен смерти, расположенный на белковом «хвостике», выходящем в цитоплазму клетки. Такой же аминокислотный фрагмент имеет и белок-адаптер FADD, находящийся в цитоплазме клетки. Домены смерти могут взаимодействовать между собой с образованием устойчивой связи; FADD, в свою очередь, способен присоединять к себе прокаспазу.
Вся цепь событий по образованию апоптотического комплекса запускается лигандом смерти – белком-агонистом, способным специфично связываться с рецептором смерти. Синтез (и, соответственно, рост концентрации) таких молекул в клетке стимулируется каскадом процессов, возникающих в ответ на повреждение клетки. В результате, благодаря посредничеству FADD, на рецепторе образуется комплекс DISC (от англ. death-inducing signaling complex), что в дословном переводе означает «сигнальный комплекс, инициирующий гибель». Именно в этом комплексе, как и в апоптосоме, происходит самоактивация прокаспазы-8, которая, в свою очередь, активирует эффекторные каспазы (каспазу-3 и каспазу-7) и инициирует клеточную гибель (Lavrik et al., 2005; Krammer et al., 2007). Собственно говоря, на этом различия между запуском двух сигнальных путей апоптоза заканчиваются.
Жить или не жить?
Нужно отметить, что любая клетка организма постоянно подвергается многочисленным повреждающим воздействиям, таким как радиационное излучение разных типов, разнообразные химические агенты, недостаток питательных веществ и т. п. К счастью для нас, для полноценной инициации клеточной гибели необходимо сравнительно сильное воздействие. На страже апоптотических путей стоят специфические механизмы, играющие роль «регулировщиков движения». Эту роль играют особые белки XIAPs и FLIP (Lavrik et al., 2005).
Белки XIAPs ингибируют каспазу-9, которая активируется вследствие развертывания митохондриального пути. Связываясь с активным центром каспазы, они не дают «киллеру» выполнять свою работу. Однако с помощью этих белков клетке удается заблокировать лишь небольшое число активных каспаз. Если же концентрация активных каспаз превышает некий пороговый уровень, то белков XIAPs становится недостаточно, и процесс апоптоза остановить уже невозможно.
В случае рецепторзависимого сигнального пути апоптоза ингибитором активации прокаспазы-8 служит близкий ей по структуре белок FLIP. Молекулы этого белка также могут связываться с апоптическим комплексом DISC, конкурируя за «место» с молекулами прокаспазы, – при повышенной концентрации в цитоплазме они блокируют все возможные «места» такого связывания (Krammer et al., 2007). В результате прокаспаза-8 не может быть активирована, и апоптоз не запускается.
Нарушения в уровне экспрессии как про- так и антиапоптотических белков может привести к серьезным отклонениям от обычного образа жизни клетки. Так, повышенный уровень экспрессии белков XIAPs и FLIP имеют многие раковые клетки. Выбрав курс на собственное бессмертие, в конечном счете они приводят к гибели все многоклеточное «сообщество» организма.
Итак, в отличие от голливудского детектива, в истории про апоптоз нет главного действующего лица: своевременное уничтожение поврежденных клеток и в итоге – жизнеспособность организма зависит от слаженной цепочки событий, в которой участвует множество различных белковых молекул.
И здесь очень важны количественные показатели, такие как концентрация. Сегодня изучением того, как влияет на инициацию и дальнейший ход апоптоза уровень содержания в клетке различных молекул, занимается одна из передовых областей современной науки – системная биология (Bentele et al., 2004). Основной ее постулат заключается в том, что протекание сложных процессов внутри клетки можно понять, лишь учитывая максимально большое число клеточных параметров. Для этого на основе экспериментальных данных создается компьютерная модель, которая учитывает действие множества факторов. Полученные таким образом предсказания о ходе основных клеточных процессов могут использоваться в борьбе с препятствиями человечества на пути к долгой и здоровой жизни.
Lavrik I. N., Golks A., Krammer P. H. Caspases: Pharmacological manipulation of cell death // J. Clin. Invest. 2005. V. 115, N 10. P. 2665—2672.
Krammer P. H., Arnold R., Lavrik I. N. Life and death in peripheral T cells // Nat. Rev. Immunol. 2007. V. 7. P. 532—542.
Green D. R. and Kroemer G. The pathophysiology of mitochondrial cell death // Science. 2004. V. 305. P. 626—629.
Еще раз об апоптозе
Каждый день в организме погибает большое количество клеток, а на смену им образуется равное количество новых: таково условие для поддержания клеточного гомеостаза. Удалить необходимо ненужные, старые и потенциально опасные. Одним из известных механизмов клеточной гибели является апоптоз, представляющий собой программируемый процесс.
Когда активируется апоптоз?
Физиологические ситуации:
Патологические ситуации:
Внутриклеточный протеолитический каскад
Активируют апоптоз внутриклеточные ферменты — каспазы (caspases). Они относятся к классу протеолитических ферментов (протеазы), так как расщепляют пептидные связи в белках. Буква «с» в «caspases» указывает на то, что в активном центре протеаз находится аминокислота цистеин, «asp» — на то, что расщепление последовательности аминокислот происходит после остатка аспарагиновой кислоты. Каспазы в клетке находятся в неактивной форме (в виде проферментов) и активируются только в процессе апоптоза.
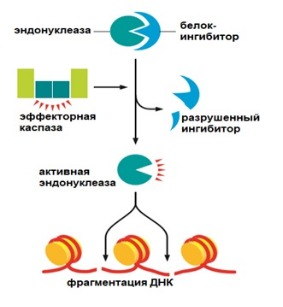
Каспазами разрушается множество белков, среди которых белки ядерной пластинки и белок-ингибитор активности эндонуклеазы. Расщепление последнего ведет к тому, что эндонуклеаза начинает разрезать ДНК. Разрушаются белки цитоскелета и клеточной адгезии, которые соединяют клетки друг с другом. Такой каспазный каскад необратим.
Рисунок 1 | Разрушение каспазой ингибитора эндонуклеазы и последствия. Апоптоз может протекать по двум различным путям — по внешнему и внутреннему (митохондриальному)
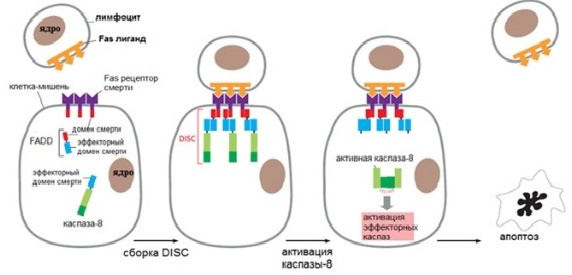
Внешний путь апоптоза
Этот путь запускается при связывании лиганда с рецептором смерти, находящимся на плазматической мембране различных клеток. Рецепторы смерти (death receptors — DR) бывают нескольких видов: TNF-R1, FAS (CD95), DR3, TRAIL-R1, TRAIL-R2 и др. Все они трансмембранные белки, содержащие внеклеточную часть — лиганд-связывающий домен — и внутриклеточную часть — домен смерти.
Существует ингибиторный белок, ограничивающий внешний путь. Этот белок называется FLIP. Он похож на инициаторную каспазу, но не обладает ее функцией. FLIP с каспазой-8 образует DISC, однако каспаза-8 не становится активной и апоптотический сигнал блокируется. Этот тормозный механизм помогает предотвратить нежелательную активацию внешнего пути.
Рисунок 2 | Внешний путь апоптоза
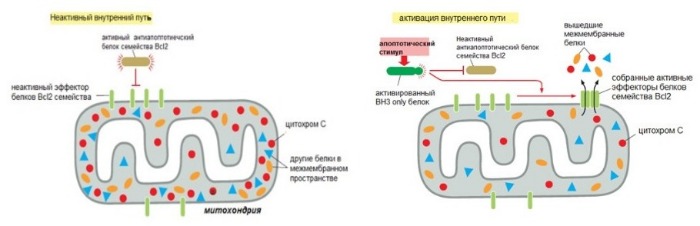
Внутренний путь апоптоза зависит от митохондрий
Этот путь может быть запущен в ответ на повреждение ДНК, активацию онкогенов, избыток Ca 2+ в клетке, отсутствие факторов роста (пептидный или стероидный гормон, стимулирующий рост и дифференцировку клетки), неправильно сложенные белки.
Активация пути ведет к повышению проницаемости наружной мембраны митохондрий. Из-за этого в цитоплазму выходят цитохром c и другие митохондриальные белки, которые инициируют апоптоз.
В норме они находятся в межмембранном пространстве этих органелл. Ключевой белок во внутреннем пути — цитохром с (компонент электрон-транспортной цепи). Выйдя в цитоплазму, он приобретает новые функции и присоединяется к фактору апоптотической протеазы 1 (apoptotic protease activating factor-1 — Apaf1).
Так образуется колесоподобная структура — апоптосома. Апоптосома активирует инициаторные каспазы-9, в свою очередь активирующие эффекторные каспазы, что дает начало апоптозу.
Апоптоз-регулируемый процесс
За внутренний путь апоптоза отвечают белки семейства Bcl2. Они контролируют выход проапоптотических белков из митохондрий (например, цитохром c). Название дано в честь гена белка Bcl2, который сверхэкспрессирован в некоторых лимфомах В-клеток (B cell lymphoma). В это семейство входят более 20 белков, которые могут быть разделены в три группы на основании их функций и количестве гомологичных доменов (Bcl2 Homology).
Первая группа — проапоптотические белки, которые увеличивают выход митохондриальных белков и запуск апоптоза.
Вторая группа — антиапоптотические белки, которые подавляют апоптоз, блокируя выход митохондриальных белков. Оба вида могут связываться друг с другом в различных комбинациях, подавляя свои функции. Баланс между активностью двух видов белков определяет, выживет ли клетка или погибнет по внутреннему пути апоптоза.
Антиапоптотическая группа представлена белками Bcl2 и BclXL, которые имеют четыре BH домена (BH1-4). Эти белки находятся на наружной мембране митохондрий и сохраняют ее непроницаемость. Таким образом это предотвращает утечку цитохрома c и других белков.
Проапоптотические белки — Bax и Bak. У них есть три BH домена (BH1-3). После своей активации Bax и Bak повышают проницаемость внешней мембраны митохондрий. Возможно, это происходит путем образования канала, что позволяет белкам выходить из межмембранного пространства в цитоплазму. Bak даже в отсуствие апоптотического сигнала связан с наружной мембраной митохондрий, а Bах локализован в цитозоле и транспортируется к митохондрии только после апоптотического сигнала.
Третья группа содержит (тоже проапототические) белки Bad, Bim, Bid, Puma и Noxa. Они имеют один BH домен (BH3), третий из четырех доменов BH, поэтому и получили название BH3 only proteins. Белки BH3-only играют ключевую роль в регулировании и стимулировании апоптоза и, таким образом, служат привлекательной целью терапевтического вмешательства. Следует отметить, что BH3 домен является единственным общим доменом для всех членов семейства Bcl2. Он опосредует взаимодействия между проапоптотическими и антиапоптотические белками.
Как происходит регуляция?
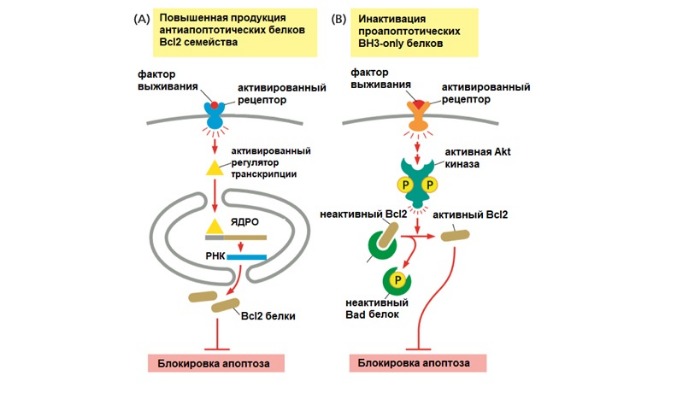
Факторы роста и другие сигналы выживания стимулируют выработку антиапоптотических белков. Они ингибируют апоптоз путем связывания проапоптотических белков на митохондриальной мембране. BH3-only белки, напротив, нейтрализуют активность антиапоптотических белков, таким образом способствуя собиранию проапоптотических белков Вах и Вак на поверхности митохондрии. Это приводит к выходу митохондриальных белков наружу.
Знаменитый белок р53 часто называют «стражем генома», потому что он в ответ на повреждение ДНК запускает апоптоз. Если повреждения не могут быть исправлены, белок р53 (опухолевый супрессор) накапливается в клетке и активирует транскрипцию генов, кодирующих BH3-only белки Puma и Noxa. Также p53 действует на митохондрии и взаимодействует с антиапоптотическим белком Bcl-xL.
Белок ВН3-only Bid связует оба пути апоптоза. В норме он неактивен. Но при активации внешнего пути каспаза-8 переводит белок Bid в активную форму. Bid перемещается к наружной мембране митохондрии и ингибирует антиапоптотические белки, тем самым увеличивая сигнал смерти.
Рисунок 4 | Схема регуляции внутреннего пути апоптоза
Другие способы регуляции
Клетка использует надежные механизмы от ненужной активации каспаз. Например, защитником служит семейство белков-ингибиторов апоптоза (inhibitors of apoptosis — IAPs). У человека они представлены следующими видами: cIAP1 (BIRC2), cIAP2 (BIRC3), X-связанный IAP (XIAP) и др.
И еще о факторах выживания
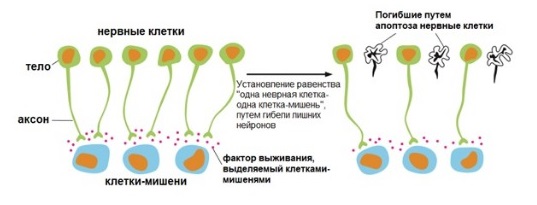
Межклеточные сигналы регулируют деятельность клеток, в том числе и апоптоз. Необходим контроль, гарантирующий, что отдельные клетки ведут себя во благо всего организма, в противном случае их нужно удалить. Например, сигнальные белки, такие как Fas-лиганд, активируют рецепторы смерти и тем самым инициируют внешний путь апоптоза. Напротив, существуют факторы выживания — внеклеточные сигнальные молекулы, которые ингибируют апоптоз. Некоторые клетки требуют непрерывной сигнализации от других клеток, чтобы выживать. И это, по-видимому, помогает обеспечить жизнь только нужных клеток.
Гибель нервной ткани
Рисунок 6 | Роль факторов выживания в гибели лишних нервных клеток
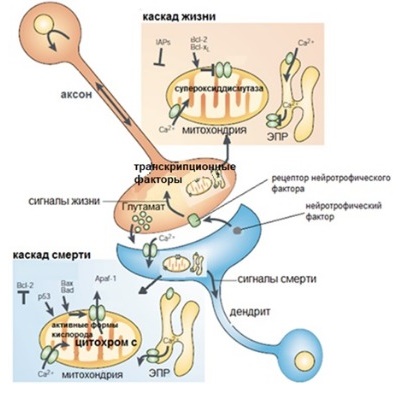
Каскады жизни и смерти
Каскад жизни
Факторы выживания для нейронов называются нейротрофическими факторами. Активация рецепторов нейротрофических факторов на пресинаптической мембране аксона приводит к увеличению факторов транскрипции, которые отвечают за образование антиапоптотических белков (Bcl-2, Bcl-xL), супероксиддисмутазы (подавляет повреждение клетки в результате окисления) и белков-ингибиторов апоптоза (IAP).
Каскад смерти
Рисунок 7 | Каскады жизни и смерти
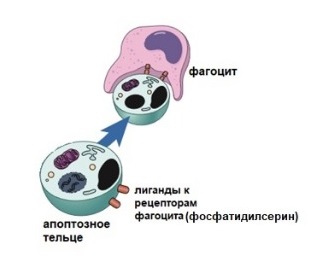
Как убрать апоптотическую клетку?
Апоптоз — очень аккуратный процесс клеточной смерти. Апоптотическая клетка и ее фрагменты не разрываются и не выделяют свое содержимое, а вместо этого остаются нетронутыми. Они съедаются без следов, поэтому воспалительного ответа нет. Апоптотическую клетку поглощают фагоциты. Процесс поглощения зависит от наличия химических изменений на поверхности мембраны клетки.
К таким изменениям относится наличие фосфатидилсерина, который служит сигналом для фагоцитарных клеток. Этот фосфолипид обычно расположен только на внутренней поверхности плазматической мембраны, а при апоптозе переворачивается на наружную поверхность. Макрофаги не фагоцитируют здоровые клетки, хотя у здоровых клеток на их поверхности есть некоторый фосфатидилсерин.
Но здоровые клетки имеют еще и такие сигнальные белки на их поверхности, которые блокируют фагоцитоз. Таким образом, помимо наличия сигналов, таких как фосфатидилсерин, которые стимулируют фагоцитоз, апоптотические клетки должны инактивировать сигналы типа «не ешь меня», блокирующие фагоцитоз.
Рисунок 8 | Фагоциты удаляют апоптотическую клетку или ее части
Уклонение от апоптоза
Нарушение механизма клеточной смерти ключевой признак онкологического заболевания. Опухолевые клетки могут использовать различные механизмы для подавления апоптоза и приобретения устойчивости к апоптотическим агентам. Например, может наблюдается повышенная экспрессия антиапоптотических белков (Bcl-2) или мутации в генах проапоптотических белков (Вах).
Дефекты апоптоза могут позволить эпителиальным клеткам выживать во взвешенном состоянии без прикрепления к внеклеточному матриксу, что способствует метастазированию. Они также способствуют устойчивости перед цитолитическими Т-клетками и натуральными киллерами (NK), атакующими опухоли. Эти дефекты играют важную роль в устойчивости к лечению химиотерапией и лучевой терапией, увеличивая порог смерти клеток и требуя более высоких доз агентов, убивающих опухоль.
Успешное удаление раковых клеток с помощью нехирургических средств в конечном итоге достигается путем индукции апоптоза. Все цитотоксические противораковые средства, которые в настоящее время используются в клинических целях, вызывают апоптотическую гибель злокачественных клеток.
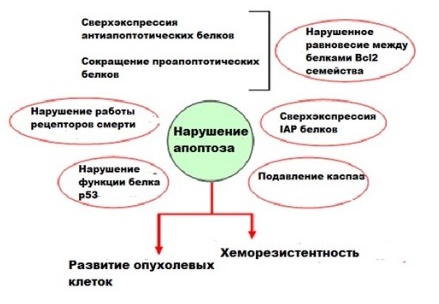
Рисунок 9 | Схематическое представление различных способов, из-за которых апоптотические пути могут быть нарушены
Терапия онкологических заболеваний и апоптоз
Ингибирование апоптоза лежит в основе развития всех опухолей. А значит, наиболее очевидной стратегией лечения является нацеленность на причины, которые подавляют гибель клеток. Для преодоления антиапоптотического эффекта белков Bcl-2 и Bcl-xL в опухолевых заболеваниях существует три стратегии:
Стратегия первая
Некоторые стероиды и ретиноиды активируют транскрипционные факторы, которые регулируют синтез мРНК. Они представляют собой потенциально «лекарственные» модуляторы транскрипции гена Bcl-2 и Bcl-xL. Например, экспрессия Bcl-2 зависит от эстрогена в молочной железе.
Следовательно, антиэстрогены, такие как тамоксифен, ингибируют экспрессию Bcl-2 в клеточных линиях рака молочной железы, способствуя развитию чувствительности к цитотоксическим противоопухолевым препаратам, таким как доксорубицин.
Стратегия вторая
Антисмысловые олигонуклеотиды — цель на мРНК. Антисмысловые олигонуклеотиды (Antisense oligonucleotides) представляют собой короткие последовательности одноцепочечной ДНК, которые могут связываться с мРНК, что сопровождается ее разрушением.
Модификация искусственных нуклеотидов делает нуклеотидную цепь устойчивой к расщеплению нуклеазами и повышают период полувыведения в организме. В данном случае использовалось добавление фосфоротиоата (PS) в основную цепь (замена одного из кислородных остатков фосфатной цепи на серу)
Стратегия третья
BH3 миметики — это вещества, связывающиеся с рецепторами белков, на которые действуют сами BH3. Они необходимы для активации апоптоза. Эти белки нейтрализуют антиапоптотическое белки Bcl2 или активируют Bak и Bax. Разработаны BH3-имитирующие молекулы, выполняющие те же функции, что и BH3 белки.
Например, вещество ABT-737, которое ингибирует Bcl2-белки. BH3-белки, взаимодействуют с длинной гидрофобной канавкой в белке Bcl2, тем самым инактивируя последние. Препарат ABT-737 был спроектирован с помощью кристаллической структуры этой канавки.
Р53 в качестве лекарственной цели
Ген белка р53 отключен из-за мутаций примерно у 50% всех злокачественных опухолей. Повышение производства белка р53 в клетке может быть методом противораковой терапии. В нормальных клетках белок p53 обычно поддерживается на низком уровне, поскольку он подвержен ингибированию белком MDM2. В ответ на повреждения ДНК p53 видоизменяется.
Это позволяет ему избежать контроля MDM2 и начать накапливаться в клетке. Содержание гена MDM2 увеличено в некоторых типах опухолей, поэтому активного белка р53 становится меньше. Взаимодействие между p53 и MDM2 является мишенью в противораковой терапии. С этой целью были разработаны препараты, которые блокируют белок-белковые взаимодействия. Среди них Nutlin-3, ингибирующий взаимодействие p53/MDM2.
Большая часть того, что известно об апоптозе, стала понятна только недавно. Основная идея разработки терапевтических препаратов для лечения рака основана на том факте, что поврежденные клетки обычно встают на путь апоптоза, поддерживая нормальное для ткани количество клеток. Однако это явление сильно нарушается в раковых клетках. Обнаружение ключевых участников апоптоза и их взаимодействие с другими значимыми участниками создает условия для поиска новых методов терапии рака.