Азитромицин или цефтриаксон что лучше при ангине
А-СТРЕПТОКОККОВЫЙ ТОНЗИЛЛИТ: клиническое значение, вопросы антибактериальной терапии
Что подразумевают под острым тонзиллитом? Почему при БГСА-тонзиллите необходима антибактериальная терапия? Какие антибактериальные средства выбрать? Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного ил
Что подразумевают под острым тонзиллитом?
Почему при БГСА-тонзиллите необходима антибактериальная терапия?
Какие антибактериальные средства выбрать?
Острый тонзиллит (ангина) 1 — заболевание, которое характеризуется острым воспалением одного или нескольких лимфоидных образований глоточного кольца (чаще небных миндалин) и принадлежит к числу широко распространенных инфекций верхних дыхательных путей.
Наиболее значимым бактериальным возбудителем острого тонзиллита является β-гемолитический стрептококк группы А (Streptococcus pyogenes, БГСА). Реже острый тонзиллит вызывают вирусы, стрептококки групп C и G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria (дифтерия), анаэробы и спирохеты (ангина Симановского — Плаута — Венсана), крайне редко — микоплазмы и хламидии.
БГСА передается воздушно-капельным путем. Источниками инфекции являются больные и реже бессимптомные носители. Вероятность заражения увеличивается при высокой степени обсемененности и тесном контакте с больным. Вспышки острого БГСА-тонзиллита чаще всего встречаются в организованных коллективах (в детских дошкольных учреждениях, школах, воинских частях и т. д.). Поражаются преимущественно дети в возрасте 5-15 лет, а также лица молодого трудоспособного возраста. Наибольшая заболеваемость отмечается в зимне-весенний период.
Высокая частота заболевания, контагиозность инфекции, большие трудопотери, влекущие за собой экономический ущерб, возможность развития серьезных осложнений — все это свидетельствует о том, что проблема БГСА-тонзиллита по-прежнему стоит достаточно остро как в научном, так и в практическом аспекте.
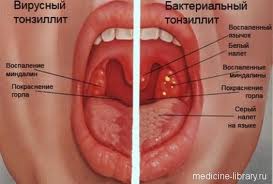
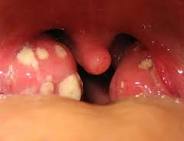
Клиническая картина. Инкубационный период при остром БГСА- тонзиллите составляет от нескольких часов до 2-4 дней. Для этого заболевания характерны острое начало с повышением температуры до 37,5–39°С, познабливание или озноб, головная боль, общее недомогание, боль в горле, усиливающаяся при глотании; нередки артралгии и миалгии. У детей могут быть тошнота, рвота, боли в животе. Развернутая клиническая картина наблюдается, как правило, на вторые сутки с момента начала заболевания, когда общие симптомы достигают максимальной выраженности. При осмотре выявляется покраснение небных дужек, язычка, задней стенки глотки. Миндалины гиперемированы, отечны, часто с гнойным налетом желтовато-белого цвета. Налет рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечаются уплотнение, увеличение и болезненность при пальпации шейных лимфатических узлов на уровне угла нижней челюсти (регионарный лимфаденит). В анализах крови — повышенный лейкоцитоз (9-12 10 9 /л), сдвиг лейкоцитарной формулы влево, ускорение СОЭ (иногда до 40-50 мм/ч), появление С-реактивного белка. Длительность периода разгара (без лечения) составляет примерно 5-7 дней. В дальнейшем при отсутствии осложнений основные клинические проявления болезни (лихорадка, симптомы интоксикации, воспалительные изменения в миндалинах) быстро исчезают, нормализуется картина периферической крови. Симптомы регионарного лимфаденита могут сохраняться до 10-12 дней.
Диагноз БГСА-тонзиллита подтверждается микробиологическим исследованием мазка с поверхности миндалин и/или задней стенки глотки. При соблюдении правил техники забора образца чувствительность метода достигает 90 %, а специфичность — 95-99 %. Популярные за рубежом методы экспресс-диагностики А-стрептококкового антигена в мазках из зева дают возможность получить ответ через 15-20 мин. В то же время следует подчеркнуть, что культуральный метод не позволяет дифференцировать активную инфекцию от БГСА-носительства, а современные экспресс-тесты, несмотря на их высокую специфичность (95-100%), характеризуются сравнительно низкой чувствительностью (60-80%), то есть отрицательный результат быстрой диагностики не исключает стрептококковой этиологии заболевания.
Дифференциальная диагностика острого БГСА-тонзиллита, основанная только на клинических признаках, нередко представляет собой достаточно трудную задачу даже для опытных врачей. Однако необходимо отметить, что наличие респираторных симптомов (кашля, ринита, охриплости голоса и др.), а также сопутствующие конъюнктивит, стоматит или диарея указывают на вирусную этиологию острого тонзиллита. В отличие от скарлатины для острого БГСА-тонзиллита не характерны какие-либо виды высыпаний на коже и слизистых. При локализованной дифтерии ротоглотки налет с миндалин снимается с трудом, не растирается на предметном стекле, не растворяется в воде, а медленно оседает на дно сосуда; после удаления налета отмечается кровоточивость подлежащих тканей. Ангинозная форма инфекционного мононуклеоза, как правило, начинается с распространенного поражения лимфатических узлов (шейных, затылочных, подмышечных, абдоминальных, паховых), симптоматика тонзиллита развивается на 3-5-й день болезни, при исследовании периферической крови выявляется лейкоцитоз с преобладанием мононуклеаров (до 60-80%). Ангина Симановского — Плаута — Венсана характеризуется слабо выраженными признаками общей интоксикации и явлениями одностороннего язвенно-некротического тонзиллита, при этом возможно распространение некротического процесса на мягкое и твердое небо, десны, заднюю стенку глотки и гортань.
Поскольку БГСА-тонзиллит по своей сути — самокупирующееся заболевание и может заканчиваться полным выздоровлением (даже при отсутствии лечения) без каких-либо осложнений, у некоторых врачей по-прежнему существуют сомнения в отношении тщательности курации таких больных. Совершенно необоснованно отдается предпочтение местному лечению (полосканиям, ингаляциям и др.) в ущерб системной антибиотикотерапии. Подобный подход ни в коей мере не оправдывает себя и может привести к весьма печальным для больного последствиям.
Многочисленные литературные данные свидетельствуют о том, что в конце XX столетия произошли существенные изменения в эпидемиологии БГСА-инфекций верхних дыхательных путей и, что особенно важно, их осложнений, обусловленные «возрождением» высоковирулентных А-стрептококковых штаммов. Так, в середине 1980-х годов в США, стране с наиболее благополучными медико-статистическими показателями, разразилась вспышка острой ревматической лихорадки (ОРЛ), сначала среди солдат-новобранцев на военной базе в Сан-Диего (Калифорния), а чуть позже — среди детей в континентальных штатах (Юте, Огайо, Пенсильвании). Причем в большинстве случаев заболевали дети из семей, годовой достаток в которых превышал средний по стране (то есть имеющих отдельное жилище, полноценное питание, возможность своевременного получения квалифицированной медицинской помощи). Примечательно, что диагноз ОРЛ в большинстве случаев был поставлен с опозданием. Среди наиболее вероятных причин данной вспышки далеко не последнюю роль сыграл и так называемый врачебный фактор. Как справедливо отметил G.H. Stollerman (1997), молодые врачи никогда не видели больных с ОРЛ, не предполагали возможности циркуляции стрептококка в школьных коллективах, не знали об определяющем профилактическом значении пенициллина и часто вообще понятия не имели о том, что при тонзиллитах нужно применять антибиотики. Наряду с этим оказалось, что в половине случаев ОРЛ являлась следствием БГСА-тонзиллита, протекавшего со стертым клиническим симптомокомплексом (удовлетворительное общее состояние, температура тела нормальная или субфебрильная, небольшое чувство першения в глотке, исчезающее через 1-2 дня), когда большинство больных не обращались за медицинской помощью, а проводили лечение самостоятельно без применения соответствующих антибиотиков.
Результаты исследований глоточных культур, выполненных в пораженных ОРЛ-популяциях в конце 1980-х годов, позволяют вести речь о существовании «ревматогенных» БГСА-штаммов, обладающих рядом определенных свойств. Среди них особое значение имеет наличие в молекулах М-протеина эпитопов, перекрестно реагирующих с различными тканями макроорганизма-хозяина: миозином, синовией, мозгом, сарколеммальной мембраной. Указанные данные подкрепляют концепцию молекулярной мимикрии как основного патогенетического механизма реализации стрептококковой инфекции в ОРЛ за счет того, что образующиеся в ответ на антигены стрептококка антитела реагируют с аутоантигенами хозяина. С другой стороны, М-протеин обладает свойствами суперантигена, индуцирующего эффект аутоиммунитета. Приобретенный аутоиммунный ответ может быть в свою очередь усилен последующим инфицированием ревматогенными штаммами, содержащими перекрестно-реактивные эпитопы.
В конце 1980-х — начале 1990-х годов из США и ряда стран Западной Европы стали поступать сообщения о чрезвычайно тяжелой инвазивной БГСА-инфекции, протекающей с гипотензией, коагулопатией и полиорганной функциональной недостаточностью. Для обозначения этого состояния был предложен термин «синдром стрептококкового токсического шока» (streptococcal toxic shock-like syndrome), по аналогии со стафилококковым токсическим шоком. И хотя основными «входными воротами» для этой угрожающей жизни БГСА-инфекции служили кожа и мягкие ткани, в 10-20 % случаев заболевание ассоциировалось с первичным очагом, локализующимся в лимфоидных структурах носоглотки. При анализе инвазивных БГСА-инфекций, проводившемся в США в 1985-1992 годах, было установлено, что кривые заболеваемости ОРЛ и синдромом токсического шока стрептококкового генеза оказались очень схожими как по времени, так и по амплитуде.
На сегодняшний день истинные причины упомянутого «возрождения» высоковирулентной БГСА-инфекции по-прежнему полностью не раскрыты. В связи с этим роль точного диагноза и обязательной антибиотикотерапии БГСА-тонзиллита (в том числе его малосимптомных форм) как в контроле за распространением этих инфекций, так и в профилактике осложнений еще более возросла.
Лечение. Несмотря на то что БГСА по-прежнему сохраняет практически полную чувствительность к β-лактамным антибиотикам, в последние годы отмечаются определенные проблемы в терапии тонзиллитов, вызванных этим микроорганизмом. По данным разных авторов, частота неудач пенициллинотерапии БГСА-тонзиллитов составляет 25-30%, а в некоторых случаях — даже 38%. Одной из возможных причин этого может быть гидролиз пенициллина специфическими ферментами — β-лактамазами, которые продуцируются микроорганизмами — копатогенами (золотистым стафилококком, гемофильной палочкой и др.), присутствующими в глубоких тканях миндалин, особенно при наличии хронических воспалительных процессов в последних.
Как видно из табл. 1, препараты пенициллинового ряда остаются средствами выбора только при лечении острого БГСА-тонзиллита. На сегодняшний день оптимальным препаратом из группы оральных пенициллинов представляется амоксициллин, который по противострептококковой активности аналогичен ампициллину и феноксиметилпенициллину, но существенно превосходит их по своим фармакокинетическим характеристикам, отличаясь большей биодоступностью (95, 40 и 50 % соответственно) и меньшей степенью связывания с сывороточными белками (17, 22 и 80 %). При сомнительной комплаентности (исполнительности) больного, а также в определенных клинико-эпидемиологических ситуациях показано назначение однократной инъекции бензатин-пенициллина.
Феноксиметилпенициллин целесообразно назначать только детям младшего возраста, учитывая наличие лекарственной формы в виде суспензии, а также несколько большую комплаентность, обеспечиваемую благодаря контролю со стороны родителей, чего нельзя сказать о подростках.
Наряду с пенициллинами несомненного внимания заслуживает представитель оральных цефалоспоринов I поколения цефадроксил, высокая эффективность которого в терапии БГСА-тонзиллитов, а также хорошая переносимость подтверждены в ходе многочисленных клинических исследований.
При непереносимости β-лактамных антибиотиков целесообразно назначать макролиды (спирамицин, азитромицин, рокситромицин, кларитромицин, мидекамицин). Наряду с высокой противострептококковой активностью преимуществами этих препаратов являются способность создавать высокую тканевую концентрацию в очаге инфекции, более короткий (в частности, для азитромицина) курс лечения, хорошая переносимость. Применение эритромицина — первого представителя антибиотиков данного класса — в настоящее время существенно сократилось, особенно в терапевтической практике, поскольку он чаще других макролидов вызывает нежелательные эффекты со стороны желудочно-кишечного тракта, обусловленные стимулирующим действием эритромицина на моторику желудка и кишечника.
Следует отметить, что в последние годы из Японии и ряда стран Европы все чаще поступают сообщения о нарастании резистентности БГСА к эритромицину и другим макролидам. На примере Финляндии было показано, что формирование резистентности — процесс управляемый. Широкая разъяснительная кампания среди врачей в этой стране привела к двукратному снижению потребления макролидов и, как следствие, к двукратному уменьшению частоты БГСА-штаммов, устойчивых к упомянутым антибиотикам. В то же время в России резистентность БГСА к макролидам составляет 13-17% (Страчунский Л. С. и др., 1997). И этот факт, несомненно, заслуживает самого серьезного внимания.
Антибиотики-линкозамины (линкомицин, клиндамицин) назначают при БГСА-тонзиллите только при непереносимости как b-лактамов, так и макролидов. Широко применять эти препараты при данной нозологической форме не рекомендуется. Известно, что при частом применении оральных пенициллинов чувствительность к ним со стороны зеленящих стрептококков, локализующихся в ротовой полости, существенно снижается. Поэтому у данной категории пациентов, среди которых немало больных с ревматическими пороками сердца, линкозамины рассматриваются как препараты первого ряда для профилактики инфекционного эндокардита при выполнении различных стоматологических манипуляций.
При наличии хронического рецидивирующего БГСА-тонзиллита вероятность колонизации очага инфекции микроорганизмами, продуцирующими b-лактамазы, достаточно высока. В этом случае целесообразно проведение курса лечения ингибитор-защищенными пенициллинами (амоксициллин/клавуланат) или оральными цефалоспоринами II поколения (цефуроксим — аксетил), а при непереносимости b-лактамных антибиотиков — линкозаминами (табл. 2). Указанные антибиотики рассматриваются также как препараты второго ряда для случаев, когда пенициллинотерапия острого БГСА-тонзиллита оказывается безуспешной (что чаще встречается при использовании феноксиметилпенициллина). Универсальной же схемы, обеспечивающей 100%-ную элиминацию БГСА из носоглотки, в мировой клинической практике не сууществует.
Необходимо отметить, что применение тетрациклинов, сульфаниламидов, ко-тримоксазола и хлорамфеникола при БГСА-инфекции глотки в настоящее время не оправдано по причине высокой частоты резистентности и, следовательно, низких показателей эффективности терапии.
Таким образом, в современных условиях вопросы своевременной и качественной диагностики и рациональной антибиотикотерапии БГСА-тонзиллита сохраняют свою актуальность. Появившиеся в последние годы новые антибактериальные средства существенно расширили возможности антимикробной терапии БГСА-тонзиллита, но полностью данную проблему не решили. В связи с этим многие исследователи возлагают большие надежды на создание вакцины, содержащей эпитопы М-протеинов ревматогенных БГСА- штаммов, не вступающих в перекрестную реакцию с тканевыми антигенами человеческого организма. Такая вакцина, в частности в рамках первичной профилактики ОРЛ, очень необходима в первую очередь лицам с генетическими маркерами, указывающими на предрасположенность к заболеванию.
Назначение антибиотиков при катаральной ангине и неосложненных формах хронического тонзиллита не всегда оправданно, тем более без четкого представления о возбудителе.
На этих стадиях заболевания, еще не отягощенных суперинфекцией, альтернативным лечением может стать гомеопатия. Это регулирующая терапия, воздействующая на процессы саморегуляции с помощью лекарств, подобранных индивидуально с учетом реакции больного. С позиций классической гомеопатии ангина и хронический тонзиллит являются не локальными заболеваниями, а частным проявлениями конституционной слабости и наследственной предрасположенности.
На таких положениях основывается подбор компонентов гомеопатического препарата «Тонзилотрен» компании «Немецкий гомеопатический союз», клинические исследования которого в России показали высокую эффективность и безопасность.
1 В зарубежной литературе широко используются взаимозаменяемые термины «тонзиллофарингит» и «фарингит».
Азитромицин или цефтриаксон что лучше при ангине
Ангина или Острый тонзиллит. Когда нужен антибиотик?
Что такое ангина?
Начнем с определения. То, что раньше называлось ангиной (фолликулярной и лакунарной), по новой классификации носит определение «острый тонзиллит».
Острый тонзиллит – это бактериальное воспаление глоточных миндалин. Для формирования этого воспаления необходимо, чтобы миндалины в своем развитии дошли до определенной стадии.
Новорожденные не имеют такой развитой лимфоидной ткани, как дети более старшего возраста, поэтому бактериального тонзиллита у них не бывает. Раньше считалось, что с острым тонзиллитом дети не сталкиваются до трех лет (именно в этом возрасте миндалины начинают развиваться очень быстро, что и является фактором риска развития ангины). Однако на сегодняшний день специалисты отмечают, что острые тонзиллиты «молодеют» и встречаются у детей в возрасте полутора–двух лет, а иногда даже и раньше.
Причины возникновения тонзиллита
Причиной возникновения острого тонзиллита являются бактерии (это принципиальное отличие данного заболевания от вирусной инфекции, например, фарингита,
при котором основным симптомом является «красное горло»).
Среди бактерий, вызывающих тонзиллит, чаще всего встречается гемолитический стрептококк (70 – 80% случаев), реже – стафилококк и др.
Для того чтобы развилась ангина, обычно нужны два фактора: массивное поступление микроба извне и местное локальное переохлаждение.
Массивное поступление микробов извне в большинстве случаев связано с непосредственным контактом с больным в острой или субклинической форме человеком, который выделяет в окружающую среду большое количество стрептококка (это могут быть больные ангиной, скарлатиной и любыми другими стрептококковыми формами инфекции). Однако, в отличие от вирусной инфекции, стрептококк на большие расстояния не распространяется, поэтому заразиться в общественном транспорте, магазине и т.д. практически невозможно. Для инфицирования необходим тесный контакт. Чаще всего – это внутрисемейные контакты, например, поцелуи, использование членами семьи общих игрушек, предметов обихода (при условии, что на эти предметы попадает слюна).
Местное локальное переохлаждение. У некоторых людей стрептококк «живет» на миндалинах и в состоянии полного здоровья, не вызывая никаких клинических проявлений. Возникает это при «равновесии» сил микроба и иммунитета. Называется данное состояние заболеванием в субклинической форме (раньше называлось «носительством»). Когда же происходит серьезное локальное переохлаждение – употребление очень холодного питья или пищи, облизывание сосулек, поедание снега – происходит снижение иммунитета. В результате собственный стрептококк размножается, и мы получаем клиническую картину острого тонзиллита во всей красе.
Симптомы тонзиллита
Начинается острый тонзиллит, как правило, с резкого подъема температуры тела и выраженного нарушения самочувствия. В отличие от вирусной инфекции (когда при понижении температуры ребенку становится легче), при бактериальных инфекциях в первые несколько дней нарушение самочувствия сохраняется даже после снижения температуры.
Обязательным условием острого тонзиллита является появление на миндалинах гнойного налета. Он может быть как точечным, в виде гнойничков, так и сплошным, полностью покрывающим миндалины.
Лечение тонзиллита
Лечение данного заболевания требует обязательного врачебного контроля, так как тонзиллит – это бактериальная инфекция и лечится она с применением антибактериальных препаратов. Курсы приема антибиотиков довольно длительные – 7–10 дней. Очень важно выдерживать полный курс приема препаратов, даже несмотря на возможное быстрое восстановление хорошего самочувствия. Бактерию нужно антибиотиком уничтожить полностью. Если этого не произойдет, возможны рецидивы заболевания и очень высок риск развития осложнений.
Кроме того, в лечении тонзиллитов часто используются самые различные варианты полосканий антисептическими растворами (йода, соли и пищевой соды, отваром ромашки и т.д.). Цель полосканий состоит в том, чтобы снять с миндалин налет, вымыть из лакун (углублений) миндалин все содержимое и, тем самым, ускорить выздоровление.
При повышенной температуре тела используются жаропонижающие препараты, рекомендуется теплое обильное питье. Важным моментом лечения ангины является соблюдение строгого постельного режима весь лихорадочный период. То есть пока у ребенка держится повышенная температура тела, категорически запрещаются прогулки на улице, подвижные игры. Несоблюдение постельного режима, как и несоблюдение длительности курса приема антибиотиков, очень часто приводит к осложнениям.
Для того чтобы проконтролировать появление осложнений и эффективность антибактериальной терапии в начале и в конце лечения острого тонзиллита обязательно проводится ряд лабораторных исследований. Это общий анализ крови и общий анализ мочи, а в конце лечения – дополнительно к ним назначаются электрокардиограмма и биохимический анализ крови.
Если у ребенка зафиксировано выздоровление (т.е. нормальная температура, нормальные анализы крови), то через несколько дней после окончания курса лечения возможно посещение детского дошкольного или школьного учреждения, но с обязательным ограничением физических нагрузок в течение двух недель.
При остром тонзиллите нет выраженных ограничений в питании, за исключением того, что пища не должна травмировать воспаленные миндалины (твердую пищу типа сушек, сухарей, печенья лучше исключить). Конечно, обязательно обильное питье для дезинтоксикации организма. В зависимости от возраста и массы тела ребенка существуют рекомендованные объемы жидкости, которые в период заболевания, как правило, должны быть увеличены на 30%.
Осложнения тонзиллита
Острые стрептококковые тонзиллиты страшны своими осложнениями. При стрептококковых инфекциях основная группа осложнений – это так называемые ревматоидные заболевания (заболевания соединительной ткани), которые вызывают поражение клапанного аппарата сердца с формированием пороков сердца и поражение почек с формированием гломерулонефритов и возможной почечной недостаточностью.
Профилактика тонзиллита
Меры профилактики бактериального тонзиллита логически вытекают из факторов, которые вызывают данное заболевание:
Директор ЧУП “Дечко и К” (торговый знак “Добрый Доктор”), врач первой категории А.В.Дечко.
Беседу вела корреспондент журнала «Малышок»
Современные тенденции применения азитромицина при остром стрептококковом тонзиллофарингите и остром среднем отите: короткие курсы, высокие дозы
Инфекции дыхательных путей (ИДП) являются одними из наиболее распространенных заболеваний у взрослых и самыми частыми у детей. По данным ВОЗ, частота ИДП у детей младше 5 лет составляет, в среднем, от 4 до 9 эпизодов в год [1].
Инфекции дыхательных путей (ИДП) являются одними из наиболее распространенных заболеваний у взрослых и самыми частыми у детей. По данным ВОЗ, частота ИДП у детей младше 5 лет составляет, в среднем, от 4 до 9 эпизодов в год [1]. В целом, 60% всех обращений к педиатрам связаны с ИДП [2]. Поскольку значимая доля пациентов не обращаются за медицинской помощью, реальный уровень заболеваемости ИДП еще выше. Однако ИДП — это не только медицинская, но и значимая экономическая проблема. Экономический ущерб, причиняемый ИДП, является колоссальным — так, ежегодные экономические затраты на терапию ИДП (исключая грипп) приближаются к 40 млрд долларов США, при этом прямые медицинские затраты (посещение врача, вызовы неотложной помощи, стоимость назначенного лечения) составляют 17 млрд долларов, а непрямые (пропущенные дни учебы и рабочие дни) — 22,5 млрд долларов США [3]. В связи с этим все большее внимание врачей привлекает возможность быстрого излечения пациентов с ИДП с использованием антибактериальных препаратов (АБП), которые можно применять короткими курсами. Кроме того, за последнее десятилетие наметилась тенденция использования более высоких доз АБП при лечении инфекций не только в стационарах, но и в амбулаторной практике. Основанием для этого является необходимость достижения высоких концентраций препарата в очаге инфекции, эффективных не только против высокочувствительных штаммов, но и против штаммов, обладающих определенными механизмами устойчивости к АБП, а главное — стремление предотвратить селекцию резистентных штаммов, происходящую при терапии субоптимальными дозами антибиотиков. Однако использование высоких доз возможно только при назначении безопасных АБП, не имеющих серьезных дозозависимых нежелательных лекарственных реакций (гепатотоксичности, кардиотоксичности и т. д.).
Азитромицин — первый представитель группы полусинтетических 15-членных макролидных антибиотиков (азалидов) — применяется в клинической практике с 1991 г. и является одним из наиболее часто назначаемых препаратов во многих странах мира. В настоящее время азитромицин одобрен Администрацией США по продуктам питания и лекарственным средствам (Food and Drug Administration — FDA) для использования у взрослых и детей старше 6 месяцев для лечения инфекций, вызванных чувствительными к нему возбудителями, в том числе ИДП [4].
Рекомендованные в мире режимы применения азитромицина при ИДП (остром стрептококковом тонзиллофарингите, остром среднем отите, остром бактериальном синусите, внебольничной пневмонии) и у детей, и у взрослых основаны на результатах рандомизированных контролируемых сравнительных клинических исследований. Необходимо подчеркнуть, что все исследования, послужившие основой для определения оптимальных режимов дозирования азитромицина, проводились с использованием оригинального препарата (Сумамед ® в Европе и Зитромакс ® в США), поэтому недопустимо переносить данные о его эффективности и безопасности на дешевые дженерики сомнительного качества, не имеющие доказательств биоэквивалентности и терапевтической эквивалентности с оригинальным препаратом.
В данной публикации предпринята попытка обобщить имеющиеся на настоящий момент сведения, касающиеся возможностей использования коротких курсов азитромицина при остром стрептококковом тонзилофарингите и остром среднем отите, а также выбора оптимального режима дозирования азитромицина при данных нозологических формах.
Острый тонзиллофарингит
Наиболее частыми этиологическими агентами острого тонзиллофарингита являются вирусы (риновирусы, доля которых в этиологической структуре составляет 20%, коронавирусы — более 5%, аденовирусы — около 5%, вирусы парагриппа и др.) и стрептококки, а именно бета-гемолитический стрептококк группы А (БГСА) (Streptococcus pyogenes) — 15–30%, бета-гемолитические стрептококки групп С и G (5–10%), в редких случаях встречается смешанная аэробно-анаэробная флора, другие бактериальные патогены — Neisseria gonorrhoeae, Corynebacterium diphtheriae, Arcanobacterium haemolyticum (ранее Corynebacterium haemolyticum), Yersinia enterocolitica, Treponema pallidum, Chlamydophila pneumoniae, Mycoplasma pneumoniae [5]. В 30% случаев этиологию острого тонзиллофарингита установить не удается.
Известно, что БГСА — единственный распространенный возбудитель тонзиллофарингита, при выделении которого показана антимикробная терапия, причем целью назначения АБП является не только устранение симптомов тонзиллофарингита, а, прежде всего, эрадикация БГСА из ротоглотки и профилактика возникновения поздних иммуноопосредованных осложнений (острой ревматической лихорадки и острого гломерулонефрита) [6]. Учитывая универсальную чувствительность БГСА к бета-лактамам, препаратами выбора в терапии БГСА-тонзиллофарингита являются пенициллины, при наличии в анамнезе аллергических реакций на бета-лактамы — макролиды и линкозамиды [7]. Следует отметить, что по данным исследования ПеГАС-I в 2001–2003 гг. устойчивость БГСА к макролидам в России (в отличие от многих стран Европы Азии и США) составляет не более 8%, т. е. макролиды сохраняют свою активность [9].
В последние годы появился целый ряд сообщений о случаях неэффективности пенициллина для эрадикации S. pyogenes со слизистой миндалин и задней стенки глотки, частота которых может достигать 30–40% [10–12]. В 2001 г. были опубликованы объединенные данные двух рандомизированных простых слепых многоцентровых исследований эффективности применения пенициллина (феноксиметилпенициллина или бензилпенициллина) в рекомендуемых дозах при лечении БГСА-тонзиллофарингита у детей [10]. Оказалось, что, несмотря на 100% чувствительность пиогенного стрептококка к пенициллину, микробиологическая неэффективность (отсутствие эрадикации БГСА из носоглотки на 10–14 или 29–31 день) отмечалась у 35% пациентов, получавших феноксиметипенициллин, и у 37% пациентов, получавших бензилпенициллин [10].
Среди наиболее часто упоминаемых причин неудачной эрадикации БГСА отмечают: 1) низкую комплаентность 10-дневных курсов пенициллина; 2) повторное заражение стрептококками от инфицированных членов семьи; 3) разрушение пенициллина ко-патогенами полости рта; 4) недостаточное проникновение антибиотика в ткань миндалин; 5) использование контаминированных зубных щеток, протезов; 6) передачу БГСА от домашних животных (кошек, собак); 7) явления толерантности стрептококков к пенициллину [12, 13].
Еще одной недавно установленной причиной неэффективности эрадикации S. pyogenes является наличие у пиогенного стрептококка способности проникать в эпителиальные клетки слизистых оболочек. Однако далеко не все антибактериальные препараты способны эффективно воздействовать на внутриклеточно локализованных патогенов. В ходе исследования, выполненного E. L. Kaplan с соавт. на культуре эпителиальных клеток слизистой оболочки глотки человека (HEp-2), проводилось изучение жизнеспособности внутриклеточно локализованных БГСА после воздействия на них антибиотиков, рекомендованных для лечения БГСА-инфекций [14]. Результаты воздействия препаратов (пенициллин, эритромицин, азитромицин, цефалотин и клиндамицин) оценивались с применением трех методик: электронной микроскопии ультратонких срезов внутриклеточно локализованных БГСА, качественного подтверждения присутствия антибиотика в эпителиальных клетках и специальной оценки жизнеспособности внутриклеточно локализованных S. pyogenes после воздействия препаратов. Как оказалось, пиогенные стрептококки, локализованные внутри клеток, сохраняли жизнеспособность, несмотря на воздействие на эпителиальные клетки пенициллина. В то же время антибиотики группы макролидов (азитромицин и эритромицин) обладали бактерицидным эффектом в отношении данных микроорганизмов. Результаты электронной микроскопии подтвердили отсутствие внутриклеточной фрагментации БГСА (свидетельствующей об их гибели) после воздействия пенициллина. В отличие от этого после воздействия макролидов отмечалась явная фрагментация микроорганизмов. Цефалотин и клиндамицин превосходили пенициллин, но уступали эритромицину и азитромицину по эффективности разрушения внутриклеточно локализованных БГСА. Таким образом, полученные данные позволяют сделать заключение о том, что причиной неэффективности эрадикации S. pyogenes у ряда пациентов является внутриклеточное расположение БГСА и недостаточная способность пенициллина проникать в эпителиальные клетки [14].
В 2007 г. в РФ были изданы практические рекомендации «Применение антибиотиков у детей в амбулаторной практике» (под ред. А. А. Баранова и Л. С. Страчунского), рекомендованные учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для системы последипломного профессионального образования врачей [8]. В соответствии с данными рекомендациями препаратом выбора в лечении БГСА-тонзиллофарингита является феноксиметилпенициллин, альтернативными препаратами — «депо-пенициллины» (бензатина бензилпенициллин), цефалоспорины I–II поколения, макролиды (эритромицин, азитромицин, кларитромицин, рокситромицин, мидекамицин, спирамицин), линкозамиды. Для достижения эрадикации БГСА из ротоглотки все АБП, за исключением однократного введения бензатина бензилпенициллина и 5-дневного курса азитромицина, должны применяться в течение 10 дней.
В 2009 г. были опубликованы результаты Кокрановского метаанализа, сравнивавшего эффективность 3–6-дневных курсов антибактериальной терапии с использованием коротких курсов различных АБП (чаще всего, азитромицина) со стандартным 10-дневным курсом феноксиметилпенициллина при лечении пациентов с острым БГСА-тонзиллофарингитом [15]. В метаанализ были включены рандомизирован-ные контролируемые исследования (РКИ), проведенные у детей в возрасте от 1 до 18 лет с острым БГСА-тонзиллофарингитом.
Вполне логичным является вопрос об оптимальном режиме дозирования азитромицина при БГСА-тонзиллофарингите. В исследованиях азитромицина при лечении стрептококкового тонзиллофарингита можно встретить самые разнообразные схемы терапии с применением 3- или 5-дневных курсов и курсовой дозой препарата от 30 до 60 мг/кг.
В 2005 г. был опубликован метаанализ РКИ азитромицина у взрослых и детей со стрептококковыми тонзиллофарингитами, выполненный J. Casey и M. Pichichero [16]. Всего в метаанализ было включено 14 исследований у детей и 5 — у взрослых (общее число пациентов 4626). В ходе метаанализа были изучены различные режимы дозирования азитромицина у детей и взрослых. Так, у детей в различных исследованиях азитромицин применялся в курсовых дозах 30 мг/кг (10 мг/кг/сутки в течение 3 дней или 10 мг/кг/сутки в первый день и по 5 мг/кг/сутки во 2–5 дни лечения) или 60 мг/кг (20 мг/кг/сутки в течение 3 дней или по 12 мг/кг/сутки в течение 5 дней). У взрослых пациентов азитромицин назначался по 500 мг в день в течение 3 дней или 500 мг в первый день и затем по 250 мг в день в течение 4 дней. Целью метаанализа было сравнение эффективности коротких курсов азитромицина и стандартных 10-дневных курсов других АБП (пенициллина, эритромицина, цефаклора, кларитромицина и амоксициллина/клавуланата).
Оказалось, что у детей азитромицин в курсовой дозе 60 мг/кг достоверно превосходил по эффективности 10-дневный курс препарата сравнения (ОШ 5,27, 95% ДИ 3,34–8,32, р 0,05). В течение 1-го месяца периода последующего наблюдения не было отмечено случаев рецидива заболевания [22].
*НИИ антимикробной химиотерапии СГМА, **СГМА, Смоленск