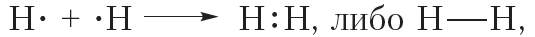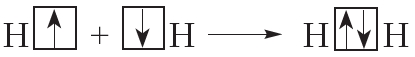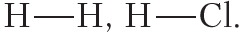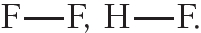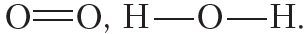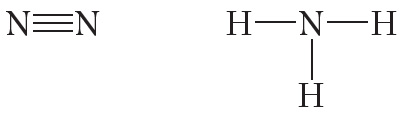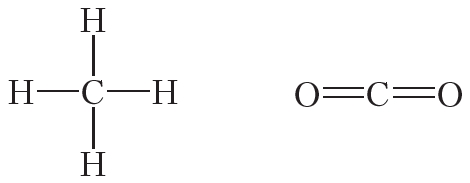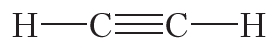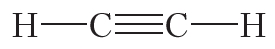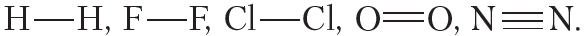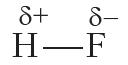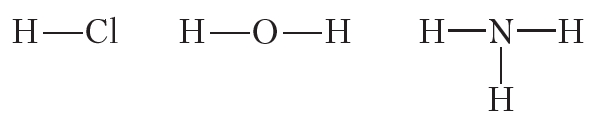фтор какая связь в химии
Фтор какая связь в химии
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» ( φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Ядерные свойства изотопов фтора
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Кристаллическая решётка
Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной со следующими параметрами решётки:
| Параметр | и значение |
|---|---|
| a | 550 пм |
| b | 328 пм |
| c | 728 пм |
| α=β=γ | 90° |
Получение
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива
шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности
фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами
фреонов — хороших хладагентов
тефлонов — химически инертных полимеров
гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Ракетная техника
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Дополнительная информация
Фториды
Соединения фтора в ракетной технике
Соединения фтора в медицине
Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Фтор F
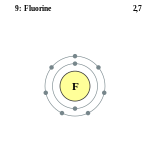
Фтор в таблице менделеева занимает 9 место, в 2 периоде.
| Символ | F |
| Номер | 9 |
| Атомный вес | 18.9984032 |
| Латинское название | Fluorum |
| Русское название | Фтор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фтора
Порядок заполнения оболочек атома фтора (F) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Фтор имеет 9 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
5 электронов на 2p-подуровне
Степень окисления фтора
Ионы фтора
Валентность F
Валентность фтора характеризует способность атома F к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа F
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения фтора
Энергия ионизации
Перейти к другим элементам таблицы менделеева
§ 4. Ковалентная связь
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 4. Ковалентная связь |
| Напечатано:: | Гость |
| Дата: | Суббота, 13 Ноябрь 2021, 23:28 |
Оглавление
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
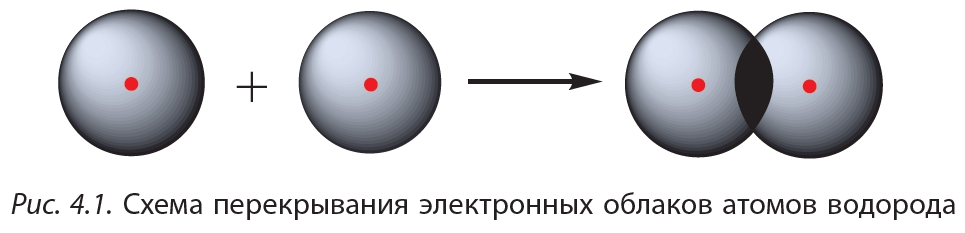
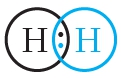
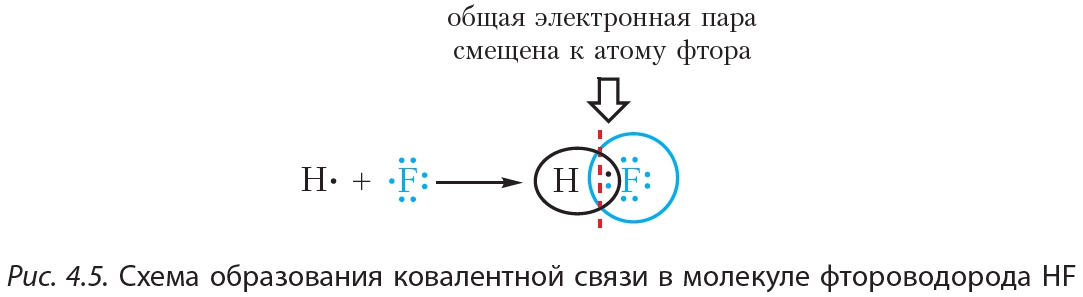
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода 
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:
Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
| Ковалентная связь — химическая связь, образованная посредством общих электронных пар. |
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Рассмотрим основные характеристики ковалентной связи.
Кратность ковалентной связи
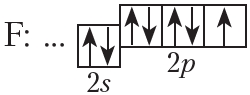
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
От символа F в структурных формулах следует рисовать одну чёрточку:
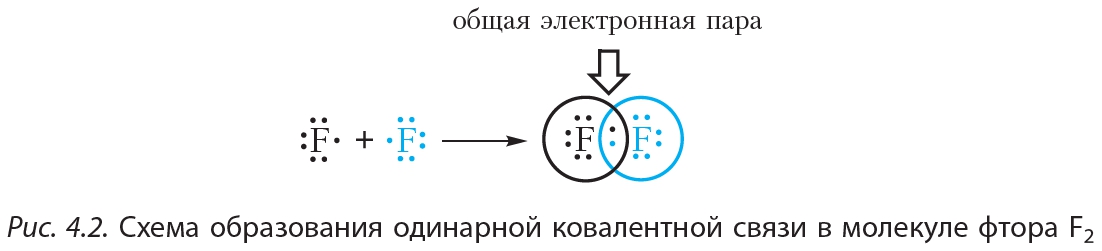
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
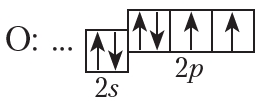
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
От символа O в структурных формулах следует рисовать две чёрточки:
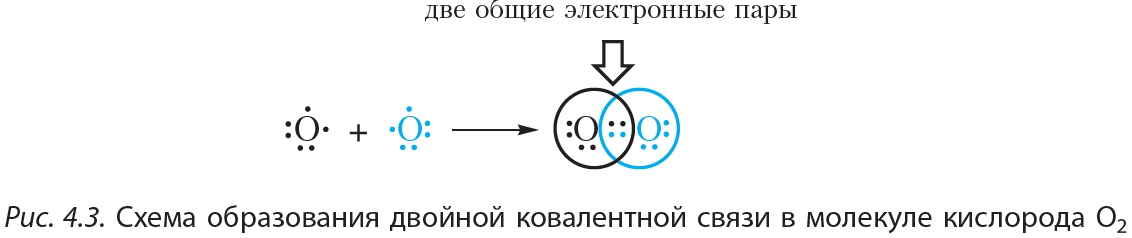
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
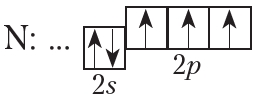
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
От символа N в структурных формулах следует рисовать три чёрточки:
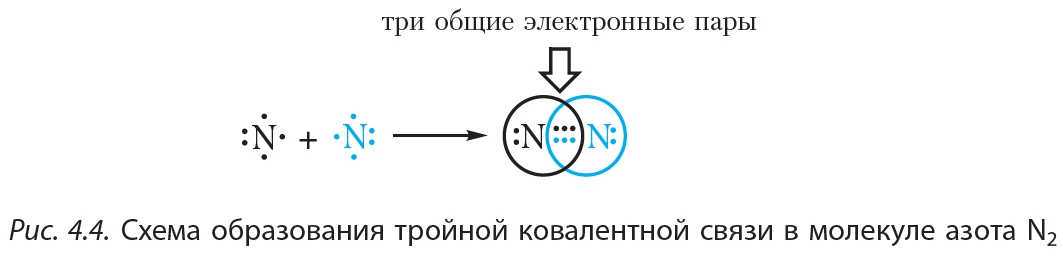
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
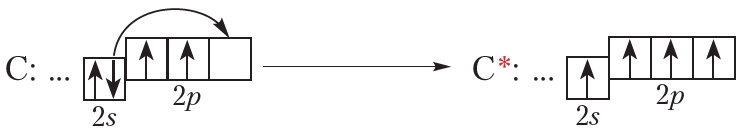
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
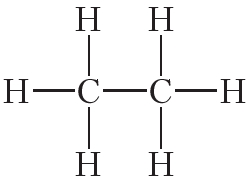
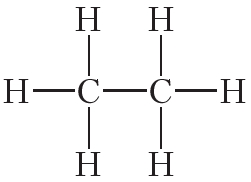
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
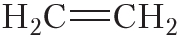
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
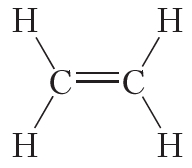
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
Энергия связи углерод-углерод, кДж/моль
Длина связи углерод-углерод, нм
Полярность ковалентной связи
В молекуле водорода H2 ковалентная связь образуется между атомами одного элемента, поэтому общая электронная пара располагается симметрично (посередине) между ядрами атомов. Такая связь называется ковалентной неполярной.
Пример 1. Ковалентной неполярной связью соединяются между собой атомы неметаллов в простых веществах
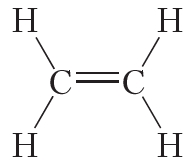
Кроме того, ковалентная неполярная связь образуется между атомами углерода в этане 

При образовании ковалентной связи между атомами разных химических элементов общая электронная пара смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной.
Напомним, что электроотрицательность — это способность атома в химическом соединении притягивать к себе электроны других атомов. Самый электроотрицательный элемент — фтор (ЭО — 4,1).
Пример 2. Ковалентная полярная связь в молекуле фтороводорода HF. Молекула 
В результате на атоме фтора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный. Частичные, а не полные заряды возникают вследствие того, что общая электронная пара смещается к атому фтора, но полного перехода электрона от одного атома к другому не происходит. Частичный заряд обозначается греческой буквой δ (дельта):
Связь между атомами водорода и фтора является ковалентной полярной.
Ковалентная полярная связь возникает между атомами неметаллов с различной электроотрицательностью, например в молекулах хлороводорода, воды, аммиака:
Чем сильнее различаются между собой электроотрицательности атомов, образующих ковалентную связь, тем больше будут частичные заряды на атомах и тем более полярной будет связь.
Пример 3. Ковалентные полярные связи в молекулах фтороводорода HF и хлороводорода HCl.
Таблица 4.2. Электроотрицательности и частичные заряды на атомах в молекулах HF и HCl
Частичные заряды на атомах
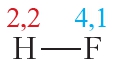
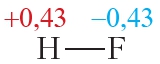
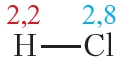
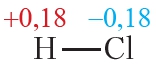
Из таблицы 4.2 видно, что частичные заряды на атомах в молекуле HF значительно больше, чем в молекуле HCl. Следовательно, связь в молекуле HF более полярна, чем в HCl.
Ковалентная связь осуществляется посредством общих электронных пар. В электронных формулах общую электронную пару обозначают двумя точками, расположенными между атомами. В структурных формулах ковалентную связь обозначают чёрточкой.
Ковалентная связь образуется между атомами неметаллов. Между атомами одного и того же неметалла возникает ковалентная неполярная связь. Между атомами разных неметаллов — ковалентная полярная.
Ковалентная связь бывает одинарной, двойной и тройной. Двойная и тройная связи называются кратными.
Чем прочнее связь, тем больше энергия связи. Энергия кратных связей выше энергии одинарных связей. Кратные связи короче одинарных связей.
Вопросы и задания
1. При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, H2O, NH3, CH4. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. В какой молекуле, H2O или NH3, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
4. Напишите структурную формулу пероксида водорода H2O2. Укажите полярные и неполярные связи.
5. В какой молекуле, O2 или H2O2, энергия связи кислород-кислород больше?
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?