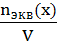Как классифицируются растворы по агрегатному состоянию
Классификация растворов



Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации.
Раствор— находящаяся в состоянии равновесия гомогенная система переменного состава из двух или более веществ.
Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ может непрерывно изменяться в определенных пределах.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. (В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает)
Любой раствор состоит из растворенных веществ и растворителя. Вещества, составляющие раствор, называются компонентами раствора.
Растворенное вещество — Компонент жидкого или твердого раствора, который присутствует в меньшем или незначительном количестве; компонент растворяется в Растворителе.
Классификация растворов
по растворимости в воде:
В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя).
А ниже это уже про растворимость веществ, не нужно здесь.
по способности к диссоциации:
по степени дисперсности:
| Грубодисперсные системы (взвеси) | Коллоидные системы (кровь, лимфа, слюна, белки) | Истинные растворы (раствор соли в воде) |
| Размер частиц дисперсной фазы | ||
| Больше 100 нм 10 –7 –10 –5 м | 1-100 нм 10 –9 –10 –7 | меньше 1 нм |
I. Взвеси – это дисперсные системы, в которых размеры распределённых частиц сравнительно велики (10 –7 –10 –5 м). Взвеси делятся на суспезии и эмульсии; в первых распределённое вещество твёрдое, во вторых – жидкое. Частицы взвеси видны простым глазом или в обычный оптический микроскоп. Взвеси – системы мутные и непрозрачные. Взвеси неустойчивы, частицы диспергированного вещества выпадают в осадок (песок + вода), а если плотность диспергированного вещества меньше плотности среды, то диспергированное вещество всплывает (глина + масло). Процесс разделения взвесей называется седиментацией (для суспензий) и расслоением(для эмульсий).
II. Коллоидные системы – это такие дисперсные системы, в которых частицы распределённого вещества имеют размеры порядка 10 –9 –10 –7 м. Каждая такая частица может содержать большое число атомов или молекул. Такие частицы невидимы через обычный микроскоп, но видимы в ультрамикроскоп, где свет падает сбоку или сзади, в результате чего в поле зрения видны светлые точки, возникающие в результате рассеяния света диспергированными частицами.
III. Истинные растворы или просто растворы – это дисперсные системы, в которых диспергированное вещество распределено в среде в виде молекул или ионов; частицы имеют размеры порядка 10 –10 –10 –7 м. Растворы системы однородные, устойчивые.
Способ выражении концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента(или нормальная концентрация), массовая концентрация или титр.
Концентрацией вещества называют величину, измеряемую количеством растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
ω (х)=
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора.
См=
1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
3. Нормальная концентрация (молярная концентрация эквивалента, СN)- количество моль- эквивалентов вещества, содержащегося в 1 л раствора.
СN=
Единица измерения моль-экв/л, Сокращенно обозначается буквой N. Например, 0.1N HCL означает, что в 1 литре такого раствора содержится 0,1моль- эквивалент НСl.
3. Массовая концентрация или титр раствора T(Х) измеряют в кг/см^3, г/см^3, г/мл,
Титр (Т)— масса растворенного вещества, содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле:
Раствор с известным титром называется титрованным раствором.
Лекция по теме: Растворы
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Лекция по теме: «Растворы»
Понятие о дисперсных системах.
Дисперсными системами называются системы, в которых одно вещество, находясь в мелкораздробленном состоянии (дисперсная фаза), равномерно распределено в другом (дисперсная среда).
В зависимости от размеров частиц дисперсной фазы различают следующие дисперсные системы:
Грубодисперсные системы, размер частиц велик (эмульсии, суспензии). Примером может служить раствор глины в воде.
По агрегатному состоянию фаз Вильгельм Фридрих Оствальд предложил ставшую весьма распространенной классификацию:
Коллоидные растворы (т/ж)
Глина, зубная паста, губная помада.
Раствор яичного белка, плазма крови, спиртовая вытяжка хлорофилла, кремниевая кислота.
Растворы солей, щелочей, сахара.
Твердые растворы (т/т)
Сплавы, минералы, цветные стекла.
Туман, облака, моросящий дождь, струя из аэрозольного баллончика.
Истинные растворы (ж/ж)
Молоко, масло, майонез, крем, мази, эмульсионные краски.
Нисшие спирты +вода, ацетон + вода.
Твердая эмульсия (ж/т)
Дисперсной системы не образуется
Пена газированной воды, мыльная пена, взбитые сливки, взбитый крем, пастила.
Пенопласт, пенобетон, пеностекло, пемза, лава.
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
По агрегатному состоянию растворы подразделяются:
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.).
На практике чаще применяются водные растворы.
Растворение веществ (образование растворов).
Растворение — сложный физико-химический процесс, который включает несколько стадий:
1. Разрушение кристаллической решетки растворенного вещества.
Рассмотрим растворение хлорида калия в воде.
Причиной этого являются собственные колебательные движения частиц и притяжение со стороны молекул растворителя.
2. Постепенный переход частиц, образующих кристалл, в раствор.
3. Распределение частиц, перешедших в раствор, по всему объему растворителя.
Растворы, компонентами которых являются ионы, называются ионными (растворы электролитов, так как они проводят электрический ток). Растворы, компонентами которых являются электро-нейтральные частицы, называются молекулярными (растворы неэлектролитов).
Долгое время считалось, что растворитель — это среда, химически инертная по отношению к растворенному веществу. То есть между частицами растворителя и частицами растворенного вещества отсутствует межмолекулярное взаимодействие, как и в обычных механических смесях.
Впоследствии оказалось, что физическая теория применима лишь к небольшой группе так называемых идеальных растворов. Примерами идеальных растворов являются многие газовые растворы (газовые смеси), образованные из не реагирующих между собой газов. Как и отдельные газы, такие газовые растворы подчиняются газовым законам. Физические свойства таких смесей (плотность, давление и др.) вычисляются как аддитивные (от лат. – сложение), т. е. из свойств компонентов, составляющих смесь. Например, общее давление газовой смеси равно сумме парциальных давлений14 ее компонентов (закон Дальтона, 1800 г.).
1. Химическое (донорно-акцепторное взаимодействие) взаимодействие, между растворителем и растворенным веществом. Например, хлор, растворяясь, взаимодействует с водой с образованием хлорной воды:
2. Ион-дипольное взаимодействие (при растворении веществ с ионной кристаллической решеткой). Например, в случае растворения хлорида натрия образуются ионы натрия и хлора, вокруг которых за счет сил электростатического притяжения удерживаются молекулы воды.
3. Диполь-дипольное взаимодействие (при растворении веществ с молекулярной кристаллической решеткой).
Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит например, при растворении в воде NaNO 3 ; КС l ; K 2 SO 4 ; KNO 2 ; NH 4 Cl и др.
Итак, разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т. е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:
При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами.
Вода, входящая в их состав, называется кристаллизационной водой. Примеры
В спокойном состоянии они могут годами оставаться без изменения.
Но стоит бросить в раствор кристаллик того вещества, которое в нем растворено, как вокруг него начинают расти другие кристаллы и через некоторое время весь избыток растворенного вещества выкристаллизовывается. Иногда кристаллизация начинается от простого сотрясения раствора или от трения стеклянной палочкой о стенки сосуда, в котором находится раствор. При кристаллизации выделяется значительное количество теплоты, вследствие чего сосуд с раствором заметно нагревается. Очень легко образуют пересыщенные растворы глауберова соль, бура, тиосульфат натрия.
В итоге, пересыщенные растворы являются неустойчивыми системами. Они Способны к существованию только при отсутствии в системе твердых частиц растворенного вещества.
Количественной характеристикой растворимости является коэффициент растворимости.
Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре. Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.

1) коэффициент растворимости веществ при различных температурах;
2 ) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t 1 °С до t 2 ° С.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Важной характеристикой любого раствора является его состав.
Количественная характеристика состава растворов
Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества). Но границы между ними условны.
При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: массовая доля растворенного вещества и молярная концентрация (молярность).
Массовая доля растворенного вещества
Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора:
ω — массовая доля растворенного вещества, выраженная и долях единицы;
m (в-ва) — масса растворенного вещества, г;
m (р-ра) — масса раствора, г.
Массовую долю можно выражать также в процентах (%):
Массовую долю растворенного вещества в процентах (%) часто называют процентной концентрацией раствора.
Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.
Молярную концентрацию можно рассчитать по формуле
На практике часто переходят от одного способа выражения концентрации к другому по известной плотности раствора, применяя формулу т = ρ • V.
Растворы
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
Обратите внимание!
При попадании в воду вещество может:
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси Vр-ра, л:
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом.
Растворы
Классификация растворов
Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Растворы подразделяются на:
•молекулярные — водные растворы неэлектролитов — органических веществ (спирт, глюкоза и т. д.);
•молекулярно-ионные — растворы слабых электролитов (азотистой, сероводородной кислот и др.);
•ионные — растворы сильных электролитов (щелочей, солей, кислот — NaOH, K2SO4, HNO3).
Растворимость многих веществ небезгранична и зависит от температуры. Насыщенным называется такой раствор, в котором при данной температуре вещество больше не растворяется. В ненасыщенном растворе содержится меньше вещества, а в перенасыщенном — больше, чем в насыщенном.
В работе с веществами важно знать их растворимость в воде. Вещество считается хорошо растворимым, если при комнатной температуре в 100 г воды растворяется 1 г этого вещества; если меньше, то вещество считается малорастворимым; при растворимости менее 0,001 г — нерастворимым.
Поведение веществ в растворе
Растворение — это физико-химический процесс. Он сочетает в себе физический процесс (дробление до молекул) и химическое воздействие компонентов (образование в воде непрочных соединений — гидратов). В процессе растворения молекулы воды разрушают кристаллы растворяемого вещества. Это разрушение происходит в месте соприкосновения кристалла с водой. Чем больше площадь поверхности соприкосновения, тем быстрее разрушаются кристаллы. В результате диффузии происходит самопроизвольное распределение частиц одного вещества между частицами другого, что приводит к образованию раствора. Для улучшения контакта вещества с растворителем увеличивают площадь поверхности соприкосновения, вещества измельчают и раствор перемешивают.
В результате химического взаимодействия вещества с водой образуются соединения — гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении: растворение H2SO4 сопровождается выделением тепла, растворение NaCl, NH4 NO3 — охлаждением. Косвенным доказательством гидратации является существование твердых кристаллогидратов — солей, в состав которых входят вода, например медный купорос CuSO4 х 5Н2O.
Массовая доля вещества. Концентрация растворов
Массовая доля растворенного вещества — это отношение его массы m к массе раствора mр-ра. Ее обозначают буквой ω («омега»).
ω(Х) = m(Х)/mр-ра (в долях единицы);
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой φ («фи»).
Концентрация (С) — это содержание растворенного вещества в единице массы или объема.
Процентная концентрация раствора — это отношение массы растворенного вещества m (в граммах) к массе раствора (в граммах).
Молярная концентрация — это отношение количества растворенного вещества n (в молях) к объему раствора V (в литрах). Ее обозначают буквой С.