Как колоть гормон роста видео
Как колоть гормон роста: куда и в какое время (+дозировки и подробная инструкция)
Соматотропин (гормон роста) уже давно используется спортсменами как средство для прироста мышц и сжигания лишнего жира (сушки). В отличие от стероидов, после курса такого препарата объемы увеличившихся мышц сохраняются. Гормон роста колется курсами, дозы и способ применения зависят от цели. Рассмотрим подробнее, когда и сколько ставить препарата с гормоном роста для ускорения прироста мышц и сжигания жировых отложений.
Какие дозировки гормона роста безопасны
Суточную дозу делят на несколько частей, поскольку гормон роста обладает краткосрочным действием. После введения эффект сохраняется на протяжении 4 часов. Рекомендованные дозы:
Лучше начинать с небольших доз и увеличить их постепенно по следующей схеме:
Женщинам нужно использовать такую же схему, только со своей дозировкой, которая в 2 раза меньше, чем у мужчин. Далее нужно мягко отменять препарат:
Допустимы следующие схемы применения соматотропина:
Максимальная длительность курса – 6 месяцев. В таком случае подходят обе схемы: первые 2 месяца – ежедневно, а далее – по графику 5/2.
Противопоказания к применению:
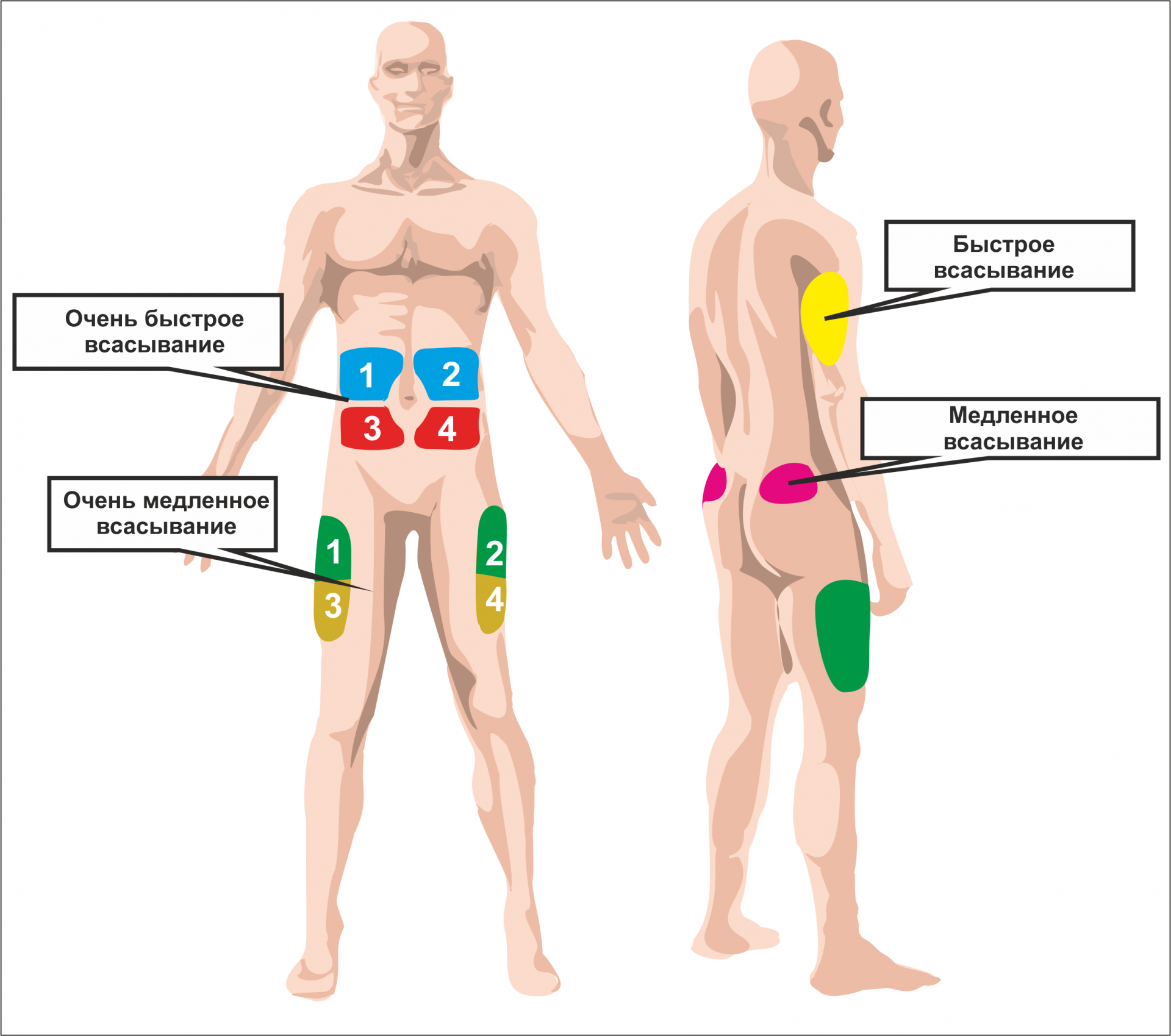
Куда колоть гормон роста
Соматотропин вводят в организм путем инъекций:
Когда лучше ставить гормон роста
Главное правило в курсе соматотропина – инъекции должны делаться на голодный желудок. Это связано с тем, что после еды в организме начинает вырабатываться инсулин – антагонист, т. е. вещество с противоположным действием. Инсулин помешает выработке.
Исходя из этих условий, специалисты определили, в какое время колоть гормон роста:
Это связано с тем, что до приема пищи еще не начал вырабатываться инсулин, а собственный соматотропин еще продолжает синтезироваться. Кроме того, с утра самая высокая концентрация тестостерона, и с помощью гормона роста можно усилить его анаболический эффект. Также в это время соматотропин поможет подавить катаболизм.
Для набора мышечной массы не менее важен утренний прием пищи, поскольку при голодании уровень гормона стресса (кортизола) находится на пике, а он разрушает белок в мышцах. Из-за этого утром они особенно нуждаются в аминокислотах. Поэтому спустя полчаса-час после инъекции стоит сразу позавтракать.
Вторую инъекцию делают перед обедом. Хорошо, если через 1-2 часа после завтрака была тренировка с ощутимой физической нагрузкой. Примерно через 30 минут после инъекции можно принять протеин или белковую пищу.
Инъекцию перед сном делают только при курсе для сушки, т. е. для сжигания жира. В таком случае введенный соматотропин вступает в реакцию в соматотропином, вырабатываемым в организме. При стремлении набрать мышечную массу лучше не ставить гормон роста на ночь, а ограничиться инъекцией утром и после тренировки.
Как ставить гормон роста
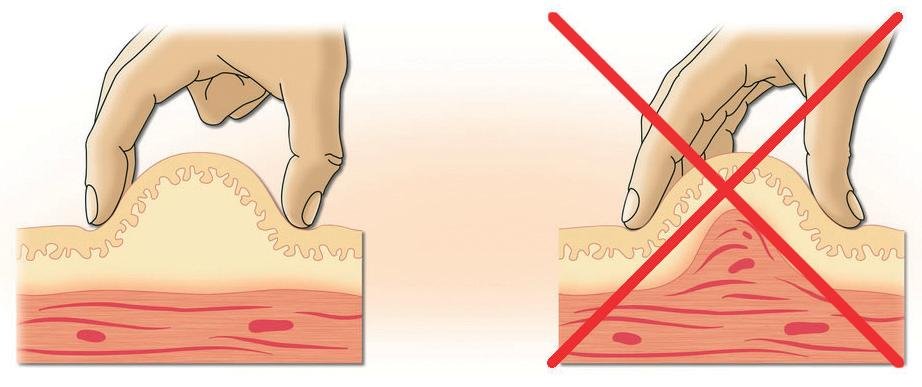
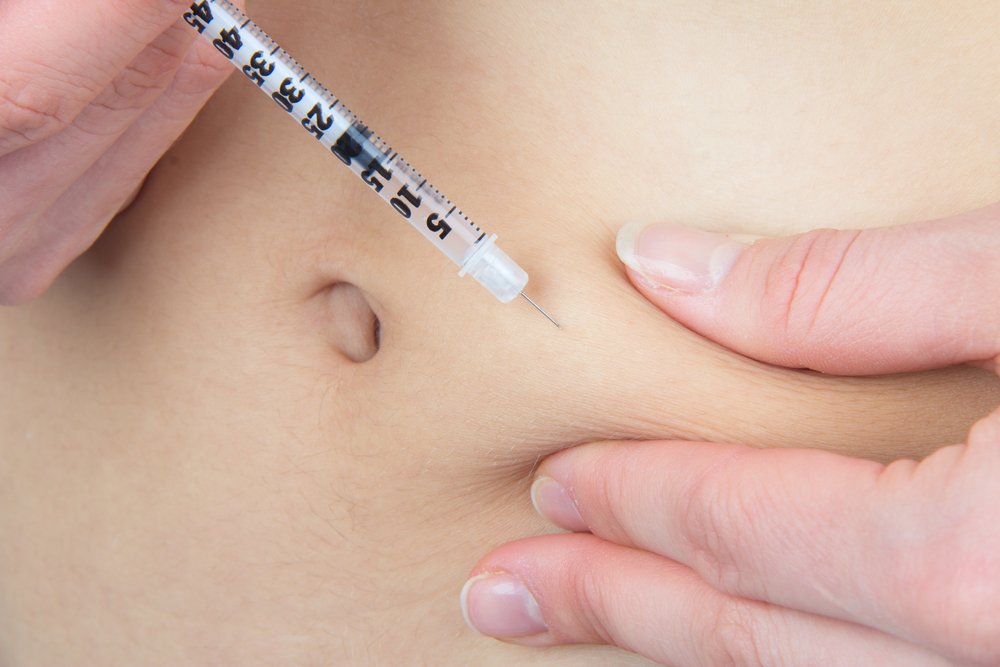
Инъекции в живот необходимо делать в разные места, чтобы избежать неравномерного рассасывания жировой ткани в месте введения. Чаще всего выбирают зону в области пупка как наименее чувствительную. Оптимальный вариант – в диаметре 8-9 см вокруг пупка.
Что необходимо для инъекции:
Во многие комплекты препарата гормона роста производитель уже включает все необходимое: порошок, воду для раствора, шприцы и спиртовые салфетки. Инсулиновые шприцы удобнее по той причине, что имеют интегрированную иглу. Она более тонкая и острая, а поэтому укол практически не ощущается и после инъекции на коже не остается шрамов и гематом. Кроме того, у них более плавный ход поршня, и они полностью выдавливают жидкость.
Инструкция, как колоть гормон роста:
Разводить раствор нужно непосредственно в день использования. При введении только части раствора оставшееся количество нужно отправить на хранение в холодильник на верхнюю полку или отсек на стенке (хранится не более 72 часов). При хранении раствора более 24 часов стоит для разведения использовать бактерицидную воду.
В дополнение к инъекциям гормона роста рекомендуют прием Тироксина. Этот препарат необходим для поддержки щитовидной железы, поскольку соматотропин препятствует выполнению ее функций. Прием Тироксина повысит безопасность гормона роста, а также усилит жиросжигание.
Джинтропин ® (Jintropine) инструкция по применению
Владелец регистрационного удостоверения:
Произведено:
Лекарственные формы
Форма выпуска, упаковка и состав препарата Джинтропин ®
| 1 фл. | |
| соматропин | 1.33 мг (4 МЕ) |
Вспомогательные вещества: глицин, сахароза, метионин, натрия гидрофосфат, полисорбат 80, натрия дигидрофосфата моногидрат.
| 1 фл. | |
| соматропин | 3.33 мг (10 МЕ) |
Вспомогательные вещества: глицин, сахароза, метионин, натрия гидрофосфат, полисорбат 80, натрия дигидрофосфата моногидрат.
Фармакологическое действие
Препарат Джинтропин ® является генно-инженерным соматотропным гормоном. Стимулирует скелетный и соматический рост, а также оказывает выраженное влияние на метаболические процессы. Стимулирует рост костей скелета, воздействуя на пластинки эпифиза трубчатых костей, костный метаболизм. Способствует нормализации структуры тела посредством увеличения мышечной массы и снижения жировой массы тела. У больных с дефицитом гормона роста и остеопорозом заместительная терапия приводит к нормализации минерального состава и плотности костей. Увеличивает число и размер клеток мышц, печени, вилочковой железы, половых желез, надпочечников, щитовидной железы. Стимулирует транспорт аминокислот в клетку и синтез белков, снижает уровень холестерина, воздействуя на профиль липидов и липопротеинов. Подавляет высвобождение инсулина. Способствует задержке натрия, калия и фосфора. Увеличивает массу тела, мышечную активность и физическую выносливость.
Фармакокинетика
Всасывание и распределение
Абсорбция соматропина после п/к введения составляет 80%, C max в плазме крови достигается через 3-6 ч. Проникает в хорошо перфузируемые органы.
Метаболизм и выведение
Показания препарата Джинтропин ®
Режим дозирования
Джинтропин ® вводят п/к, медленно, 1 раз/сут, обычно на ночь. Следует менять места инъекции для профилактики развития лииоатрофии.
Растворять содержимое флакона рекомендуется в 1 мл прилагаемого растворителя, исходя из рассчитанной дозы. Для этого отбирают растворитель шприцем и вводят во флакон с препаратом через пробку. Осторожно покачивают до полного растворения содержимого флакона. Резкое встряхивание при этом недопустимо. Приготовленный раствор хранится во флаконе не более двух недель при температуре от 2°С до 8°С.
Дозы подбирают индивидуально с учетом выраженности дефицита гормона роста, массы или площади поверхности тела, эффективности в процессе терапии.
У детей при недостаточной секреции гормона роста рекомендуется доза 25-35 мкг/кг/сут (0.07-0.1 МЕ/кг/сут), что соответствует 0.7-1 мг/м 2 /сут (2-3 МЕ/м 2 /сут). Лечение начинают как можно в более раннем возрасте и продолжают до полового созревания и/или до закрытия зон роста костей. Возможно прекращение лечения при достижении желаемого результата.
При дефиците гормона роста у взрослых начальная доза составляет 0.15-0.3 мг/сут (что соответствует 0.45-0.9 МЕ/сут) с последующим ее увеличением, в зависимости от эффекта.
При титровании дозы в качестве контрольного показателя может использоваться уровень инсулиноподобного фактора роста I (ИРФ-I) в сыворотке крови. Поддерживающая доза подбирается индивидуально, но не превышает, как правило, 1 мг/сут, что соответствует 3 МЕ/сут.
Пожилым пациентам рекомендуются более низкие дозы.
Побочное действие
Возможно: повышение внутричерепного давления (головная боль, тошнота, рвота, нарушение зрения), снижение функции щитовидной железы, гипергликемия, лейкемоидные реакции, эпифизеолиз головки бедренной кости, задержка жидкости с развитием периферических отеков, артралгия, миалгия, туннельный синдром. Симптомы носят, как правило, транзиторный, дозозависимый характер, могут потребовать уменьшения дозы.
Аллергические реакции: кожная сыпь, зуд.
Редко: образование антител к препарату со снижением его эффективности.
Местные реакции: гиперемия, припухлость, боль, зуд, липоатрофия в месте инъекции.
Следующие побочные эффекты описаны в литературе при применении препарата соматропин: слабость, усталость, гинекомастия, отек диска зрительного нерва (обычно наблюдается в течение первых 8 недель лечения, наиболее часто бывают у больных с синдромом Шсрешевского-Тернера), панкреатит (абдоминальные боли, тошнота, рвота), средний отит и нарушение слуха (у больных с синдромом Шерешевского-Тернера), подвывих бедра у детей (прихрамывание, боль в бедре и колене), ускорение роста существовавшего ранее невуса (возможна малигнизация), прогрессирование сколиоза (у больных с чрезмерно быстрым ростом), повышение содержания в крови неорганического фосфата, паратиреоидного гормона и активности ЩФ.
Противопоказания к применению
С осторожностью следует назначать препарат при сахарном диабете, внутричерепной гипертензии, гипотиреозе.
Применение при беременности и кормлении грудью
Применение у детей
У детей при недостаточной секреции гормона роста рекомендуется доза 25-35 мкг/кг/сут (0.07-0.1 МЕ/кг/сут), что соответствует 0.7-1 мг/м 2 /сут (2-3 МЕ/м 2 /сут). Лечение начинают как можно в более раннем возрасте и продолжают до полового созревания и/или до закрытия зон роста костей. Возможно прекращение лечения при достижении желаемого результата.
Применение у пожилых пациентов
Пожилым пациентам рекомендуются более низкие дозы.
Особые указания
На фоне лечения препаратом Джинтропин ® возможно потребуется коррекция доз гипогликемических препаратов у больных сахарным диабетом, может произойти манифестация латентно протекающего гипотиреоза, а у пациентов, получающих тироксин, могут появиться признаки гипертиреоза.
Во время лечения необходимо контролировать состояние глазного дна, особенно, при симптомах внутричерепной гипертензии. Отек зрительного нерва требует отмены препарата.
Обнаружение хромоты на фоне терапии соматропином требует тщательного наблюдения.
Необходимо менять места п/к инъекций в связи с возможностью развития липоатрофий.
Передозировка
Лечение: отмена препарата, симптоматическая терапия.
Лекарственное взаимодействие
ГКС снижают стимулирующее действие соматропина на процессы роста.
На эффективность препарата (в отношении конечного роста) также может оказывать влияние сопутствующая терапия другими гормонами, например, гонадотропином, анаболическими стероидами, эстрогенами и гормонами щитовидной железы.
Условия хранения препарата Джинтропин ®
Препарат следует хранить в защищенном от света месте при температуре от 2°С до 8°С. Не замораживать.
Приготовленный раствор хранить при температуре от 2°С до 8°С в течение 2 недель.
Как повысить гормон роста
В данной статье будет рассмотрена работа гормона роста в организме, его основные функции, причины снижения, как стимулировать выработку, продукты, повышающие гормон роста, как выявить недостаток и другое.
Что такое гормон роста и его функции
Научное название гормона роста – соматотропин или соматотропный гормон. Данное вещество вырабатывается в мозгу в передней доле гипофиза и крайне важно для роста и развития тканей организма человека. Без необходимой выработки данного вещества у подростков и детей не будут расти кости, а у более взрослых людей он оказывает важное влияние на синтез белка, регулирует жировую и мышечную массу тела.
В разные периоды жизни человека, соматотропин вырабатывается в разном количестве, например, пик его приходится на период роста в детском и подростковом возрасте, после 25 лет выработка начинается замедляться и постепенно останавливается. Именно с этими процессами связано начало старения организма и ослабление иммунитета.
Если ребенок не получает достаточное количество гормона роста, то это приводит к различного рода задержкам: задержка роста, умственного и полового развития.
У мужчин и женщин гормон роста способствует меньшему накоплению жировых отложений, рост мышечной массы, регулирует углеводный обмен, нормализует выработку инсулина.
Особенно популярен вопрос о том, как повысить гормон роста у мужчин, так как он помогает активнее расти мышечной массе, что особенно важно для спортсменов.
Соматотропин вырабатывается у человека в любое время суток, однако, наиболее активно это происходит во время сна ночью, в момент получения питательных веществ с едой и в период физической активности.
В течение дня наибольшая выработка достигается каждые 3-5 часов и на ее активность влияет множество факторов. Суточный пик обычно приходится на второй-третий час сна человека.
Были проведены независимые исследования, которые доказали, что введение дополнительного гормона роста пожилым людям, существенно повышает их продолжительность жизни и замедляет старение органов.
Причины снижения соматотропина
На выработку соматотропина в организме влияет множество факторов, которые могут быть как генетическими, так и отражать образ жизни человека и факторы окружающей его среды. Основные факторы, которые не увеличивают, а подавляют выработку:
Таким образом, на малое количество гормона роста в большей степени влияют сопутствующие заболевания, либо генетические факторы.
Как повысить гормон роста естественным путем
Существует ряд биологических факторов, которые непосредственно влияют на выработку соматотропина
Усиленный синтез может быть связан с неправильной работой щитовидной железы. Например, при гипертиреозе его количество значительно повышается, и данный аспект может служить основанием для проведения обследования щитовидной железы.
Для стимуляции выработки гормона и блокировки негативного действия других веществ, необходимо правильно питаться. Питание должно быть насыщено белками, полезными жирами и медленными углеводами, так сахара в кровь будет выбрасываться меньше, работа инсулина будет достаточной. В рационе должны присутствовать орехи, мясо рыбы, крупы с невысоким гликемическим индексом, яйца, творог и т.п.
Физические нагрузки
Как уже было отмечено, умеренная физическая активность хорошо стимулирует синтез гормона роста. Существует два основных вида такой активности: силовые и аэробные. К силовым относятся любые упражнения, в которых необходимо прикладывать физическую силу и при которых интенсивнее увеличивается мышечная масса, а к аэробным можно отнести бег, все виды ходьбы, лыжи, плавание и т.п. Наибольший успех для повышения гормона роста достигается при силовых нагрузках, однако, они не являются золотым стандартом, для организма лучше всего, когда те и другие виды сочетаются.
Для человека важно каждый день уделять время физической активности: это может быть не быстрая ходьба (желательно проходить в сутки не менее 8000 шагов), заниматься в тренажерном зале с гантелями, на специальных тренажерах или дома с небольшими весами.
Кроме того, что физическая активность помогает увеличить уровень гормона роста, это еще и благоприятно влияет на массу тела и способствует нормализации обменных процессов внутри организма. При физической активности увеличивается углеводный обмен – интенсивнее, что называется, «сгорают жиры» и вес человека уменьшается, а уменьшение веса благоприятно влияет на другие органы и система, также наблюдается снижение сахара в крови.
Как увеличить гормон роста в организме другими способами
Как уже упоминалось выше, для быстрого увеличения сухой мышечной массы, спортсмены прибегают к употреблению специальных веществ или их инъекциям. Метод искусственного введения можно назвать опасным, так как это создает дисбаланс гормональной системы, и могут проявиться побочные эффекты и даже развиться заболевания органов и тканей. Наиболее часто встречающиеся осложнения после приема синтетического гормона роста: увеличение сердца, значительное повышение сахара в крови, развитие опухолей и другое.
Только под присмотром специалиста можно подобрать безопасные препараты, стимулирующие гормон роста, которые не нанесут вред организму, так как будут подобраны индивидуально и назначены в соответствии со всеми нормами и правилами.
К какому врачу обратиться
Гормональная система человека – это полностью стезя врачей-эндокринологов, если какие-либо нарушения происходят в ней, либо необходимо вмешательство в данную систему, то наилучший вариант – это обратиться к специалисту.
Я, Романов Георгий Никитич, квалифицированный специалист, врач-эндокринолог с практикой более 20 лет. Я владею обширными классическими и современными знаниями в области эндокринологии. На моем счету множество благодарных клиентов, с которыми мы смогли нормализовать их ритм жизни.
Сегодня я веду практику не только в клинике, но и провожу онлайн консультации, на которые можно записаться лично у меня любым из представленных способов: ВКонтакте, instagram, WhatsApp, skype, Viber. На онлайн консультации я могу помочь расшифровать результаты инструментальных исследований, скорректировать лечение, ответить на интересующие Вас вопросы. Также я работаю с профессиональными спортсменами, помогаю подобрать необходимые препараты под особенности организма, контролирую процесс изменений, связанный с ними и др.
Гормон роста в современной клинической практике
В последние годы на фоне развития фундаментальных наук (молекулярная генетика, генная инженерия, иммунология и др.) достигнуты значительные успехи в понимании этиологии и патогенеза врожденной соматотропной недостаточности. С внедрением новых технологий
В последние годы на фоне развития фундаментальных наук (молекулярная генетика, генная инженерия, иммунология и др.) достигнуты значительные успехи в понимании этиологии и патогенеза врожденной соматотропной недостаточности.
С внедрением новых технологий рекомбинантного синтеза гормона роста человека коренным образом изменилась судьба людей, страдающих гипофизарной карликовостью.
С 1985 г. в клинической практике используются рекомбинантные препараты гормона роста человека. Согласно материалам международного научного общества по изучению гормона роста (2001), около 100 000 детей во всем мире получают лечение рекомбинантным гормоном роста человека. До этого, начиная с 1958 г., во всех странах использовались исключительно препараты соматотропного гормона (СТГ), полученные экстрактным путем из гипофизов трупов человека. Понятно, что иметь в наличии достаточное количество препарата не представлялось возможным. Кроме того, было показано, что подобное лечение сопряжено с риском развития смертельно опасного недуга, поражающего центральную нервную систему — болезни Крейтцфельдта–Якоба. С 1985 г. использование экстрактных препаратов гормона роста было официально запрещено.
Практически неограниченные возможности получения генно-инженерных препаратов СТГ выводят на новый, современный уровень лечение и мониторинг пациентов с соматотропной недостаточностью, что обеспечивает достижение нормального роста и полноценного качества жизни этих людей.
Различают врожденный и приобретенный дефицит СТГ; органический (как результат внутричерепного повреждения различной этиологии) и идиопатический (при отсутствии какой-либо специфической органической патологии гипоталамо-гипофизарной области). Врожденный дефицит гормона роста развивается вследствие первичного нарушения секреции СТГ на уровне гипофиза или гипоталамуса, не способного адекватно стимулировать соматотрофы аденогипофиза. Приобретенная соматотропная недостаточность является чаще всего последствием операции на гипоталамо-гипофизарной области, реже — воспалительных заболеваний этой области.
Различают также формы нанизма — в зависимости от нарушения уровня регуляции секреции и действия СТГ: гипофизарный (первичная патология гипофиза); гипоталамический (дефицит биосинтеза и секреции СТГ-рилизинг-фактора (СТГ-РФ)); тканевая резистентность к действию СТГ (патология рецепторов к СТГ на уровне тканей-мишеней). Соматотропная недостаточность может быть изолированной (25%) и множественной (75%), когда выпадает функция и других гормонов гипофиза. В случае множественного дефицита гормонов гипофиза наиболее часто встречается сочетание соматотропной недостаточности со вторичным гипотиреозом и вторичным гипогонадизмом, реже — СТГ-дефицит и вторичный гипотиреоз с недостаточной секрецией пролактина, что обусловлено врожденной поломкой гена РIT-1 или гена PROP-1. Реже снижается или совсем не осуществляется секреция адренокортикотропного гормона (АКТГ) (10%). Пангипопитуитаризм — «выпадение» функции всех гормонов гипофиза — не превышает 10%.
Частота нанизма, обусловленного дефицитом СТГ гипофиза, составляет 1:15 000 (Vimpani et al., 1977). Наиболее распространенная форма — идиопатическая (65–75%). Вместе с тем по мере совершенствования диагностических методов и использования их в клинической практике (генетические исследования, компьютерная и магнитно-резонансная томография головного мозга) доля детей с идиопатическим дефицитом СТГ уменьшается, в то время как частота диагностируемых органических причин дефицита СТГ возрастает. Классификация этиологии соматотропной недостаточности представлена ниже.
I. ВРОЖДЕННЫЙ ДЕФИЦИТ СТГ.
Изолированный дефицит СТГ.
А. Мутации гена гормона роста (GH-1).
1) Тип IA: Делеция гена СТГ, аутосомно-рецессивный тип наследования.
2) Тип IБ: Аутосомно-рецессивный тип наследования.
3) Тип II: Аутосомно-доминантный тип наследования.
4) Тип III: Х-связанная рецессивная форма наследования.
Б. Мутации гена рецептора к СТГ-РФ (GHRH-R).
Множественный дефицит гормонов аденогипофиза.
1) Мутации гена P1T-1.
2) Мутации гена PROP-1.
1) Патология срединной трубки:
2) Дисгенезия гипофиза:
— врожденная аплазия гипофиза;
— врожденная гипоплазия гипофиза;
II. ПРИОБРЕТЕННЫЙ ДЕФИЦИТ СТГ.
— глиома зрительного перекреста.
— хирургическое повреждение гипофизарной ножки.
— вирусный, бактериальный энцефалит и менингит;
— неспецифический (аутоиммунный) гипофизит.
— аневризмы сосудов гипофиза;
— лейкемия, медуллобластома, ретинобластома;
— другие опухоли головы и шеи;
— общее облучение всего тела (например, при пересадке костного мозга).
— конституциональная задержка роста и пубертата;
— психосоциальный (депривационный) нанизм.
III. ПЕРИФЕРИЧЕСКАЯ РЕЗИСТЕНТНОСТЬ К ДЕЙСТВИЮ СТГ
Секреция СТГ гипофизом имеет пульсирующий характер с выраженным суточным ритмом. Основное количество СТГ секретируется в ночное время в начале глубокого сна, что особенно выражено в детстве.
Регуляция секреции СТГ осуществляется посредством СТГ-РФ (соматолиберина) и СТГ-ингибирующего фактора (соматостатина). Их эффекты опосредуются гипоталамическими нейротрансмиттерами, которые оказывают либо стимулирующее (α-адренергические, серотонинергические, дофаминергические рецепторные системы), либо ингибирующее (α-адренергические и серотонинергические антагонисты, β-адренергические агонисты) влияние на секрецию СТГ.
Стимулирующие эффекты на секрецию СТГ оказывают тиреоидные и половые гормоны, вазопрессин, АКТГ, меланоцитостимулирующий гормон. Глюкокортикостероиды оказывают как стимулирующее (при острой нагрузке высокими дозами), так и тормозящее (при длительном хроническом избытке гормона) влияние на секрецию СТГ.
СТГ является основным гормоном, стимулирующим линейный рост. Он способствует росту костей в длину, росту и дифференцированию внутренних органов, развитию мышечной ткани. Основные эффекты СТГ на уровне костной ткани состоят в стимуляции роста хряща и синтеза белка, индуцировании митоза клеток. Ростстимулирующие воздействия СТГ опосредуются через инсулинподобные факторы роста (ИФР-I, ИФР-II), которые синтезируются главным образом в печени под влиянием СТГ.
Влияние СТГ на углеводный и жировой обмен может осуществляться в два этапа — «острых» и «запаздывающих» эффектов. «Острые» эффекты состоят в инсулинподобном действии — стимуляции гликогенеза в печени, синтезе белка в печени и мышцах, утилизации глюкозы в жировой и мышечной ткани. «Запаздывающие» эффекты проявляются противоположным действием — стимуляцией гликогенолиза, липолиза, торможением утилизации глюкозы тканями.
Диагностика СТГ-дефицита
Тщательно собранный анамнез крайне важен на начальном этапе обследования. При сборе анамнеза следует уточнить следующие моменты.
Сроки появления задержки роста. Пренатальная задержка роста характерна для детей с внутриутробной задержкой роста, с генетическими синдромами, хромосомной патологией, наследственным СТГ-дефицитом вследствие делеции гена СТГ. Для детей с классической соматотропной недостаточностью характерна постнатальная задержка роста. В случае врожденного СТГ-дефицита патология в росте отмечается с первых месяцев жизни. У 70–80% детей с гипофизарным нанизмом отставание в росте проявляется до 5-летнего возраста.
Для детей с органическим генезом дефицита СТГ (краниофарингиома, посттравматический и др.) характерны более поздние сроки проявления дефицита роста — после 5–6-летнего возраста.
Перинатальная патология. При идиопатическом СТГ-дефиците выявляется высокая частота перинатальной патологии с асфиксией и фетальным дистрессом вследствие травмы в родах при ягодичном и ножном предлежании, наложении акушерских щипцов, вакуум-экстракции, стремительных или, наоборот, длительных родов.
Гипогликемии. Наличие в анамнезе гипогликемий натощак характерно для детей раннего возраста с врожденным СТГ-дефицитом. В 10% случаев гипогликемии выявляются клинически, вплоть до судорожных синдромов. В большинстве случаев необходимо выявить эквиваленты гипогликемии — потливость, беспокойство, повышенный аппетит.
Семейный анамнез. У детей с транзиторным СТГ-дефицитом (конституциональная задержка роста и пубертата) семейный анамнез позволяет в большинстве случаев выявить аналогичные случаи низкорослости и задержки полового развития в детском и подростковом возрасте у одного из родителей либо ближайших родственников. Наличие у одного из родителей или сибсов гипофизарной карликовости позволяет заподозрить эту же патологию у ребенка.
Хронические заболевания, а также лекарственные препараты, которые могут повлиять на процессы роста. К заболеваниям, которые могут сопровождаться нарушением роста у детей, относятся следующие.
Клиника
На фоне резкого отставания в росте, задержки скорости роста и костного созревания у детей сохраняются нормальные пропорции тела. Вследствие недоразвития костей лицевого черепа черты лица мелкие, переносица западает. Характерно «кукольное» лицо. Волосы тонкие. Голос высокий. Часто встречается избыток веса, однако для детей с ранним проявлением дефицита роста (до 1 года жизни) ожирение не характерно.
У мальчиков, как правило, имеется микропенис. Половое развитие задержано и наступает в сроки, когда костный возраст ребенка достигает пубертатного уровня.
Если имеет место пангипопитуитаризм, то к клинической симптоматике, представленной выше, присоединяются симптомы выпадения других функций гипофиза (тиреотропного гормона (ТТГ), АКТГ, лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), вазопрессина). Симптомы снижения функции щитовидной железы при вторичном гипотиреозе выражены, как правило, в меньшей степени, чем при первичном гипотиреозе. В ряде случаев диагноз может быть поставлен только после получения гормональных данных (свободный Т4, ТТГ).
Значительная доля детей с СТГ-дефицитом имеет сопутствующий дефицит гонадотропинов. Клиническая симптоматика подтверждается данными пробы с люлиберином и сниженными уровнями половых гормонов в крови.
Сопутствующий дефицит АКТГ встречается довольно редко и в основном диагностируется лабораторно — по сниженному уровню базального кортизола и АКТГ и значительному выбросу кортизола на фоне пробы с синактеном.
Наличие помимо дефицита роста таких жалоб, как головные боли, нарушение зрения, рвота, позволяет заподозрить внутричерепную патологию (краниофарингиома).
Клинический осмотр позволяет различить: детей с генетическими синдромами (Шерешевского–Тернера, Секкеля, Блума, Рассела–Сильвера и др.); явными формами скелетных дисплазий (ахондроплазии и др.); детей с эндокринной патологией (врожденный гипотиреоз, болезнь Иценко–Кушинга, синдром Мориака); пациентов с нарушенным питанием.
Диагностика многих редких смешанных синдромов первичного нарушения роста и хромосомной патологии основана главным образом на типичном фенотипе (рис. 1).
 |
| Рисунок 1. Синдром Ларона, семейная форма у сестер 6 и 4 лет. Задержка роста, недоразвитие лицевого скелета, выступающий лоб, запавшая переносица, голубые склеры |
Прогерия (синдром Гетчинсона–Гилфорда). Клиническая картина представлена чертами прогрессирующего преждевременного старения. Рост и вес, нормальные при рождении, значительно отстают уже к первому году жизни. Основная симптоматика развивается с 2–3-летнего возраста: тотальная алопеция, атрофия потовых и сальных желез, отсутствие подкожно-жирового слоя, склеродермо-подобные изменения кожи, выраженная венозная сеть на голове, дистрофия ногтей, экзофтальм, тонкий клювовидный нос, малый лицевой и большой мозговой череп. Голос тонкий. Пубертат обычно не наступает. Интеллект средний или выше среднего. Часто диагностируются асептические некрозы головки бедренной кости, вывих тазобедренного сустава. Характерен ранний распространенный атеросклероз коронарных, мезентериальных сосудов, аорты, головного мозга. Продолжительность жизни — в среднем 12–13 лет, основная причина летальности — острый инфаркт миокарда, застойная сердечная недостаточность, инсульты.
Синдром Рассела–Сильвера. Характеризуется внутриутробной задержкой роста, асимметрией туловища (укорочение конечностей с одной стороны), укорочением и искривлением 5-го пальца, «треугольным» лицом, задержкой умственного развития. У трети больных развивается преждевременное половое развитие. Характерны почечные аномалии и гипоспадии.
Синдром Секкеля (птицеголовые карлики). Характеризуется внутриутробной задержкой роста, микроцефалией, гипоплазией лицевого черепа с крупным носом, низким расположением ушей (часто аномально развитых), задержкой умственного развития, клинодактилией 5-го пальца.
Синдром Прадера–Вилли. Дети с этим синдромом, наряду с задержкой роста с рождения, имеют выраженное ожирение, крипторхизм, микропенис, гипоспадию, нарушение толерантности к углеводам, задержку умственного развития.
Синдром Лоуренса–Муна–Барде–Бидля. Включает в себя низкий рост, ожирение, пигментную дегенерацию сетчатки, атрофию дисков зрительных нервов, гипогонадизм, задержку умственного развития. Часто встречаются неполные формы синдрома, с наличием лишь некоторых описанных признаков.
Синдром Шерешевского–Тернера (дисгенезия гонад). Типичная клиническая симптоматика для кариотипа 45ХО представлена сниженной массой тела при рождении, лимфатическим отеком стоп, голеней и кистей у новорожденных, низким уровнем роста волос на шее сзади, короткой шеей с крыловидными складками, бочкообразной грудной клеткой, широко расставленными сосками. Характерны птоз, эпикантус, низкое расположение ушей. Вторичные половые признаки отсутствуют. Костный возраст соответствует паспортному или несколько отстает. В связи с наличием стертых форм данного синдрома, с различными вариантами мозаицизма, у всех девочек с задержкой роста целесообразно проводить исследование кариотипа.
Показатели роста
Рост оценивается по данным перцентильных таблиц стандартов роста и веса, отдельно для мальчиков и девочек.
Помимо абсолютных показателей роста, крайне важным показателем процесса роста является скорость роста. Перцентильные таблицы скорости роста разработаны J. M. Tanner, P. S. W. Davies (1985). У детей с дефицитом СТГ скорость роста не превышает 4 см в год, чаще всего она составляет 1–2 см в год.
Оценка пропорциональности скелета важна в первую очередь для исключения различных форм скелетных дисплазий как генеза нанизма. В частности, целесообразно вычислять коэффициент «верхний сегмент: нижний сегмент», объем размаха рук.
В настоящее время известны различные формы скелетных дисплазий (остеохондродисплазии, диссоциированное развитие хряща и фиброзного компонента скелета, дизостозы и др.). Ахондроплазия является наиболее частой формой хондродистрофий. Клиническая симптоматика типична и включает в себя выраженную задержку роста за счет диспропорционального укорочения конечностей, особенно проксимальных сегментов.
Для определения костного возраста используются два метода: Гролиха и Пайла или Таннера и Уайтхауса. При врожденном дефиците гормона роста костный возраст отстает от паспортного более чем на 2 года.
Рентгенологическое исследование черепа проводится с целью визуализации формы и размеров турецкого седла и состояния костей черепа. При гипофизарном нанизме турецкое седло нередко малых размеров. Характерные изменения турецкого седла имеют место при краниофарингиоме — истончение и порозность стенок, расширение входа, супраселлярные или интраселлярные очаги обызвествления; признаки повышения внутричерепного давления — усиление пальцевых вдавлений, расхождение черепных швов.
Показана компьютерная и магнитно-резонансная томография головного мозга. Морфологические и структурные изменения при идиопатическом гипопитуитаризме включают в себя гипоплазию гипофиза, разрыв или истончение гипофизарной ножки, эктопию нейрогипофиза, синдром «пустого турецкого седла».
Проведение компьютерной и магнитно-резонансной томографии головного мозга необходимо при любом подозрении на внутричерепную патологию (объемный процесс) и всем детям с доказанным дефицитом гормона роста.
Гормональная диагностика дефицита СТГ
Однократное определение СТГ в крови для диагностики соматотропной недостаточности не имеет диагностического значения вследствие эпизодического характера секреции СТГ и из-за возможности получения крайне низких (нулевых) базальных значений СТГ даже у здоровых детей.
В связи с этим используется определение пика выброса СТГ на фоне стимуляции, исследование ИФР и их связывающих белков в крови.
Провокационные тесты основаны на способности различных фармакологических препаратов стимулировать секрецию и выброс СТГ соматотрофами.
В клинической практике наиболее широко используются пробы с инсулином, клонидином, СТГ-РФ, аргинином, леводопой, пиридостигмином (табл.). Любой из перечисленных выше стимуляторов способствует значительному выбросу (свыше 10 нг/мл) гормона роста у 75–90% здоровых детей.
Тотальная соматотропная недостаточность диагностируется в случае пика выброса СТГ на фоне стимуляции менее 7 нг/мл, частичный дефицит — при пике выброса СТГ от 7 до 10 нг/мл.
Необходимое условие проведения СТГ-стимулирующих проб — эутиреоидное состояние щитовидной железы. В случае гипотиреоза необходим предварительный курс лечения тиреоидными препаратами в течение 3–4 нед.
Наиболее диагностически значимой константой в выявлении дефицита СТГ у детей являются ИФР, в частности ИФР-I (соматомедин С) и ИФР-II (соматомедин В). СТГ-дефицит напрямую связан со сниженным уровнем ИФР-I и ИФР-II в плазме крови.
В диагностике соматотропного дефицита у детей высокоинформативным показателем является уровень высокомолекулярного соматомединсвязывающего белка 3. Уровень его в плазме крови зависит от секреции гормона роста и снижен у детей с СТГ-дефицитом.
Важное место в выявлении дефицита СТГ занимает диагностика рецепторной резистентности к СТГ (синдром Ларона). Молекулярная основа данного состояния — патология гена рецептора СТГ. Секреция гормона роста гипофизом не нарушена, но существует рецепторная резистентность к СТГ.
Клиническая симптоматика синдрома Ларона такая же, как при гипофизарном нанизме, но уровень гормона роста при проведении стимуляционных тестов значительно повышен, а уровень ИФР крови сильно снижен.
Для диагностики синдрома Ларона используется ИФР-I- стимулирующий тест. Этот тест заключается в введении генно-инженерного СТГ (0,033 мг/кг/сут, подкожно, в течение 4 дней) и определении уровней ИФР-I и ИФР-связывающего белка 3 до первой инъекции СТГ и через день после окончания пробы. У детей с синдромом Ларона отсутствует повышение уровней ИФР-I и ИФР-связывающего белка-3 на фоне стимуляции, в отличие от пациентов с гипофизарным нанизмом.
Лечение больных с синдромом Ларона гормоном роста неэффективно. Значительный практический интерес представляет терапия детей с этим синдромом рекомбинантным ИФР-I.
Лечение соматотропной недостаточности
С 1985 г. для лечения детей с соматотропной недостаточностью используются исключительно генно-инженерные препараты гормона роста человека.
В настоящее время в России прошли клиническую апробацию и разрешены к использованию следующие рекомбинантные препараты гормона роста человека: В настоящее время в России прошли клиническую апробацию и разрешены к использованию следующие рекомбинантные препараты гормона роста человека: Нордитропин® (НордиЛет®) (Ново Нордиск, Дания); хуматроп (Лилли Франс, Франция); генотропин (Пфайзер Хелс АБ, Швеция); сайзен (Индустрия Фармасьютика Серано С. п. А., Италия); растан (Фармстандарт, Россия).
При лечении гипофизарного нанизма у детей имеется четкая связь «доза–ростовой эффект», особенно выраженная в первый год лечения.
Рекомендуемая стандартная доза СТГ при терапии классического дефицита СТГ — 0,033 мг/кг/на инъекцию, ежедневно, подкожно, в вечернее время 20.00–22.00.
Критерием эффективности терапии является увеличение скорости роста от исходной в несколько раз. Она достигает в первый год лечения, по данным разных авторов, от 8 до 13 см в год. Максимальная скорость роста отмечается в первый год лечения, особенно в первые 3–6 мес, затем имеет место замедление скорости роста от первого ко второму году лечения (при сохранении скорости роста более 5–6 см в год).
 |
| Рисунок 2. Эффективность лечения гормонами роста пациентов с СТГ-дефицитом: а) не леченный гормоном роста, 48 лет, 124 см; б) леченный гормоном роста, 22 года, рост 180 см |
Опыт детской клиники ЭНЦ РАМН по лечению детей с гипофизарным нанизмом различными генно-инженерными препаратами гормона роста и зарубежный опыт различных эндокринологических клиник свидетельствует о высокой эффективности заместительной терапии рекомбинантными препаратами гормона роста человека. При рано начатом и регулярном лечении возможно достижение нормальных, генетически запрограммированных границ роста. На рисунке 2 представлен ребенок с пангипопитуитаризмом, достигший роста 180 см, с сравнении с ростом нелеченного взрослого с той же патологией и конечным ростом 124 см.
Помимо увеличения линейного роста, в процессе терапии гормоном роста отмечаются определенные изменения в гормональном, метаболическом, психическом статусе пациентов. Анаболический, липолитический и антиинсулиновый эффекты проявляются увеличением мышечной силы, улучшением почечного кровотока, повышением сердечного выброса, увеличением всасываемости кальция в кишечнике и минерализации костей. В крови снижаются уровни β-липопротеинов, увеличиваются в пределах нормы уровни щелочной фосфатазы, фосфора, мочевины, свободных жирных кислот. Повышается жизненный тонус пациентов, значительно улучшается качество жизни.
Лечение гормоном роста не вызывает быстрого прогрессирования костного созревания.
Пациенты с изолированным выпадением соматотропной функции имеют спонтанный пубертат по достижении костным возрастом пубертатных значений.
 |
| Рисунок 3. Эффективность лечения рекомбинантным гормоном детей с внутриутробной задержкой роста из тройни: а) до лечения (слева направо: рост первой сестры 104,1 см; брата — 108,5 см; второй сестры — 103,8 см); б) через 12 мес лечения (рост первой сестры 113,9 см; брата — 118,7 см; второй сестры — 114,3 см) |
У детей с пангипопитуитаризмом, помимо лечения гормоном роста, необходима сопутствующая заместительная терапия другими препаратами по показаниям — L-тироксином, глюкокортикостероидами, адиуретином-SD. При дефиците гонадотропинов назначается терапия половыми гормонами: у девочек по достижении костного возраста 11 лет (этинил-эстрадиол, 0,1 мкг/кг, per os, ежедневно), у мальчиков — при костном возрасте 12 лет (препараты тестостерона, 50 мг/м 2 поверхности тела в месяц, в/м — в первый год лечения, 100 мг/м 2 /мес — во второй год лечения, 155 мг/м 2 в месяц — в третий год лечения).
Лечение гормоном роста проводят до закрытия зон роста или достижения социально-приемлемого роста. Клиническим ориентиром служит скорость роста менее 2 см в год.
Гормон роста синтезируется в течение всей жизни. Для взрослого человека он необходим как анаболический гормон, препятствующий процессам старения, улучшающий сократительную функцию сердца, функцию печени, почек, повышающий минеральную плотность костной ткани, мышечный тонус. Поэтому в настоящее время заместительная терапия гормоном роста при доказанной соматотропной недостаточности проводится всю жизнь. После закрытия зон роста гормон роста применяется в метаболической дозе, которая в 7–10 раз меньше ростстимулирующей и составляет 0,0033 мг/кг/сут.
Первый отечественный опыт использования заместительной терапии при закрытых зонах роста у взрослых с соматотропной недостаточностью (И. И. Дедов и соавт., 2004) показал безопасность и высокую метаболическую эффективность такого лечения.
Побочные эффекты
С 1989 г. в ЭНЦ РАМН ведется Национальный регистр детей с соматотропной недостаточностью. Анализ лечения более 3000 пациентов, наблюдающихся в детской клинике ЭНЦ РАМН, показал высокую ростстимулирующую эффективность и безопасность применения гормона роста при данной патологии.
 |
| Рисунок 4. Эффективность лечения рекомбинантным гормоном у ребенка с синдромом Сильвера–Рассела: а) до лечения (рост — 78,2 см); б) через 12 мес. лечения (рост — 89,1 см); в) через 24 мес лечения (рост — 96,2 см). Прибавка в росте + 18 см за 24 мес |
В первые дни лечения возможны отечность век, пастозность голеней, которые проходят в течение 1–2 нед. Это связано с задержкой жидкости. Редко может наблюдаться повышение внутричерепного давления. В этих случаях отменяют гормон роста на несколько дней, после чего продолжают лечение гормоном роста в половинной дозе, постепенно повышая до терапевтической.
Крайне редко наблюдается, значит, теоретически возможно в клинической практике нарушение толерантности к углеводам, в связи с чем необходимо мониторировать уровень глюкозы крови каждые 3 мес терапии.
При приобретенной гипофизарной недостаточности вследствие оперативного лечения краниофарингиомы, гамартомы, аденомы гипофиза, облучения головного мозга и др. лечение гормоном роста назначают через 6–12 мес после оперативного вмешательства при отсутствии продолженного роста или рецидива объемного образования. Двадцатилетний опыт лечения таких пациентов, продемонстрировал эффективность и безопасность использования гормона роста при данной форме соматотропной недостаточности.
Практически неограниченные возможности создания рекомбинантных СТГ человека расширили потенциальные показания к его применению как у детей, так и у взрослых, не ограничиваясь рамками только классического гипофизарного нанизма.
К настоящему времени имеются данные (как зарубежных исследователей, так и наши собственные) об эффективном лечении гормоном роста детей с внутриутробной задержкой роста (рис. 3), семейной низкорослостью, синдромами Шерешевского–Тернера, Прадера–Вилли, Рассела–Сильвера
(рис. 4), анемией Фанкони, болезнью Иценко–Кушинга, гликогенозом, с хронической почечной недостаточностью, скелетными дисплазиями, муковисцидозом.
И. И. Дедов, доктор медицинских наук, профессор, академик РАН и РАМН
В. А. Петеркова, доктор медицинских наук, профессор
Е. В. Нагаева, кандидат медицинских наук
ЭНЦ РАМН, Москва