Как можно распознать карбоновые кислоты
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
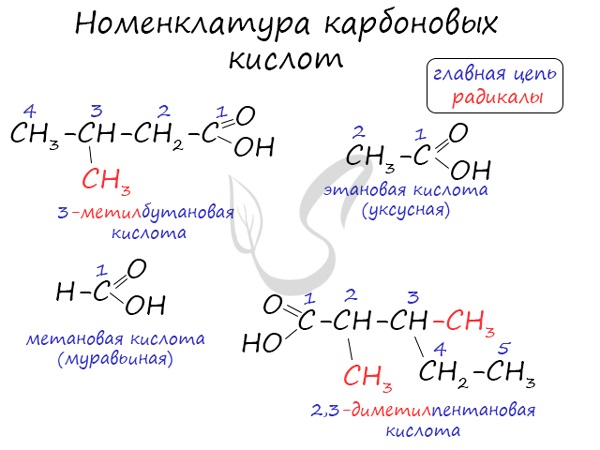
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
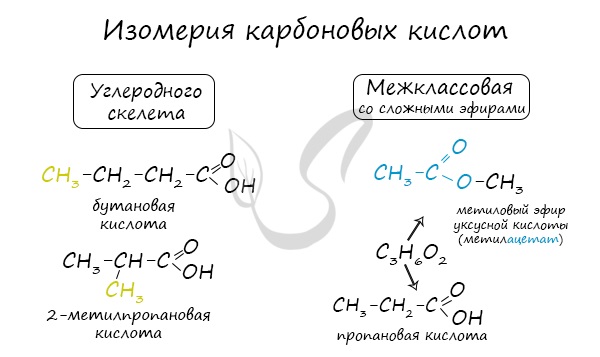
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
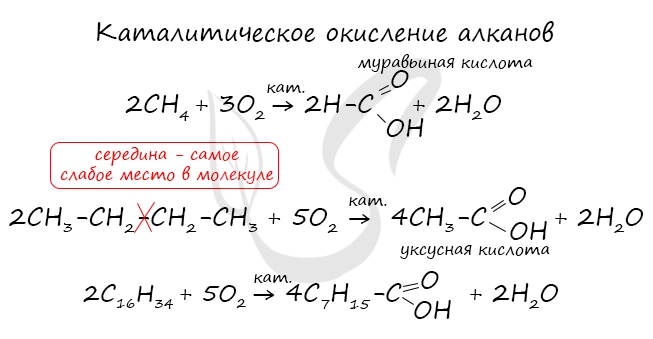
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
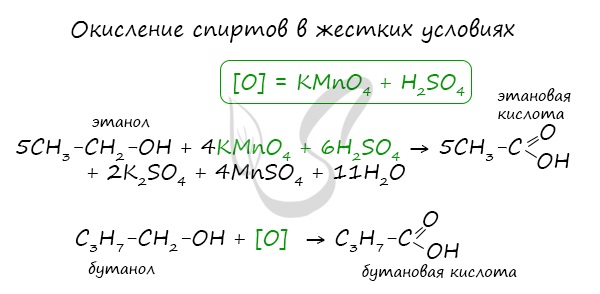
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
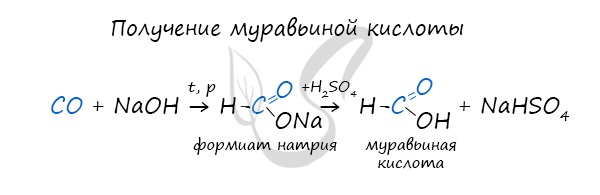
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
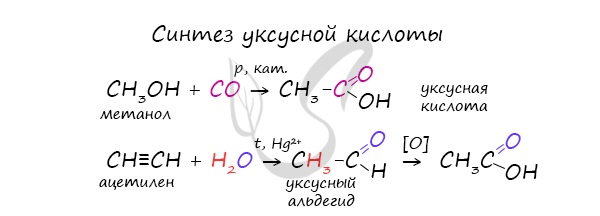
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
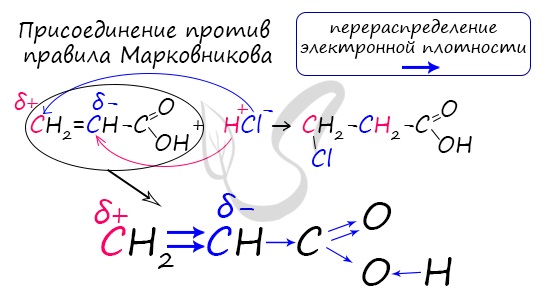
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
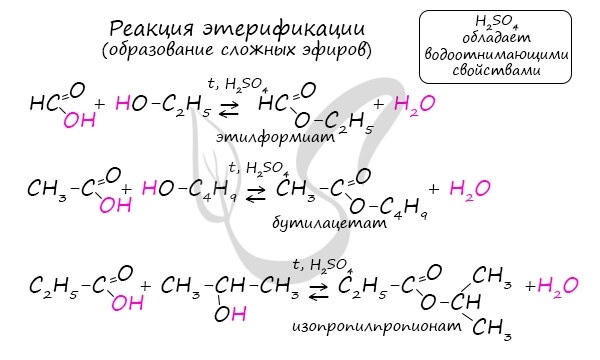
Сложные эфиры
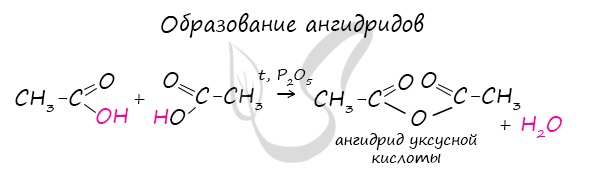
Ангидриды
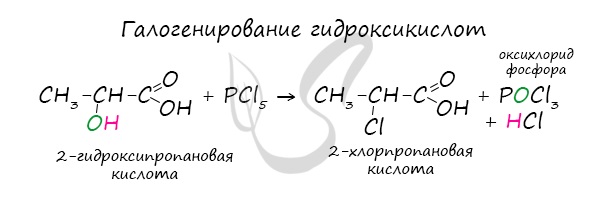
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Карбоновые кислоты
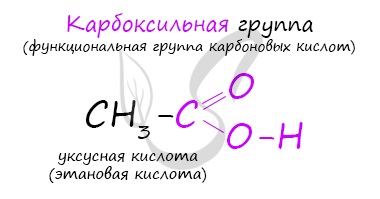
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
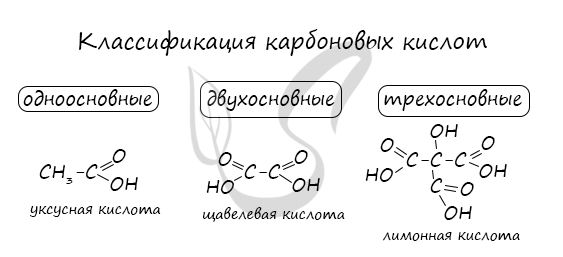
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
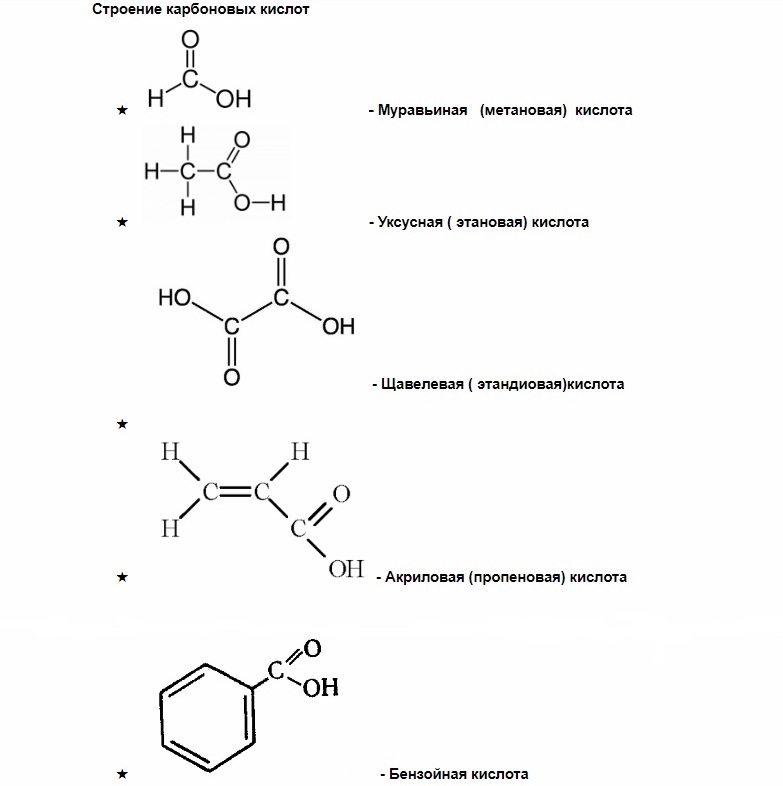
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
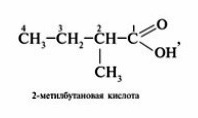
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) 
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 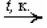
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 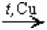
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 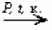
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Карбоновые кислоты.
Карбоновыми кислотами называют соединения, в которых содержится карбоксильная группа:

Карбоновые кислоты различают:
В зависимости от строения карбоновые кислоты различают:
Примеры карбоновых кислот.
Если в радикале водород поменять на любую функциональную группу, то такие кислоты называются гетерофункциональными. Среди них: аминокислоты (протон замещен на амино-группу), нитрокислоты (атом водорода замещен на нитро-группу) и т.д.
Если число атомов углерода в кислоте больше 6, то такая кислота называется жирной.
Строение карбоновых кислот.
Карбоксильная группа состоит из С=О и ОН группы. На свойства кислоты влияют оба эти показателя. В группе С=О атом углерода обладает частично положительным зарядом и притягивает неподеленную пару атома кислорода из гидроксильной группы. При этом на кислороде электронная плотность понижается и связь О-Н ослабляется:
Группа ОН «нейтрализует» положительный заряд на группе С=О, которая перестает вступать в реакции присоединения, которые так характерны для карбонильных кислот.
Как называть карбоновых кислот?
Наличие СООН группы обозначается окончанием –овая кислота.
Нумеровать цепь начинают с атома углерода карбоксильной группы, например:
Карбоксильную группу рассматривают в качестве заместителя. Например,
Изомерия карбоновых кислот.
Для карбоновых кислот характерна изомерия углеродного скелета, положение кратной связи, межклассовая изомерия, пространственная изомерия и изомерия положения функциональной группы:
Физические свойства карбоновых кислот.
Общая формула кислот CnH2n+1COOH. Низшие кислоты в нормальных условиях представляют собой жидкости, которые обладают характерным запахом. Начиная с С10 – твердые вещества.
Твердые кислоты нерастворимы в воде, а кислоты с 1-3 количеством атомов углерода неограниченно смешиваются с водой.
1. Окисление первичных спиртов перманганатом калия и дихроматом калия:
2. Гибролиз галогензамещенных углеводородов, содержащих 3 атома галогена у одного атома углерода:
3. Получение карбоновых кислот из цианидов:
При нагревании нитрил гидролизуется с образованием ацетата аммония:
При подкисления которого выпадает кислота:
4. Использование реактивов Гриньяра:
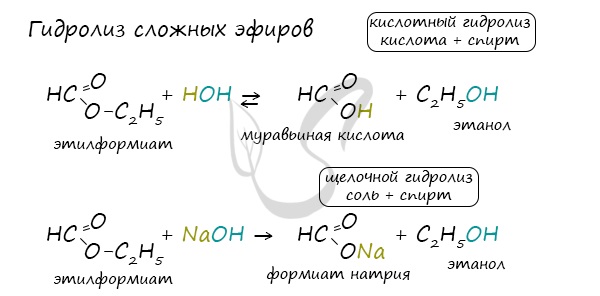
5. Гидролиз сложных эфиров:
6. Гидролиз ангидридов кислот:
7. Специфические способы получения карбоновых кислот:
Муравьиная кислота получается при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
Бензойную кислоту получают окислением монозамещенных гомологов раствором перманганата калия:
Реакция Каннициаро. Бензальдегид обрабатывают 40-60% раствором гидроксида натрия при комнатной температуре.
Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:
Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.
1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:
Карбоновые кислоты – слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:
2. Образование функциональных производных карбоновых кислот:
3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты – реакция этерификации:
4. Образование амидов, нитрилов:
3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:
4. Реакция присоединения.
5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:
Исключение: муравьиная кислота:
6. Реакция серебряного зеркала:
8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:
9. Двухосновная кислота легко отщепляет СО2 при нагревании:
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Строение карбоновых кислот
Виды карбоновых кислот
Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.
Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия
Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.
Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
Из гомологов бензола получают бензойную кислоту.
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
Реакция замещения гидроксильной группы карбоновой кислоты
Для проведения реакции необходима минеральная кислота.
Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.
Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.
Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.
Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.
Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.