Как называется белковая часть миоглобина
МИОГЛОБИН
МИОГЛОБИН (myoglobinum; греч, mys, my [os] мышца + лат. globus шарик; Mgb; син.: миогемоглобин, мышечный гемоглобин) — сложный белок красного цвета, относящийся к хромопротеидам; содержится в красных мышцах животных различных классов и видов. Основной функцией М. является накопление кислорода, поступающего в процессе дыхания в мышцы из крови и отдача кислорода по мере необходимости в нем (см. Газообмен).
Факторами, определяющими различия в содержании М., являются видовая принадлежность животных (см. табл.), особенности условий их существования, образ жизни, тип мышцы, степень ее активности, а также трофические влияния нервной системы. Очень высокое содержание М. (до 16—40 г на 100 г высушенной ткани) характерно для водных животных. Значительные количества М. содержатся в красных мышцах нек-рых беспозвоночных (моллюски), в гладких мышцах мускульного желудка птиц, в гладкой мускулатуре бронхов, сосудов, стенок кишечника, а также в паренхиматозных органах, причем последние участвуют в процессах синтеза (печень), распада (селезенка) и выделения пигмента. Однако еще не доказано, что пигмент, выделенный из паренхиматозных органов, идентичен М.
Таблица. Содержание миоглобина в сердечных и скелетных мышцах человека и некоторых классов позвоночных животных (в г на 100 г высушенной ткани)
Класс животных; человек
В крови и моче М. в норме отсутствует. Поэтому его появление в этих биол, жидкостях является признаком заболеваний, сопряженных с деструкцией тканей (инфаркт миокарда, травматические повреждения мышц, генетически обусловленная прогрессивная мышечная дистрофия и т. д.). Определение уровня М. в плазме крови может служить критерием обширности деструкции, динамики процесса и эффективности лечебных мероприятий.
Мол. вес (масса) М. составляет в среднем 17 500, содержание железа 0,34%, Изоэлектрическая точка находится при pH 6,99. М. характеризуется большой растворимостью и высокой устойчивостью к действию щелочей.
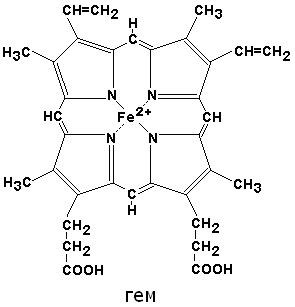
Изучена третичная структура М. и построена пространственная модель его молекулы (рис.). М. состоит из простого белка— глобина, представляющего собой одну полипептидную цепь, в состав к-рой входит 153 аминокислотных остатка, и простетической (небелковой) группы — гема (железопротопорфириновый комплекс, или протогем). Полипептидная цепь глобина М. на 77% представлена альфа-спиральными участками (всего 8 спиралей), к-рые перемежаются с участками неупорядоченной структуры, расположенными в области четырех изгибов полипептидной цепи. Все полярные группы, образованные лизином, аргинином, глутамином, аспарагином, гистидином, треонином, тирозином и триптофаном, находятся на поверхности и соединены с молекулами воды, а неполярные остатки сконцентрированы в центре. Поэтому молекула М. компактна и устойчива к изменениям pH и ионной силы р-ра.
По своим свойствам глобин М. близок к альбуминам. Гем М. расположен в углублении, находящемся на определенном изгибе полипептидной цепи вблизи поверхности молекулы. Это делает гем более доступным различным воздействиям. Одной координационной связью (пятой) гем соединен с гистидиновым остатком альфа-спирали, а шестая координационная связь железа гема может быть занята водой, кислородом, окисью углерода или другими соединениями. При взаимодействии с кислородом (оксигенации) в глобине молекулы М. не происходит структурных изменений. Пигмент мышц не способен соединяться с двуокисью углерода (CO2).
Доказано существование двух конформеров (А и В) нативного состояния М., к-рые отличаются по своим свойствам и структуре. Переход конформера А в конформер В протекает при повышении температуры от 20 до 40° и отражается на активности гема. Высокотемпературный конформер В является менее реакционноспособным.
М. человека и животных имеет неодинаковую форму кристаллов: тонкие, игловидные, собранные в пучки (человек), ромбические таблички (рогатый скот) и др. М. подобно гемоглобину (см.) образует различные производные, отличающиеся друг от друга по спектрам поглощения. При соединении с кислородом М. превращается в оксимиоглобин (MgbO2), в к-ром железо гема является двухвалентным. С помощью метода дифракции рентгеновских лучей показано, что оксигенация М. сопровождается пространственным смещением железа от середины порфиринового кольца по направлению к проксимальному гистидину (F-8) полипептидной цепи на 0,033 нм. В гемоглобине же оксигенация вызывает гораздо большее смещение атома железа (0,04— 0,05 нм) и изменения в четвертичной структуре всей молекулы пигмента крови.
Вдыхание животными воздуха, содержащего окись углерода в повышающихся концентрациях (0,01—0,2%), приводит не только к увеличению содержания карбоксигемоглобина в крови, но и к связыванию окиси углерода миоглобином с образованием карбоксимиоглобина (MgbCO), железо гема к-рого также находится в двухвалентном состоянии. Когда количество карбоксигемоглобина в крови достигает 60%, содержание карбоксимиоглобина в скелетных мышцах составляет 10—50%, а в мышце сердца — от 6 до 44%. MgbCO обнаружен и в мышцах людей, погибших от отравления: угарным газом. Воздействие на М. окислителей обусловливает возникновение метмиоглобина (метMgb). Превращение М. в метMgb при окислении происходит очень легко и при одинаковых условиях в 12—14 раз превышает скорость образовании метгемоглобина. В то же время в мышцах животных эта реакция после внутривенного вливания окисляющих ядов протекает более медленно, чем окисление гемоглобина.
Максимумы полос поглощения М. и его производных расположены при следующих значениях длин волн: для MgbO2 — 582, 542, 415 нм; для Mgb — 602, 560, 436 нм; для MgbCO — 585, 542, 423 нм; для метMgb — 630, 500, 409 нм. Известный другие производные пигмента: сульфмиоглобин, нитроксимиоглобин, цианмиоглобин и т. д. В реакциях сопряженного окисления М. переходит в зеленый пигмент — вердомиоглобин, а при более глубоком распаде — в желчные пигменты (см.).
Биосинтез М. происходит в мышцах со значительно меньшей скоростью по сравнению с гемоглобином. После введения животным меченого железа оно обнаруживается в гемоглобине уже спустя 6—8 дней, а в М. только через месяц. Продолжительность существования М. составляет 80 дней. В процессе эмбриогенеза М. раньше всего появляется в мышце сердца.
В мышцах позвоночных М. локализуется в саркоплазме на уровне диска А и связан электростатически с наружной мембраной митохондрий или саркоплазматического ретикулума (см. Мышечная ткань).
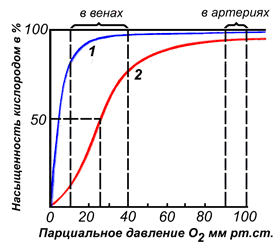
Создаваемый с помощью М. резерв кислорода в мышцах прежде всего определяется концентрацией в них пигмента и его способностью подвергаться оксигенации и деоксигенации. М. поддерживает постоянный уровень оксигенации во время мышечного сокращения, создавая определенный градиент напряжения кислорода между капиллярами и мышечными клетками, обеспечивая, т. о., возможность его утилизации при усилении окислительных процессов в работающих мышцах. Благодаря высокому сродству к кислороду полунасыщение им М. происходит менее чем за 0,1 сек. (при pO2 = 3,3 мм рт. ст.). При pO2, равном 5 мм рт. ст. (минимальное для деятельности цитохромоксидазы), диссоциирует до 40% оксимиоглобина, повышая, т. о., количество кислорода, растворенного в саркоплазме. М. участвует в молекулярном механизме его транспорта в клетку путем создания градиента и ускорения диффузии. Не исключена возможность непосредственного переноса кислорода М. при поступательном движении молекулы пигмента. Благодаря наличию пероксидазных свойств М. обладает ферментативной активностью. Доказана возможность включения М. в работу фосфорилирующей дыхательной цепи в качестве акцептора электронов от восстановленных коферментов пиридинового типа (НАД-H и в меньшей степени НАДФ-Н).
Существующие методы количественной оценки содержания М. включают электрофорез (см.) и ионообменную хроматографию (см.). Разделение М. и гемоглобина достигается благодаря их различной растворимости в 3 М фосфатном буфере при pH 6,6 (гемоглобин при этом значении pH нерастворим). Спектрофотометрическая регистрация количества М. основана на разнице в светопоглощении карбокси- и цианметсоединений М. и гемоглобина в видимой части спектра (см. Спектрофотометрия). Предложены также гистохимические методы определения М., основанные на бензидин-пероксидазной активности пигмента. Они позволяют с достаточной достоверностью выявлять М. в мышечной ткани и устанавливать закономерности в локализации и распределении М. в норме и их изменения при различных патол, состояниях.
Миоглобин в судебно-медицинском отношении
Миоглобин в судебно-медицинском отношении имеет значение в случаях прижизненного поражения скелетных мышц, сопровождающегося высвобождением М. При этом М. накапливается в плазме крови. При концентрации, превышающей 30 мг%, развивается миоглобинурия (см.), к-рая наряду с шоковым и коматозным состоянием, интоксикацией и пр. служит патогенетическим фактором развития миоглобинурийного нефроза (см. Нефротический синдром). Повреждение мышц, сочетающееся с обширными гематомами или внутрисосудистым гемолизом, кроме того, ведет к возникновению гемоглобинемии (см.), приводящей в последующем к миоглобинурии и миоглобинурийному нефрозу. Т. о., миоглобинемия и обусловленные ею процессы служат экспертным критерием поражения скелетной мускулатуры и доказательством его прижизненности.
Миоглобинемия может иметь место при механической травме (одномоментная травма обширных мышечных массивов, так наз. краш-синдром, или синдром раздавливания), отравлении миолитическими ядами, в т. ч. пищевыми (токсический миозит), при нарушении артериального или венозного кровообращения в конечностях (тромбоз или тромбоэмболия крупных артерий, тромбоз вен, синдром жгута, состояние после реплантации конечностей), при длительном пребывании человека в одной и той же позе (позиционное сдавление), при ожогах, обморожениях, при судорожных состояниях (эпилепсия, столбняк и т. д.).
Библиография: Атанасов Б. П. Модели конформеров нативного состояния миоглобина, Молек. биол., т. 4, в. 3, с. 348, 1970, библиогр. ; Верболович П. А. и Верболович В. П. Миоглобин и использование кислорода в животном организме, в кн.: Полярографическое определение кислорода в биол, объектах, под ред. В.А. Березовского, с. 123, Киев, 1974, библиогр.; Свадковский Б. С. Острый пигментный нефроз и его судебно-медицинская оценка, М., 1974, библиогр.; Троицкая О. В. Миоглобин, его химическое строение и функции в организме, Вопр, мед. хим., т. 17, в. 5, с. 451, 1971, библиогр.; Murray J. D. On the role of myoglobin in muscle respiration, J. theor. Biol., v. 47, p. 115, 1974, bibliogr.; Wittenberg J. B. Myoglobin — facilitated oxygen diffusion, role of myoglobin in oxygen entry into muscle, Physiol. Rev., v. 50, p. 559, 1970, bibliogr.
П. А. Верболович, В. П. Верболович; М. В. Кисин (суд.-мед.).
Как называется белковая часть миоглобина
Миоглобин – белок, который связывает кислород и поставляет его скелетным мышцам. Его концентрация в крови возрастает при повреждении скелетных мышц или миокарда.
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Миоглобин – белок, который содержится в скелетной мускулатуре и сердечной мышце – миокарде. Использование запасенного О2 в мышечной ткани начинается при выраженном снижении парциального давления кислорода в мышцах. Он способен связывать кислород в мышечных клетках, что дает им энергию для сокращения. В норме миоглобина в крови настолько мало, что он не определяется лабораторными методами. При повреждении скелетных мышц или миокарда миоглобин в больших количествах попадает в кровоток. Он не является специфичным маркером повреждения миокарда, в отличие от креатинкиназы МВ и тропонина, однако реагирует на гибель мышечных клеток сердца одним из первых – через 1-2 часа его концентрация в крови увеличивается.
Миоглобин фильтруется почками и выводится из организма с мочой. Если происходит массивное повреждение мышц, например, в результате серьезной травмы, он начинает в больших количествах поступать в кровь и может повреждать почки, вызывая острую почечную недостаточность. При отсутствии воспалений или повреждений мышечной ткани он практически не фиксируется в крови. Это его свойство используется для уточнения диагноза «инфаркт миокарда».
Для чего используется исследование?
Анализ на миоглобин, как правило, назначается вместе с другими маркерами повреждения сердечной мышцы, такими как креатинкиназа МВ, и используется для того, чтобы подтвердить или исключить инфаркт миокарда у пациентов с острой болью в сердце или другими симптомами.
Миоглобин начинает повышаться через 1-2 часа после повреждения миокарда, достигает своего пика через 8-12 часов и к концу дня обычно приходит в норму. Тропонин – «золотой стандарт» в определении инфаркта, так как он является более специфичным, однако преимущество миоглобина состоит в том, что он реагирует максимально рано, тем самым позволяя быстрее поставить диагноз. С другой стороны, необходимо понимать, что миоглобин может повышаться и без повреждения сердечной мышцы. Таким образом, отрицательный результат анализа на миоглобин исключает инфаркт, положительный – требует подтверждения тропонином.
Иногда тест на миоглобин необходим людям с серьезными травмами для того, чтобы определить вероятность поражения почек.
Когда назначается исследование?
Анализ на миоглобин назначается при подозрении на острый инфаркт миокарда. Кровь берут сразу при поступлении пациента в стационар и потом еще несколько раз через каждые 2-3 часа.
Такой тест обычно назначается вместе с другими маркерами повреждения сердечной мышцы, такими как креатинкиназа МВ и тропонин, что позволяет более уверенно судить о наличии или, напротив, отсутствии острого повреждения сердечной мышцы.
Кроме того, это исследование может понадобиться после массивных повреждений скелетной мускулатуры, чтобы оценить риск повреждения почек и острой почечной недостаточности.
Что означают результаты?
Обычно содержание миоглобина в крови настолько несущественно, что даже не может быть измерено.
Повышение уровня миоглобина в крови говорит о недавнем повреждении скелетных или сердечной мышц. Назначение тропонина или креатинкиназы МВ позволяет уточнить причину повышения миоглобина. Если в течение 12 часов боли в грудной клетке повышения миоглобина не произошло, вероятность инфаркта миокарда крайне маловероятна.
Так как миоглобин, помимо сердца, содержится еще в скелетной мускулатуре, он может повышаться и в других ситуациях:
Что может влиять на результат?
Структура и функции сложных белков. Строение и функции миоглобина и гемоглобина.
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
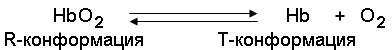
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.