Как называется реакция отщепления воды
Реакция дегидратации
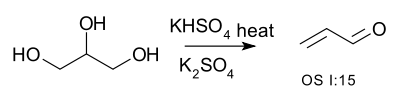
Дегидрата́ция — реакция отщепления воды от молекул органических соединений
При дегидратации глицерина образуется акролеин:
Полезное
Смотреть что такое «Реакция дегидратации» в других словарях:
Реакция Эльбса — Реакция Эльбса пиролитическая циклизация орто метилбензофенона в конденсированные полиароматические соединения. Реакция названа в честь её открывателя, немецкого химика Карла Эльбса, также он открыл реакцию, сейчас называемую окислением… … Википедия
Химические свойства спиртов — Химические свойства спиртов это химические реакции спиртов во взаимодействии с другими веществами. Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием: Чем больше… … Википедия
Шикиматный путь — Шикиматный путь метаболический путь, промежуточным метаболитом которого является шикимовая кислота (шикимат). Шикиматный путь наряду с поликетидным (ацетатно малонатным) механизмом построения бензольных ядер отмечается как… … Википедия
Гликоли — (хим.) (Glycol фр. и англ., Glykol нем.). Г., С2Н6О2 = СН2(ОН).СН2(ОН), получен в 1856 г. Вюрцем как продукт омыления едким кали уксуснокислого эфира С2Н4(О2C2Н3)3 + 2КНО = СН2(ОН).СН2(ОН) + 2КС2Н3О2, полученного, в свою очередь, взаимодействием… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
кирпич — искусственный камень правильной формы (обычно параллелепипед размером 250 5 120 5 65 мм), сформированный из минеральных материалов и приобретший камнеподобные свойства после обжига или обработки паром. Является одним из самых древних… … Энциклопедия техники
Дегидратация (значения) — Дегидратация (англ. dehydration): Дегидратация в медицине то же, что обезвоживание. Дегидратация в авиации постепенная потеря жидкости в самолёте во время полёта. Реакция дегидратации в органической химии реакция с отщеплением молекул воды … Википедия
Дегидрадация — Термин «дегидратация» может означать: Реакция дегидратации в органической химии реакция с отщеплением молекул воды Дегидратация (авиация) постепенная потеря жидкости в самолёте во время полёта Дегидратация (синдром) в медицине болезненное… … Википедия
Дегидратация — Термин «дегидратация» может означать: Реакция дегидратации в органической химии реакция с отщеплением молекул воды Дегидратация (авиация) постепенная потеря жидкости в самолёте во время полёта Дегидратация (синдром) в медицине болезненное… … Википедия
Дегидрация — Термин «дегидратация» может означать: Реакция дегидратации в органической химии реакция с отщеплением молекул воды Дегидратация (авиация) постепенная потеря жидкости в самолёте во время полёта Дегидратация (синдром) в медицине болезненное… … Википедия
Дитиосульфатоаурат(I) натрия — Общие Систематическое наименование Дитиосульфатоаурат(I) натрия Химическая формула Na3Au(S2O3)2 Эмпирическая формула Na3AuS4O6 … Википедия
Большая Энциклопедия Нефти и Газа
Реакция отщепления воды от спиртов с образованием олефинов давно известна. [5]
Дегидратацией называется реакция отщепления воды от реагирующих молекул. Дегидратация спирта происходит при нагревании его с концентрированной серной кислотой или при пропускании ггаров спирта через нагретую трубку с окисью алюминия. И в том и в другом случае в зависимости от условий реакция может протекать по-разному. [9]
Дегидратацией называется реакция отщепления воды от реагирующих молекул. Дегидратация спирта происходит при нагревании его с концентрированной серной кислотой или при пропускании паров спирта через нагретую трубку с окисью алюминия. И в том и в другом случае в зависимости от условий реакция может протекать по-разному. [10]
Оказалось, что реакция отщепления воды от этих алкоголен идет в двух различных направлениях: либо с изомеризацией, либо без изомеризации цикла. [12]
Метод основан на реакции отщепления воды ( дегидратация) от жирной кислоты, входящей в состав касторового масла. В результате дегидратации невысыхающее касторовое масло превращается в высыхающее. [13]
Оказалось, что реакция отщепления воды от этих алкоголей идет в двух различных направлениях: без изменения или с изменением числа углеродных атомов в цикле исходного алкоголя ( стр. [14]
Оказалось, что реакция отщепления воды от этих алкоголей идет в двух различных направлениях: либо с изомеризацией, либо без изомеризации цикла. [15]
отщепление воды
Смотреть что такое «отщепление воды» в других словарях:
дегидратация — отщепление воды … Cловарь химических синонимов I
ДЕГИДРАТАЦИЯ — отщепление воды от молекул орг. или неорг. соединений. Осуществляется термически (обычно в присут. катализаторов) или под. действием в в, связывающих воду (т. н. дегидратирующих агентов, напр. Р 2 О 5, H2SO4). Различают внутри и межмолекулярную Д … Химическая энциклопедия
ДЕГИДРАТАЦИЯ — отщепление воды от хим. соединений; реакция, обратная гидратации. Применяется, напр., для получения ангидридов к т из к т, безвод. солей из их кристаллогидратов, этилена из этилового спирта … Естествознание. Энциклопедический словарь
Пропен — Пропилен Общие Химическая формула C3H6 Молярная масса 42.08 г/моль … Википедия
АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ — А. МОНОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ 1. С1 : металлоорганические соединения. Эти соединения обычно получают двумя методами: а) действием активного металла (Na, Li, Mg, Zn) на органический галогенид, например: или б) действием галогенида менее… … Энциклопедия Кольера
Пропилен — Пропилен … Википедия
Нитрилы — карбоновых кислот, цианистые соединения, RC ≡ N, органические производные синильной кислоты. Их структурные изомеры Изонитрилы. Первый представитель ряда Цианистый водород HCN (формонитрил). Низшие алифатические Н. жидкости с… … Большая советская энциклопедия
дегидратация — отщепление воды от химических соединений; реакция, обратная гидратации. Применяется, например, для получения ангидридов кислот из кислот, безводных солей из их кристаллогидратов, этилена из этилового спирта. * * * ДЕГИДРАТАЦИЯ ДЕГИДРАТАЦИЯ,… … Энциклопедический словарь
Органический синтез — Органический синтез раздел органической химии и технологии, изучающий различные аспекты (способы, методики, идентификация, аппаратура и др.) получения органических соединений, материалов и изделий, а также сам процесс получения веществ.… … Википедия
Типы химических реакций в органической химии
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:
Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например:
Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение:
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:
Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:
Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона:
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов:
Реакции нуклеофильного присоединения
Реакции электрофильного замещения
Реакции электрофильного присоединения
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов
Реакции радикального присоединения
Характерны для алкенов и алкинов
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Реакции электрофильного присоединения к алкенам
Электрофильные реагенты являются наиболее характерными атакующими частицами в реакциях алкенов, идущих по С-Сπ связи.
Многочисленные экспериментальные данные свидетельствуют о том, что в отличие от реакций гидрирования электрофильное присоединение осуществляется по асинхронному типу.
Механизм реакции электрофильного присоединения к алкенам
Рассмотрим типичную реакцию электрофильного присоединения к алкенам — реакцию бромирования этилена:
Механизм реакции электрофильного присоединения к алкенам, в частности бромирования, в настоящее время представляется следующим
Доказательства механизма электрофильного присоединения к алкенам основаны на следующих фактах.
Циклический «неклассический» карбокатион, например норборнильный, образуется в некоторых реакциях мостиковых бициклических углеводородов и их производных. В таких «неклассических» карбокатионах атом углерода становится пентакоординированным. По В. А. Бархату [104, с. 227-411], «неклассический ион есть положительно заряженная частица, обладающая минимумом свободной энергии при данных межъядерных расстояниях, в которой делокализация положительного заряда осуществляется с помощью многоцентровой молекулярной орбитали, образованной, по меньшей мере частично, σ-перекрыванием атомных орбиталей атомов, по крайней мере часть из которых не связана между собой σ-остовом». Примерами таких ионов являются:
Направление электрофильного присоединения к алкенам. Правило Марковникова
Присоединение реагентов типа НХ к несимметричным алкенам идет по аналогичному бромированию механизму, но в данном случае возникает проблема направления присоединения.
В. В. Марковников в 1870 г. сформулировал правило, согласно которому кислоты присоединяются к несимметричным алкенам таким образом, что водород кислоты присоединяется к атому углерода, несущему наибольшее число атомов водороду. Это правило легко понять, если принять во внимание механизм реакции электрофильного присоединения, например:
Положительный конец диполя НВr ориентируется к атому углерода с наибольшей электронной плотностью, то есть к концевому. Из двух возможных карбокатионов А и Б первый, несомненно, более устойчив (стабилизация за счет положительных индуктивных эффектов трех метильных групп) и образуется быстрее. В результате при электрофильном присоединении в основном образуется mpem-бутилбромид. Следовательно, в современной трактовке правило Марковникова можно сформулировать следующим образом: присоединение НХ к алкену идет с образованием наиболее стабильного карбокатиона. Правило Марковникова в такой формулировке объясняет редкие случаи электрофильного присоединения к алкенам против классически сформулированного правила Марковникова. Например, в реакции присоединения НСl к алкену с сильной электроноакцепторной группой образуется более стабильный карбокатион А, а протон присоединяется к менее гидрогенизированному атому углерода:
Примеры реакций электрофильного присоединения
Естественное предположение о возможности присоединения к алкенам самых разнообразных электрофильных реагентов находит экспериментальное подтверждение. Необходимо, однако, помнить, что поляризация С-Сπ связи происходит в момент химической реакции, то есть реагент должен быть достаточно сильным электрофилом. Слабые электрофилы или, тем более, нуклеофилы должны быть «электрофилизированы» добавлением сильного электрофила (кислоты).
Среди типичных реагентов отметим:
Галогенирование.
Расчеты тепловых эффектов реакций галогенирования алкенов дают следующие результаты:
Все реакции галогенирования принципиально возможны и практически осуществимы, за исключением фторирования. Эта реакция вследствие очень высокой экзотермичности не поддается контролю. Легкость осуществления реакций галогенирования, например бромирования, в обычных органических растворителях, таких, как хлороформ, четыреххлористый углерод, широко используют в аналитических целях для качественного определения наличия двойной связи в органических соединениях.
Присоединение кислот к алкенам.
Механизм и особенности присоединения к алкенам рассмотрены выше. Отметим среди реакций этого типа взаимодействие с серной кислотой, которое лежит в основе важных технических процессов:
Гипогалогенирование.
Реакция гипохлорирования лежит в основе промышленного синтеза глицерина. Пропилен после пр вращения в хлористый аллил или аллиловый спирт подвергают действию хлорноватистой кислоты, которая взаимодействует по механизму электрофильного присоединения к алкенам.
Акцепторное влияние двух атомов хлора приводит к образованию обоих карбокатионов А и Б и, соответственно, смеси дихлорпропанолов. Собственно глицерин получают щелочным омылением дихлорпропанолов:
Гидратация алкенов (присоединение воды).
Вода является слабым электрофилом, и по этой причине ее прямое присоединение к алкенам осуществить не удается. Однако в присутствии сильных минеральных кислот в результате гидратации образуются спирты. Так получают синтетический этиловый спирт, техническую потребность в котором промышленность удовлетворяет гидратацией этилена, выделяемого из газов крекинга или продуктов пиролиза легких алканов (этана, пропана, бутана).
При сернокислотном методе пропусканием этилена через концентрированную серную кислоту получают этил сульфат (этил серную кислоту), который реагирует с водой, давая в итоге спирт и кислоту:
С фосфорной кислотой гидратация осуществляется под давлением. Спирт в данном случае образуется сразу при взаимодействии карбокатиона с водой.
Реакцию гидратации можно осуществить и в газовой фазе — при высоких температуре и давлении. В качестве катализаторов обычно применяют оксид алюминия ( Аl2O3 ), хлористый цинк ( ZnCl2 ) и др. Гомологи этилена образуют вторичные и третичные спирты.
Образование простых эфиров.
Присоединение спиртов к алкенам в присутствии сильных кислот приводит к образованию простых эфиров:
Образование сложных эфиров.
Карбоновые кислоты образуют с алкенами сложные эфиры. Реакция ускоряется сильными минеральными кислотами:
Алкены с галогенангидридами и ангидридами карбоновых кислот в присутствии кислот Льюиса дают продукт присоединения, который в зависимости от условий реакции далее превращается в непредельный кетон, насыщенный кетон и др.:
Непредельный кетон может образоваться и в результате отщепления протона от карбокатиона [46, т. 3].
Комплексы с переходными металлами.
В промышленности алкены из крекинг-газов выделяют с помощью раствора CuCl в аммиаке, а лучше — этаноламине.
Сорбция осуществляется при повышенном давлении, десорбция — при пониженном.
Алкилирование.
Одной из важнейших в практическом плане реакций алкенов является алкилирование — введение алкильной группы, которое приводит к алканам и может быть осуществлено различными методами.
Синтез изоалканов — высокооктанового бензина — реализован в промышленности в нескольких модификациях.
Сернокислотное алкилирование осуществляют действием 60%-ной серной кислоты на низшие алкены, выделяемые из газов крекинга или пиролиза пропан-бутановой фракции.
Трет-Бутилкатион реагирует с алкеном смеси (на схеме представлен один из вариантов). Стабилизация карбокатиона А отщеплением протона (вода прерывает процесс полимеризации) приводит к смеси алкенов, гидрирование которой дает изооктан.
Процесс, разработанный В. Н. Ипатьевым, в котором взаимодействие изобутилен-изобутановой смеси осуществляется в присутствии «твердой фосфорной кислоты» (фосфорная кислота на оксиде алюминия) или фторида бора, является примером катионоцепной реакции (см. раздел 9.5.5). Крупнотоннажное производство по этой схеме успешно реализовано самим Ипатьевым в США в 30-е годы. Взаимодействие алкенов с аренами (ароматическими углеводородами) рассмотрено в главе XV.