Как называют клетки мышечной ткани
Как называют клетки мышечной ткани
Это ткань энтомезенхимного происхождения, которая делится на два вида: висцеральную и сосудистую. В эмбриональном гистогенезе даже электронно-микроскопически трудно отличить мезенхимные предшественники фибробластов от гладких миоцитов. В малодифференцированных гладких миоцитах развиты гранулярная эндоплазматическая сеть, комплекс Гольджи. Тонкие филаменты ориентированы вдоль длинной оси клетки. По мере развития размеры клетки и число филаментов в цитоплазме возрастают. Постепенно объем цитоплазмы, занятый сократительными филаментами, увеличивается, расположение их становится все более упорядоченным. Пролиферативная активность гладких миоцитов в миогенезе постепенно снижается. Это происходит в результате увеличения продолжительности клеточного цикла, выхода клеток из цикла репродукции и перехода в дифференцированное состояние.
Однако и в дефинитивном состоянии в гладкой мышечной ткани клеточная регенерация в виде размножения миоцитов полностью не прекращается. Существуют данные о том, что пролиферация и дифференцировка в большей степени свойственна субпопуляции малых (по размерам) гладких миоцитов.
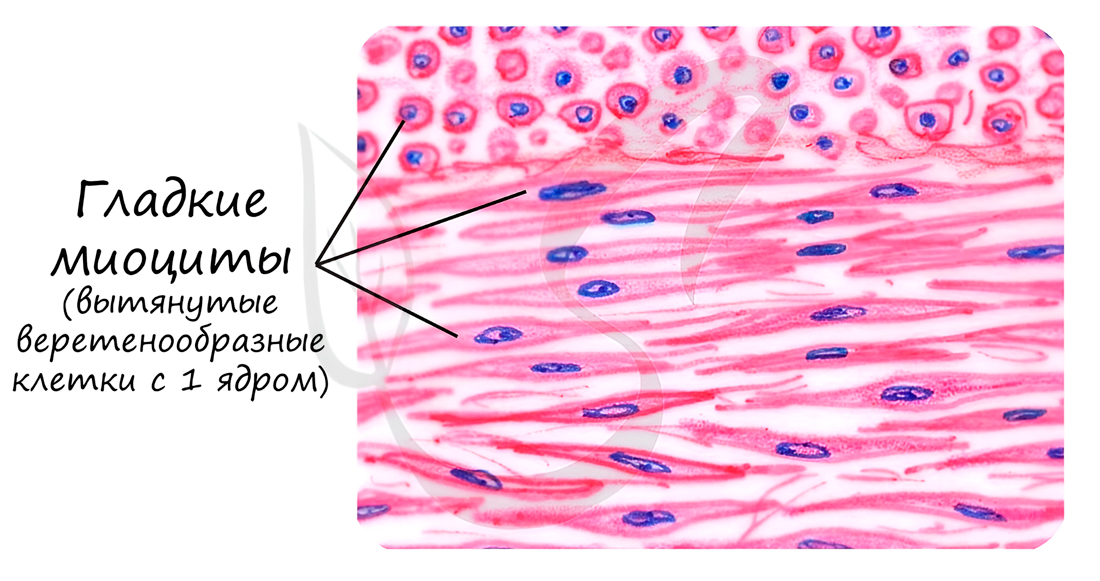
Строение гладкой мышечной ткани. Структура дефинитивных гладких миоцитов (лейомиоцитов), входящих в состав внутренних органов и стенки сосудов, имеет много общего, но в то же время характеризуется гетероморфией. Так, в стенках вен и артерий обнаруживаются овоидные, веретеновидные, отростчатые миоциты длиной 10-40 мкм, доходящие иногда до 140 мкм.
Наибольшей длины гладкие миоциты достигают в стенке матки — до 500 мкм. Диаметр миоцитов колеблется от 2 до 20 мкм. В зависимости от характера внутриклеточных биосинтетических процессов различают контрактилъные и секреторные миоциты. Первые специализированы на функции сокращения, но вместе с тем сохраняют секреторную активность. Плазмолемма расслабленной клетки имеет ровную поверхность, а при сокращении становится складчатой. В центре клетки имеется палочковидное ядро, которое при сокращении клетки спиралевидно изгибается. Практически все ядра миоцитов содержат диплоидное количество ДНК. Гладкая эндоплазматическая сеть занимает примерно 2-7% объема цитоплазмы, а гранулярная сеть в контрактильных миоцитах выражена плохо. Митохондрии мелкие, сферические или овоидные, расположены у полюсов ядра. Характерной чертой гладких миоцитов является наличие множества впячиваний (кавеол) плазмолеммы, содержащих ионы кальция.
Секреторные миоциты (синтетические) по своей ультраструктуре напоминают фибробласты, однако содержат в цитоплазме пучки тонких миофиламентов, расположенные на периферии клетки. В цитоплазме хорошо развиты комплекс Гольджи, гранулярная эндоплазматическая сеть, много митохондрий, гранул гликогена, свободных рибосом и полисом. По степени зрелости такие клетки относят к малодифференцированным.
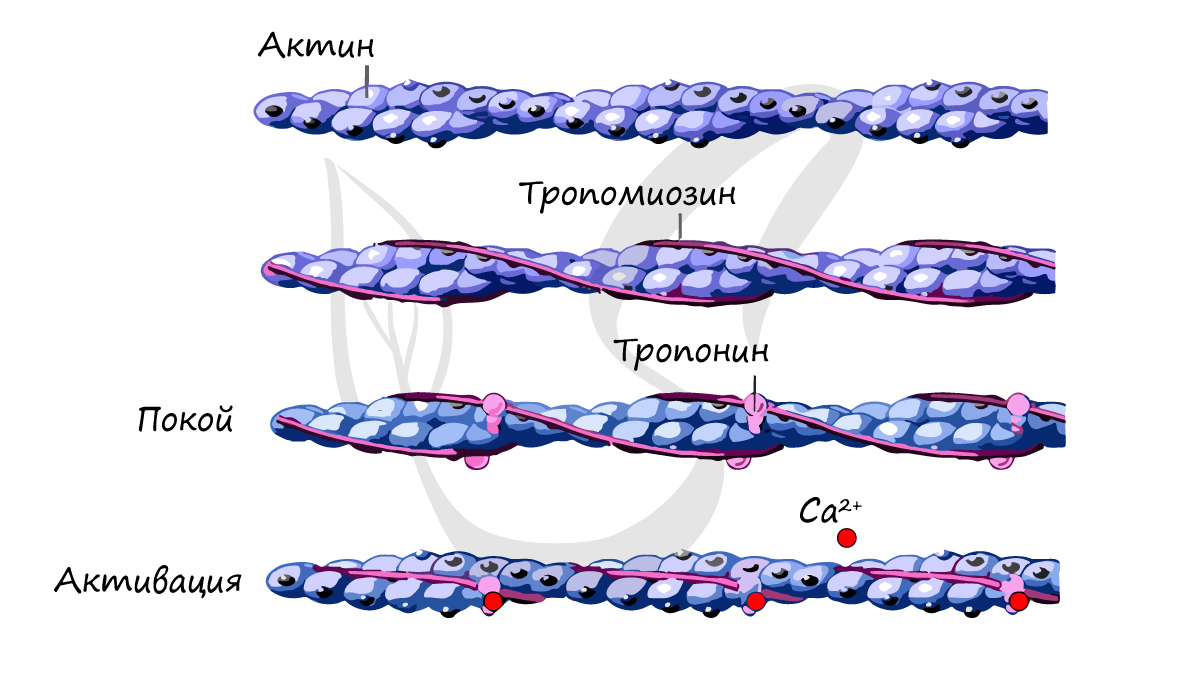
Сократительный аппарат миоцитов представлен тонкими актиновыми филамен-тами (гладкомышечным альфа-актином), связанными с тропомиозином. Толстые нити состоят из миозина, мономеры которого располагаются вблизи филаментов актина. Соотношение актиновых и миозиновых филаментов в гладком миоците составляет 12 к 1. Важным компонентом контрактильного аппарата миоцитов являются электронно-плотные структуры — тельца прикрепления, расположенные свободно в цитоплазме (плотные тельца) или тесно связанные с плазмолеммой. Основными белковыми компонентами плотных телец являются альфа-актинин, актин (немышечный) и кальпонин, что позволяет расссматривать их как функциональный эквивалент Z-линий миофибрилл скелетной мышцы. Актиновые филаменты фиксируются на плотных тельцах. Промежуточные филаменты, включающие десмин и виментин, обеспечивают связи между плотными тельцами и плазмолеммой, образуя прикрепительные пластины.
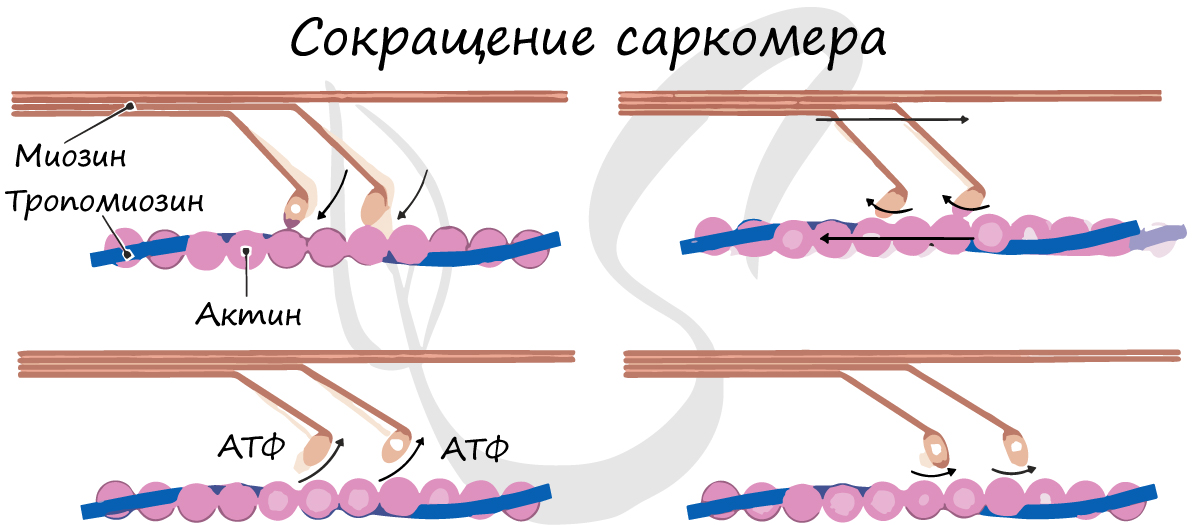
Сократительные белки формируют решетчатую структуру, закрепленную по окружности плазмолеммы, поэтому сокращение выражается в укорочении клетки, которая приобретает складчатую форму, тогда как в состоянии покоя клетка вытянута. При возникновении нервного импульса, распространяющегося по плазмолемме миоцита, происходит повышение уровня внутриклеточного Са2+, который поступает в цитоплазму из кавеол, отшнуровывающихся в цитоплазму в виде пузырьков. Высвобождение ионов кальция приводит к каскаду реакций, в результате которого происходит полимеризация миозина и образование перекрестных связей миозина вдоль актиновых филаментов по мере развития мышечного сокращения. Расслабление мышцы возникает при восстановлении концентрации исходного уровня Са2+ внутри клетки путем его перемещения внутрь саркоплазматической сети. При этом образовавшиеся в присутствии ионов кальция связи между актином и миозином нарушаются, акто-миозиновый комплекс распадается, гладкий миоцит расслабляется.
Гладкие миоциты синтезируют протеогликаны, гликопротеиды, проколлаген, проэластин, из которых формируются коллагеновые и эластические волокна и основное вещество межклеточного матрикса.
Взаимодействие миоцитов осуществляется с помощью цитоплазматических мостиков, взаимных впячиваний, нексусов, десмосом или простых участков мембранных контактов клеточных поверхностей.
Регенерация гладкой мышечной ткани
Гладкая мышечная ткань висцерального и сосудистого видов обладает значительной чувствительностью к воздействию экстремальных факторов.
В активированных миоцитах возрастает уровень биосинтетических процессов, морфологическим выражением которых являются синтез сократительных белков, укрупнение и гиперхроматоз ядра, гипертрофия ядрышка, возрастание показателей ядерно-цитоплазменного отношения, увеличение количества свободных рибосом и полисом, активация ферментов, аэробного и анаэробного фосфорилирования, мембранного транспорта. Клеточная регенерация осуществляется как за счет дифференцированных клеток, обладающих способностью вступать в митотический цикл, так и за счет активизации камбиальных элементов (миоцитов малого объема).
При действии ряда повреждающих факторов отмечается фенотипическая трансформация контрактильных миоцитов в секреторные. Данная трансформация часто наблюдается при повреждении интимы сосудов, формировании ее гиперплазии при развитии атеросклероза.
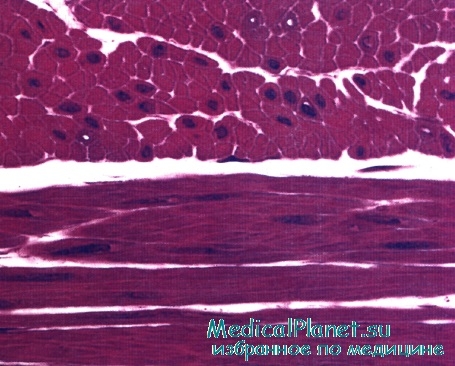
Окраска: парарозанилин—толуидиновый синий. Среднее увеличение.
Мышечные ткани
Общими свойствами всех мышечных тканей является сократимость и возбудимость. К данной группе тканей относятся гладкая, поперечнополосатая скелетная и поперечнополосатая сердечная мышечные ткани. Клетки мышечной ткани имеют хорошо развитый цитоскелет, содержат много митохондрий.
Гладкая (висцеральная) мускулатура
Эта мышечная ткань встречается в стенках внутренних органах (бронхи, кишечник, желудок, мочевой пузырь), в стенках сосудов, протоках желез. Эволюционно является наиболее древним видом мускулатуры.
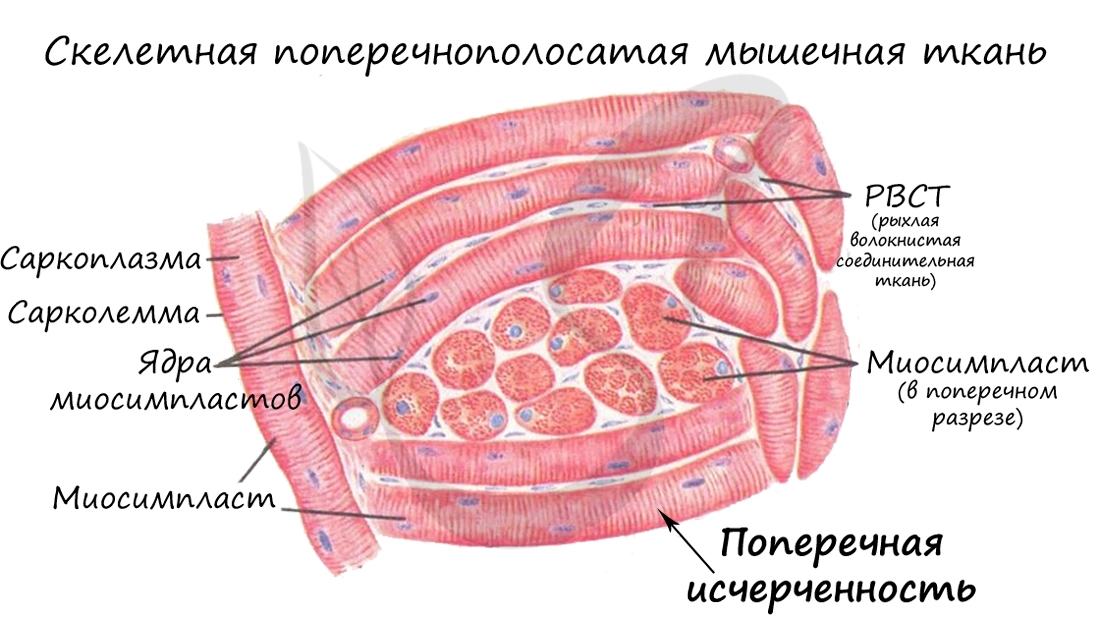
Особо заметим, что в гладкой мышечной ткани миофиламенты собираются в миофибриллы только во время сокращения. У таких временных миофибрилл не может быть регулярной организации, а значит ни у таких миофибрилл, ни у гладких миоцитов не может быть поперечной исчерченности.
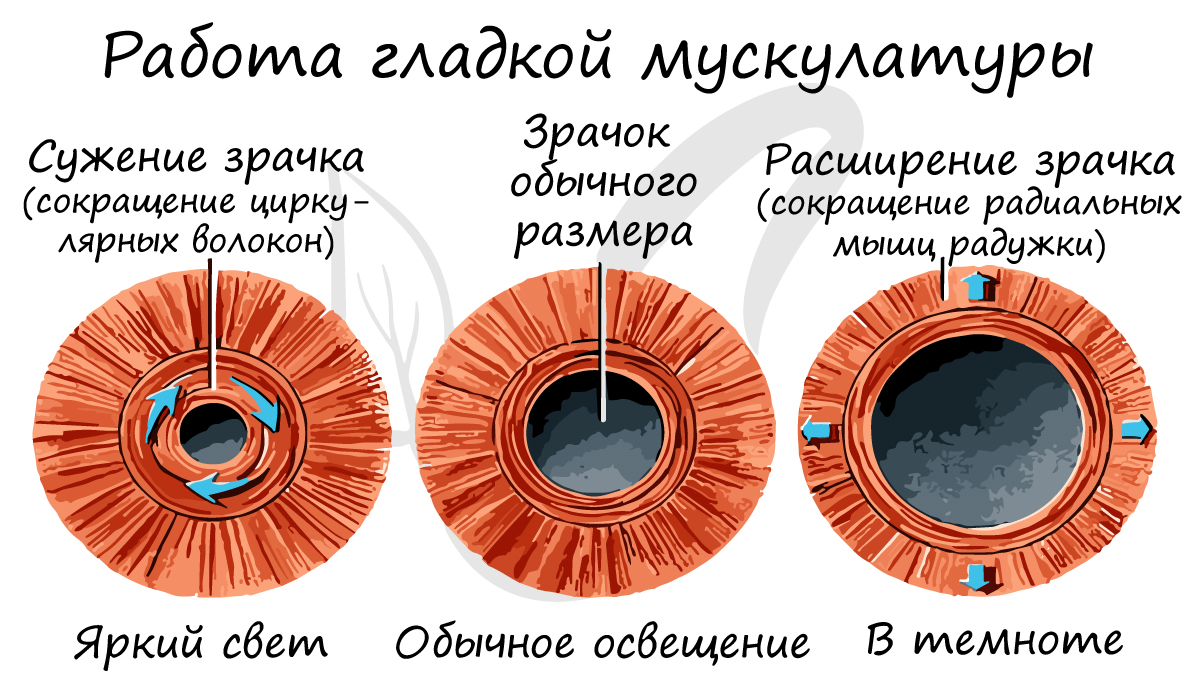
Гладкая мышечная ткань сокращается непроизвольно (неподвластна воле человека). Работа гладких мышц обеспечивается вегетативной (автономной) нервной системой. К примеру невозможно по желанию сузить или расширить бронхи, кровеносные сосуды, зрачок.
Гладкая мышечная ткань называется неисчерченной, так как не обладает поперечной исчерченностью, характерной для поперечнополосатых скелетной и сердечной мышечных тканей.
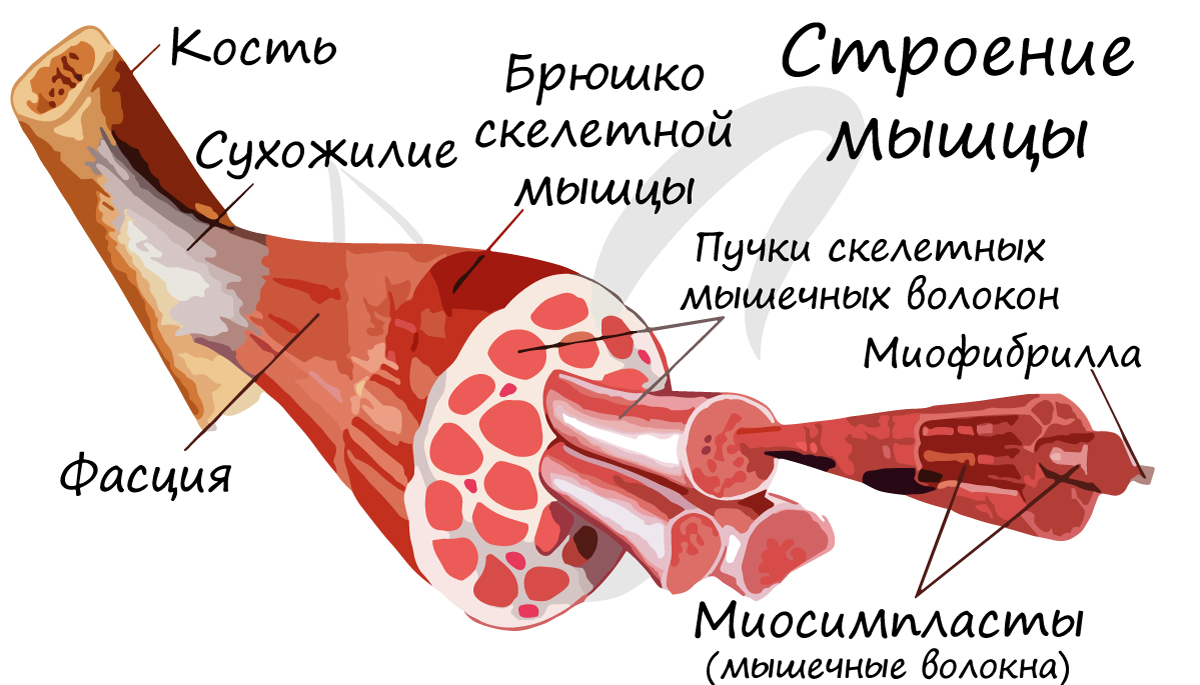
Скелетная (поперечнополосатая) мышечная ткань
Скелетная мышечная ткань образует диафрагму (дыхательную мышцу), мускулатуру туловища, конечностей, головы, голосовых связок.
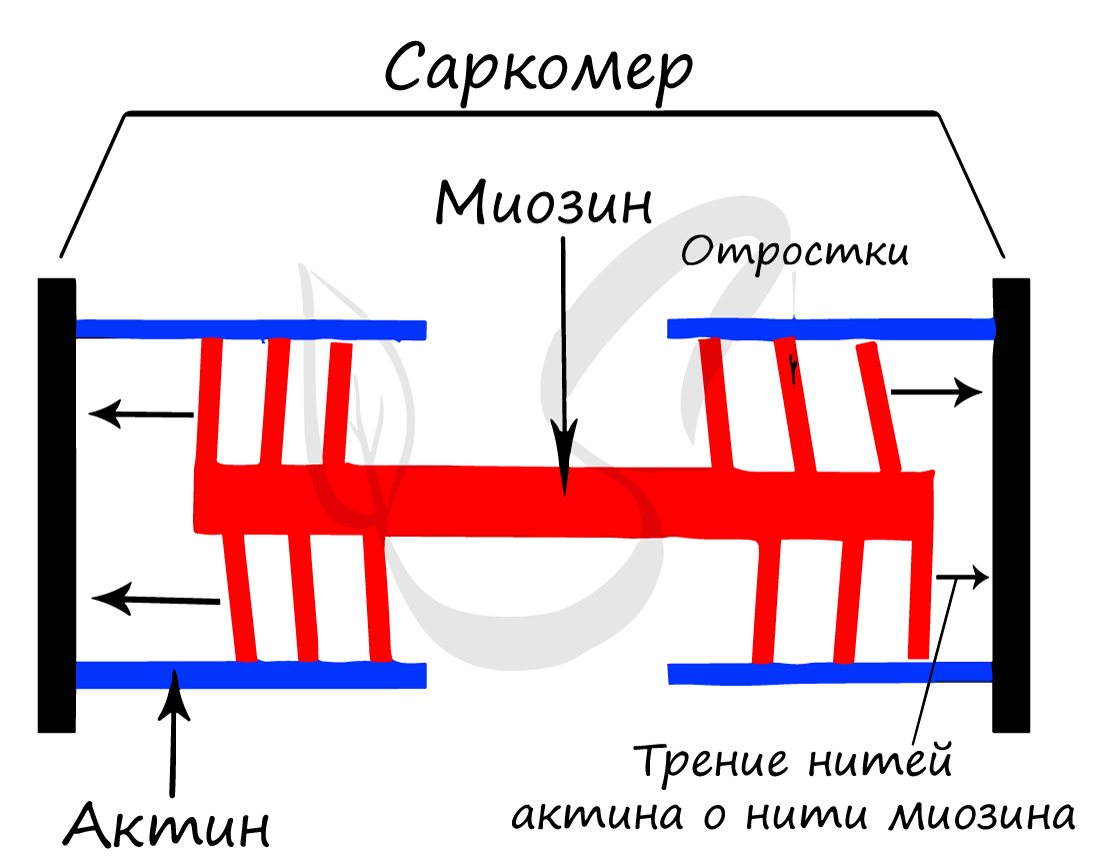
Саркомер состоит из актиновых (тонких) и миозиновых (толстых) филаментов, которые образованы главным образом белками актином и миозином. Сокращение происходит за счет взаимного перемещения миофиламентов: они тянутся навстречу друг другу, саркомер укорачивается (и мышца в целом).
Вернемся к скелетным мышцам. Имеется еще ряд важных моментов, о которых нужно знать.
Скелетные мышцы сокращаются произвольно: они подконтрольны нашему сознанию. К примеру, по желанию мы можем изменить скорость движения руки, темп бега, силу прыжка. Мышцы покрыты фасцией, крепятся к костям сухожилиями, и, сокращаясь, приводят в движение суставы.
Сердечная поперечнополосатая мышечная ткань
Большое число контактов между кардиомиоцитами обеспечивает высокую эффективность и надежность проведения возбуждения по миокарду. Сокращается эта ткань непроизвольно, не утомляется.
Ответ мышц на физическую нагрузку
В большинстве случае гипертрофия сердца обратима, а у спортсменов наблюдается так называемая физиологическая гипертрофия (вариант нормы).
Происхождение мышц
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Как называют клетки мышечной ткани
Введение
В современной медицине все больший интерес вызывают вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых в значительной мере связано с нарушением структуры и функций сердечной мышечной ткани (атеросклероз, инфаркт миокарда, гипертензия, астма и др.). В связи с необходимостью более глубокого изучения этиологии и патогенеза заболеваний сердечно-сосудистой системы, познания механизмов, лежащих в основе этих состояний, возрастает интерес к фундаментальным исследованиям структурно-функциональных особенностей сердечной мышечной ткани.
1 Общая характеристика сердечной мышечной ткани
Стенка сердца состоит из трех оболочек:
В организме человека все мышечные ткани, в том числе и сердечная мышечная ткань, специализированы на функции сокращения и развиваются на общей основе: гипертрофии и видоизменении сократимой механической актин-миозиновой системы.
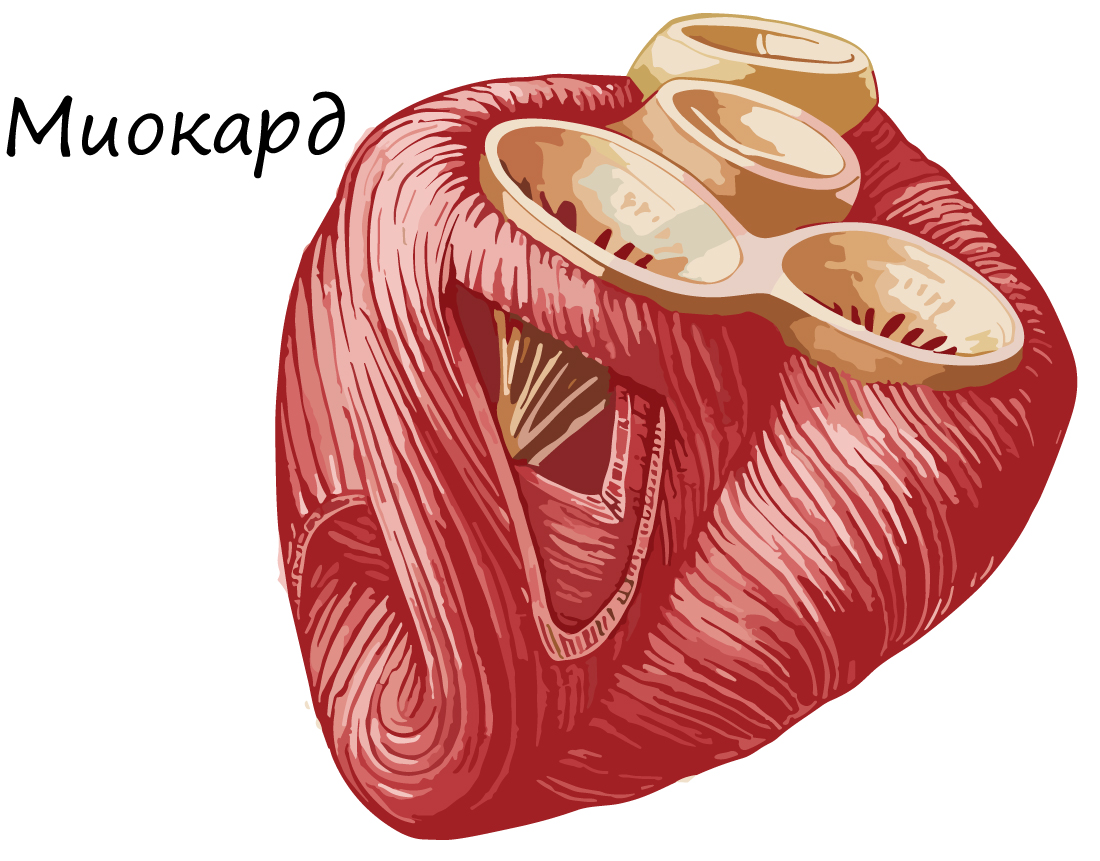
Сердечная мышечная ткань относится к поперечнополосатой мышечной ткани целомического типа, встречается только в мышечной оболочке сердца (миокарде) и устьях связанных с ним крупных сосудов; образована структурными элементами (клетками, волокнами), которые имеют поперечную исчерченность вследствие особого упорядоченного взаиморасположения в них актиновых и миозиновых миофиламентов и обладает спонтанными (непроизвольными) ритмическими сокращениями (рис. 1).
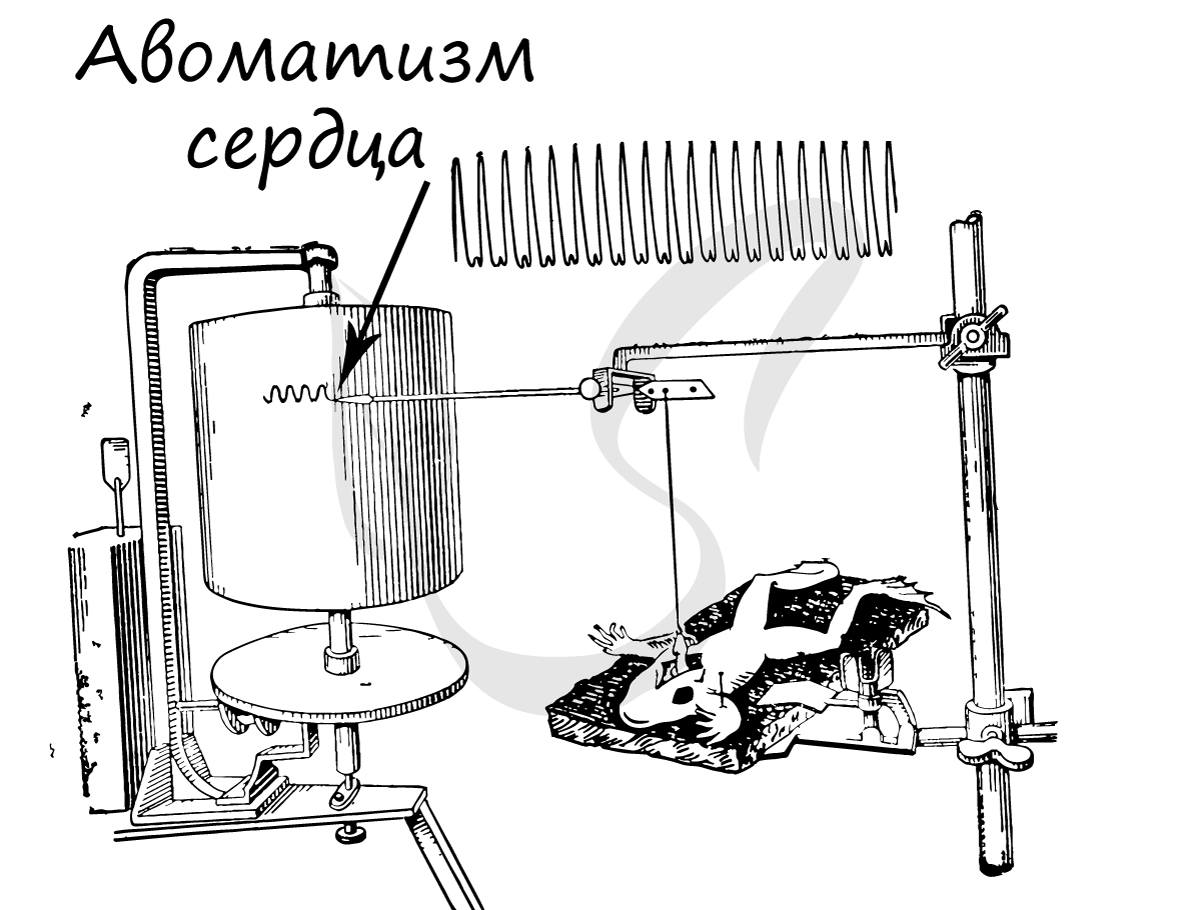
Основным функциональным свойством сердечной мышечной ткани является способность к спонтанным ритмическим сокращениям, на активность которых влияют гормоны и нервная система (симпатическая и парасимпатическая).
Для понимания структурно-функциональных особенностей сердечной мышечной ткани рассмотрим процессы ее формирования в период развития сердца и кардиомиогенеза.
2 Развитие сердца и кардиомиогенез
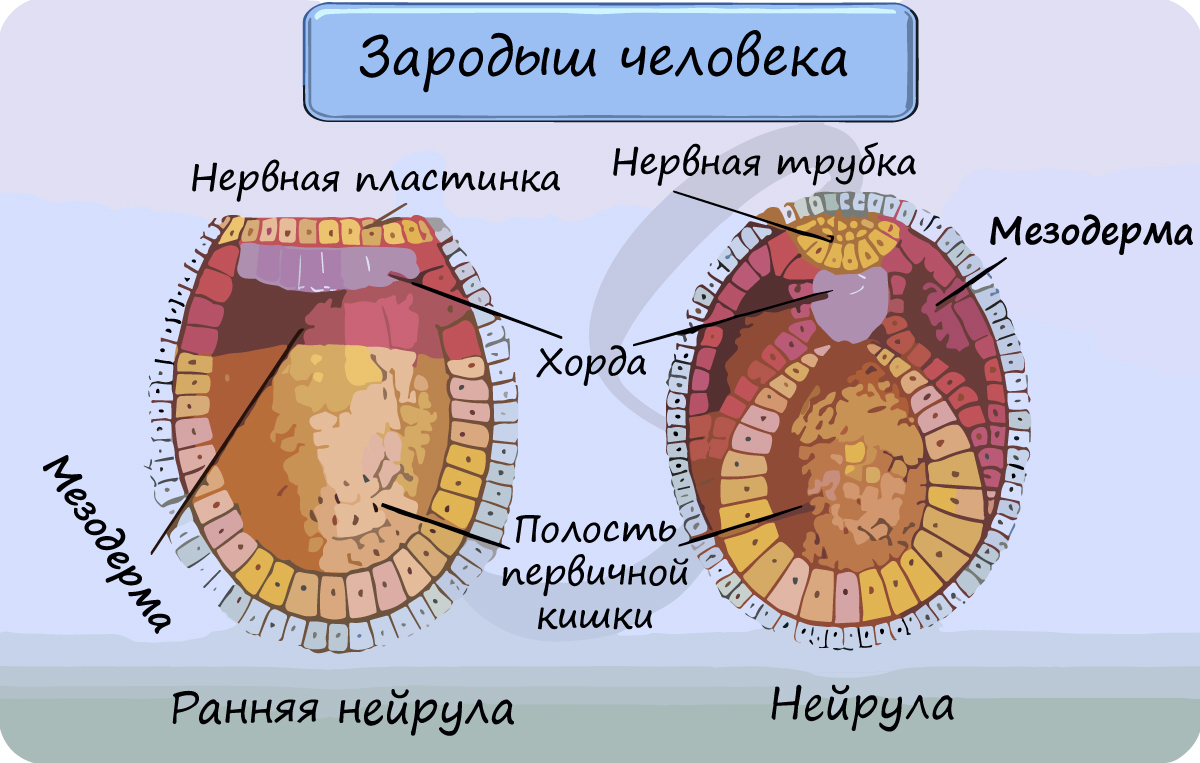
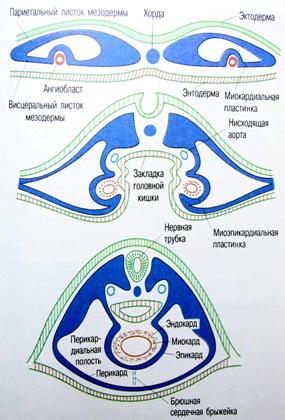
Закладка сердца человека происходит в начале 3-й недели развития (у эмбриона длиной 1,5 мм) и представлена парным скоплением мезенхимных клеток в задней части головного отдела эмбрионального щитка под висцеральным листком мезодермы (рис. 2, 3). С течением времени эти скопления превращаются в две удлиненные трубки, вдающиеся вместе с висцеральным листком мезодермы в целомическую полость тела, и выстилаются эндотелием. Позднее мезенхимные трубки сливаются и из их стенок образуется эндокард.
Рис. 3. Развитие сердца человека
Перикард формируется из париетального листка мезодермы.
Широкое пространство между эндотелиальными трубочками и миокардиальной пластинкой заполняется эндокардиальным гелем.
По мнению А.Г. Кнорре слой образующегося эпикарда (его мезотелиальное покрытие) нарастает на зачаток миокарда позднее, со стороны венозного синуса. Поэтому первичную закладку сердца предлагается называть не миоэпикардиальной пластинкой, а миокардиальной.
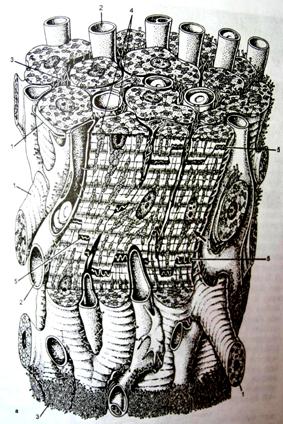
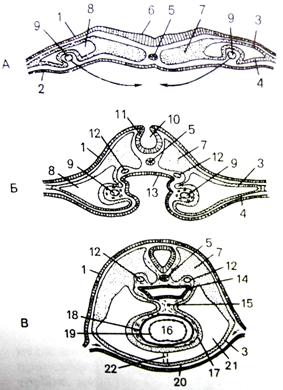
Клетки зачатка миокарда (миокардиальная пластинка), т.е. кардиомиобласты, производят процесс деления и на 2-м месяце эмбрионального развития в них появляются миофибриллы с поперечной исчерченностью. Z-полоски появляются одновременно с саркотубулярной сетью и поперечными инвагинациями клеточной мембраны (Т-системы). На плазмолеммах контактирующих миобластов образуются десмосомы. Формирующиеся миофибриллы прикрепляются к плазмолеммам, где позднее образуются вставочные диски.
В конце 2-го месяца начинает формироваться проводящая система сердца, завершение образования всех отделов которой завершается к 4-му месяцу. Развитие мышечной ткани левого желудочка происходит быстрее, чем правого.
Опорный скелет сердца образован фиброзными кольцами между предсердиями и желудочками и плотной соединительной тканью в устьях крупных сосудов. Кроме плотных пучков коллагеновых волокон, в состав опорного скелета сердца входят эластические волокна, а иногда встречаются хрящевые пластинки.
В процессе развития сердце человека увеличивается в объеме в 16 раз в сравнении с сердцем новорожденного, при этом в 15 раз возрастает объем кардиомиоцитов.
Таким образом, рост миокарда происходит из-за полиплоидизации ядер кардиомиоцитов и гипертрофии, которая свойственна внутриклеточной регенерации, т.е. умножением числа внутриклеточных структур и увеличением массы гиалоплазмы. Полиплоидизация и гипертрофия обеспечивают увеличение миокарда при его развитии, а также осуществляют компенсационный рост ответ на повышенную нагрузку на сердце, когда может происходить небольшой всплеск митотической активности, но часто без цитотомии.
В процессе развития сердечной мышечной ткани происходит инверсия митотического индекса: на ранних этапах развития максимальная пролиферативная активность наблюдается в желудочках, а позднее более интенсивно митозируют миоциты предсердий.
Итак, кардиомиоциты представляют собой некамбиальную, медленно растущую популяцию, не имеющую сателлитов.
2.1 Строение внутренней оболочки сердца эндокарда
Питание эндокарда производится в основном диффузно из-за наличия крови, находящейся в сердечных камерах. Кровеносные сосуды имеются только в наружном соединительнотканном слое эндокарда.
2.1.1 Клапаны сердца
Левый предсердно-желудочковый клапан появляется в виде эндокардиального валика, в который к 2,5 месяцам врастает соединительная ткань из эпикарда. На 4-м месяце из эпикарда в створку клапана врастает пучок коллагеновых волокон, образующий позже фиброзную пластинку. Правый предсердно-желудочковый клапан закладывается как мышечно-эндокардиальный валик. С 3-го месяца эмбриогенеза мышечная ткань правого атриовентрикулярного клапана уступает место соединительной ткани, врастающей со стороны миокарда и эпикарда. У взрослого человека мышечная ткань сохраняется в виде рудимента только с предсердной стороны в основании клапана. Таким образом, предсердно-желудочковые клапаны являются производными как эндокарда, так и соединительной ткани миокарда и эпикарда.
На границе между восходящей частью дуги аорты и левым желудочком сердца локализуются аортальные клапаны, которые по своему строению имеют много общего с предсердно-желудочковыми клапанами и клапанами легочной артерии.
2.2 Строение средней оболочки сердца миокарда
Различают два типа кардиомиоцитов:
2.2.1 Сердечные миоциты желудочков и предсердий
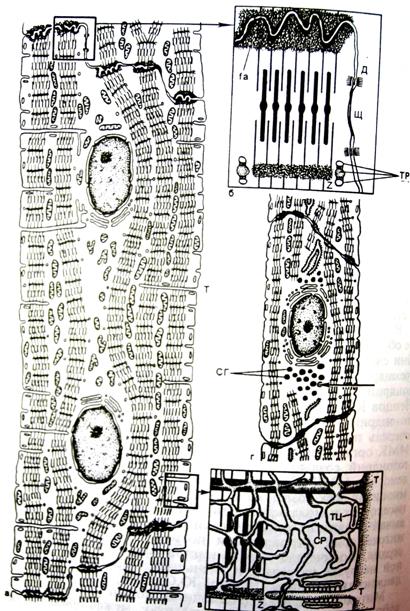
Рис. 4. Строение кардиомиоцита сердца.
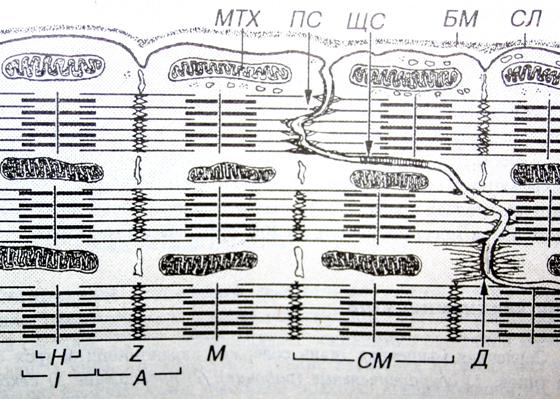
Т-каналы желудочковых миоцитов имеют характер глубоких поперечных складок на уровне линий Z, их продольных ветвей и анастомозов вблизи дисков А. Объем Т-системы в желудочковых миоцитах составляет 27-36% от объема цитоплазмы. По каналам данной системы у кардиомиоцитов не только распространяется импульс, но и поступают метаболиты в клетку.
Специализированными структурами кардиомиоцитов являются «вставочные диски», которые представляют собой комплекс, состоящий из промежуточных соединений (fascia adherens), нексусов (щелевые контакты) и десмосом (рис. 5, 6). Вставочные диски всегда находятся на уровне линий Z и содержат плотный материал, в котором много липидов и ряд белков, в том числе α-актинин, виментин, винкулин, десмин, спектрин, коннектин и др.
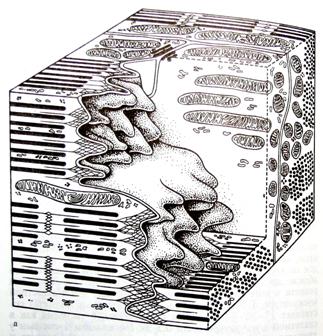
Рис. 5. «Вставочные диски» кардиомиоцитов
Объемная модель фрагментов двух кардиомиоцитов на уровне вставочного диска. Видны пальцевидные выросты клеток, которые на срезе имитируют рисунок «вставочного диска»
Рис. 6. Ультраструктурная организация области «вставочного диска» кардиомиоцитов
Клеточные соединения в виде десмосом имеют характерное строение, а нексусы в основном располагаются вдоль продольной оси клетки. В этих образованиях сближаются мембраны контактирующих клеток, образуя многочисленные коннексоны, при этом через гидрофильный канал распространяется нервный импульс и происходит обмен метаболитами между соседними миоцитами. Промежуточные соединения, или полоски слипания, представляют собой уплотненные участки плазмоллем контактирующих клеток и связывают конечные саркомеры соседних миоцитов. Вставочные диски соединяют друг с другом продольно лежащие миоциты с образованием тяжей или функциональных волокон. Часто плотные вставочные диски имеют ступенчатый вид.
Рабочие миоциты предсердий в отличие от желудочковых содержат секреторные гранулы и имеют способность к митозу. Данные миоциты мельче желудочковых и часто с отростками. Миофибриллярных элементов в них меньше на 40%, и реже наблюдаются лестничные структуры во вставочных дисках. Гранулярный эндоплазматический ретикулум и аппарат (комплекс) Гольджи развиты в этих клетках сильнее, чем в желудочковых миоцитах. Характерно, что Т-система в рабочих миоцитах предсердий почти не развита и если присутствуют, то каналы располагаются вдоль, а не перпендикулярно продольной оси клетки.
2.2.2 Сердечные миоциты проводящей системы сердца
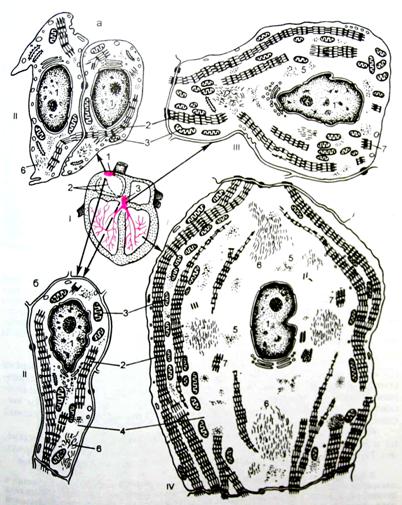
Миоциты проводящей системы сердца (рис. 7). К проводящей системе сердца (systema conducens cardiacum) относятся мышечные клетки, формирующие и проводящие импульсы к сократительным клеткам сердца. В состав проводящей системы входят синусно-предсердный и предсердно-желудочковый узлы, предсердно-желудочковый пучок (пучок Гиса), его ножки и концевые разветвления ножек, образованные клетками Пуркинье. В сердце человека клетки проводящей системы сильно отличаются по размерам и структуре от рабочих миоцитов. Различают три типа мышечных клеток, которые в разных соотношениях находятся в соответствующих отделах данной системы.
Рис. 7. Кардиомиоциты проводящей системы сердца
Другим типом клеток синусного узла, находящегося по его периферии, является переходный, или латентный тип. В таких клетках больше миофибрилл и нексусов, а в некоторых из них есть Т-каналы. Данные клетки проводят импульс из синусного узла к другим клеткам предсердия, а именно от Р-клеток к клеткам предсердно-желудочкового пучка и рабочему миокарду.
Предсердно-желудочковый узел имеет клетки, схожие с миоцитами синусного узла. Оба узла сильно иннервированы с преобладание адренергических терминалей. Каждый миоцит имеет и афферентную, и эфферентную иннервации.
Предсердно-желудочковый пучок (пучок Гиса) представляет прямое продолжение предсердно-желудочкового узла и покрыт «чехлом» из плотной соединительной ткани. Ножки пучка разветвляются под эндокардом, а также по толщине миокарда желудочков и проникают в сосочковые мышцы.
В проводящей системе сердца преобладают энзимы, принимающие участие в анаэробном гликолизе (фосфорилаза, дегидрогеназа молочной кислоты). В проводящих волокнах уровень калия ниже, а кальция и натрия выше в сравнении с сократительными кардиомиоцитами.
2.3 Строение наружной оболочки сердца эпикарда и перикарда
Наружная оболочка сердца, или эпикард (epicardium), представляет висцеральный листок перикарда (pericardium). Эпикард образован тонкой пластинкой соединительной ткани, плотно срастающейся с миокардом. Свободная поверхность ее покрыта мезотелием. В основе эпикарда различают поверхностный слой коллагеновых волокон, слой эластических волокон, глубокий слой коллагеновых волокон и глубокий коллагеново-эластический слой, составляющей до 50% всей толщины эпикарда.
В перикарде соединительнотканная основа развита сильнее, чем в эпикарде. Здесь много эластических волокон, особенно в глубоком его слое. Поверхность перикарда, обращенная к перикардиальной полости, также покрыта мезотелием. Эпикард и париетальный листок перикарда имеют многочисленные нервные окончания в основном свободного типа.
3. Васкуляризация сердца
Венечные (коронарные) артерии имеют плотный эластический каркас, в котором выделяются внутренняя и наружная эластические мембраны. Гладкие мышечные клетки в артериях обнаруживаются в виде продольных пучков во внутренней и наружной оболочках.
В основании клапанов сердца кровеносные сосуды в месте прикрепления створок разветвляются на капилляры, откуда кровь собирается в коронарные вены, впадающие в правое предсердие или венозный синус. В эпикарде и перикарде также находятся сплетения сосудов микроциркуляторного русла. Проводящая система сердца, особенно ее узлы, обильно снабжена кровеносными сосудами.
Кровоснабжение сердечной мышечной ткани чрезвычайно обильно: по уровню кровоснабжения (мл/мин/100г массы) миокард уступает только почке и превышает другие органы, включая головной мозг. В частности, этот показатель для сердечной мышцы в 20 раз выше, чем для скелетной.
Лимфатические сосуды в эпикарде сопровождают кровеносные. В миокарде и эндокарде они проходят самостоятельно и образуют густые сети. Лимфатические капилляры обнаружены также в атриовентрикулярных и аортальных клапанах. Из капилляров лимфа, оттекающая от сердца, направляется в парааортальные и парабронхиальные лимфатические узлы.
4 Иннервация сердца
В стенке сердца обнаруживается несколько нервных сплетений и ганглиев. Наибольшая плотность расположения нервных сплетений наблюдается в стенке правого предсердия и синусно-предсердного узла проводящей системы.
Рецепторные окончания в стенке сердца образованы нейронами ганглиев блуждающих нервов и нейронами спинномозговых узлов, а также ветвлениями дендритов равноотростчатых нейроцитов внутриорганных ганглиев (афферентные нейроны).
Пресинаптический аппарат в кардиомиоцитах синапсов характеризуется тем, что практически не удается выделить в миокардиоцитах локальные постсинаптические структуры, так как эффекторные влияния имеют модулирующий характер.
Электротоническое влияния в миокардиальной ткани распространяются далеко за пределы одной клетки, и как следствие, обнаружение высокого коэффициента передачи между кардиомиоцитами, что обусловлено наличием электрических синапсов (щелевых контактов) между клетками. При этом автоматизм сокращения связан с передачей импульса через указанные контакты.
В миокарде много афферентных и эфферентных нервных волокон. Раздражение нервных волокон, окружающих проводящую систему, а также нервов, подходящих к сердцу, вызывает изменение ритма сердечных сокращений. Это указывает на определяющую роль нервной системы в ритме сердечной деятельности, следовательно, и в передаче импульсов по проводящей системе сердца.
5. Функциональная адаптация сердца
Функциональная адаптация клеток в гистогенезе сердечной мышечной ткани проявляется в гетерохромном развитии мышечных элементов миокарда различных отделов сердца. По морфологическим, гистохимическим, гистоавторадиографическим и биометрическим признакам, а также скорости дифференцировки мышечных клеток миокард желудочков, предсердий и мышечные трабекулы отличаются друг от друга, что находится в связи с особенностями гемодинамики, трофики и функции этих отделов миокарда.
Генетически детерминированные основные параметры процессов дифференциации, пролиферации и интеграции клеток миокарда характеризуются известным диапазоном изменчивости, вследствие чего осуществляется адаптация миокарда к конкретным условиям функционировании на каждом этапе фило- и онтогенеза как в норме, так и под влиянием различных внутренних и внешних условий.
6. Возрастные изменения сердечной деятельности
В течение онтогенеза можно выделить три периода изменения гистоструктуры сердца:
В период 20-30 лет при обычной функциональной нагрузке сердце человека находится в стадии относительной стабилизации. В возрасте старше 30-40 лет в миокарде обычно начинается некоторое увеличение его соединительнотканной стромы. При этом в стенке сердца, особенно в эпикарде, появляются адипоциты.
Степень иннервации сердца также изменяется с возрастом. Максимальная плотность внутрисердечных сплетений на единицу площади и высокая активность медиаторов отмечаются в период полового становления человека. После 30-летнего возраста уменьшаются плотность холинергических сплетений и количество медиаторов в них сохраняется на постоянном уровне. Нарушение равновесия в вегетативной иннервации сердца предрасполагает к развитию сложных патологических состояний. В пожилом возрасте уменьшается активность медиаторов в холинергических сплетениях сердца.
При повышенных систематических функциональных нагрузках общее количество клеток не возрастает, но в цитоплазме увеличиваются содержание органелл общего значения и миофибрилл, а также размер клеток (функциональная гипертрофия); соответственно возрастает и степень плоидности ядер кардиомиоцитов.
7. Регенерация сердечной мышечной ткани
Для сердца как органа характерна способность к регенерации путем регенераторной гипертрофии, при которой масса органа восстанавливается, но форма остается нарушенной. Подобное явление наблюдается после перенесенного инфаркта миокарда, когда масса сердца может восстановиться как целое, при этом на месте повреждения образуется соединительнотканный рубец, но орган гипертрофируется, т.е. нарушается форма. Происходит не только увеличение размеров кардиомиоцитов, но и пролиферация в основном в предсердиях и ушках сердца.
Ранее полагали, что дифференцировка кардиомиоцитов является необратимым процессом, связанным с полной потерей этими клетками способности к делению. Но на современном уровне многочисленные данные показывают то, что дифференцированные кардиомиоциты способны к синтезу ДНК и митозу. В исследовательских работах П.П. Румянцева и его учеников показано, что после экспериментального инфаркта миокарда левого желудочка сердца в клеточный цикл возвращается 60-70% предсердных кардиомиоцитов, возрастает число полиплоидных клеток, но это не компенсирует повреждение миокарда.
Установлено, что кардиомиоциты способны к митотическому делению (в том числе и клетки проводящей системы). В миокарде сердца особенно много одноядерных полиплоидных клеток с 16-32-кратным содержанием ДНК, но встречаются и двуядерные кардиомиоциты (13-14%) в основном октоплоидные.
В процессе регенерации сердечной мышечной ткани кардиомиоциты участвуют в процессе гиперплазии и гипертрофии, возрастает их плоидность, но уровень пролиферации клеток соединительной ткани в области повреждения оказывается в 20-40 раз выше. В фибробластах активизируется синтез коллагена, в результате чего репарация происходит путем рубцевания дефекта. Биологическое представление подобной адаптационной реакции соединительной ткани объясняется жизненной важностью сердечного органа, так как задержка с закрытием дефекта может привести к гибели.
Считалось, что у новорожденных, а возможно, и в раннем детском возрасте, когда способные к делению кардиомиоциты еще сохраняются, регенераторные процессы сопровождаются увеличением количества кардиомиоцитов. При этом у взрослых физиологическая регенерация осуществляется в миокарде в основном путем внутриклеточной регенерации, без увеличения количества клеток, т.е. в миокарде взрослого человека отсутствует пролиферация кардиомиоцитов. Но недавно получены данные о том, что в здоровом сердце человека 14 миоцитов из миллиона находится в состоянии митоза, завершающегося цитотомией, т.е. количество клеток не значительно, но увеличивается.
Применение современных методов клеточной биологии в клинических и экспериментальных исследованиях позволило перейти к выяснению клеточных и молекулярных механизмов повреждения и регенерации миокарда. Особенно интересны данные о том, что в перинекротических областях и в функционально перегруженном сердце происходит синтез эмбриональных миоакрдиальных белков и пептидов, а также белков, синтезирующихся во время клеточного цикла. Это подтверждает положение о сходстве механизмов регенерации и нормального онтогенеза.
Выяснилось также и то, что дифференцированные кардиомиоциты в культуре способны к активному митотическому делению, что, возможно, объясняется не полной утратой, а подавлением способности кардиомиоцитов возвращаться в клеточный цикл.
Важной задачей теоретической и практической кардиологии является разработка способов стимуляции восстановления поврежденного миокарда, т.е. индукции миокардиальной регенерации и уменьшения соединительнотканного рубца. Одно из направлений исследований предоставляет возможность переноса регуляторных генов, которые превращают фибробласты рубца в миобласты или трансфекция в кардиомиоциты генов, контролирующих рост новых клеток. Другим направлением является перенос в область повреждения фетальных скелетных и миокардиальных клеток, которые могли бы участвовать в восстановлении сердечной мышцы. Также проводятся эксперименты по трансплантации скелетной мышцы в сердце, показывающие образование в миокарде участков сокращающейся ткани и улучшающие функциональные показатели миокарда. Перспективным может быть лечение с применением факторов роста, оказывающих как прямое, так и косвенное воздействие на поврежденный миокард, например, улучшение ангиогенеза.
8. Патологическая гистология сердечной мышечной ткани
Различные повреждающие воздействия на сердце (прекращение притока артериальной крови, травмы, воспаления и др.) могут вызвать некроз мышечной ткани, т.е. гибель мышечных клеток. Некроз, возникающий при нарушении или прекращении кровотока в артериях вследствие тромбоза, эмболии, длительного спазма или в условиях недостаточного коллатерального кровообращения, более характерен для миокарда. Артериальная сеть поперечнополосатых мышц в большом количестве имеет анастомозирующие сосуды, поэтому в случае полного закрытия артерии ишемии не наблюдается. Дистрофические и некротические изменения в мышцах развиваются только при длительном закрытии крупных артерий.
Для миокарда характерны следующие клинико-морфологические формы некроза: коагуляционный некроз, коагуляционный миоцитолиз, колликвационный некроз. В развитии разных типов некроза участвуют различные биохимические механизмы.
Колликвационный некроз развивается в результате пропитывания миокарда экссудатом из кровеносных сосудов. При этом в клетках возникает внутриклеточный отек и вакуолизация, что обычно может наблюдаться в периваскулярной и субэндотелиальной областях после инфаркта.
Вследствие воспалительной реакции происходит рассасывание омертвевшей мышечной ткани и последующим замещением рубцом. Вокруг пораженного участка наблюдается жировая дистрофия и липоматоз, а также отложение извести.
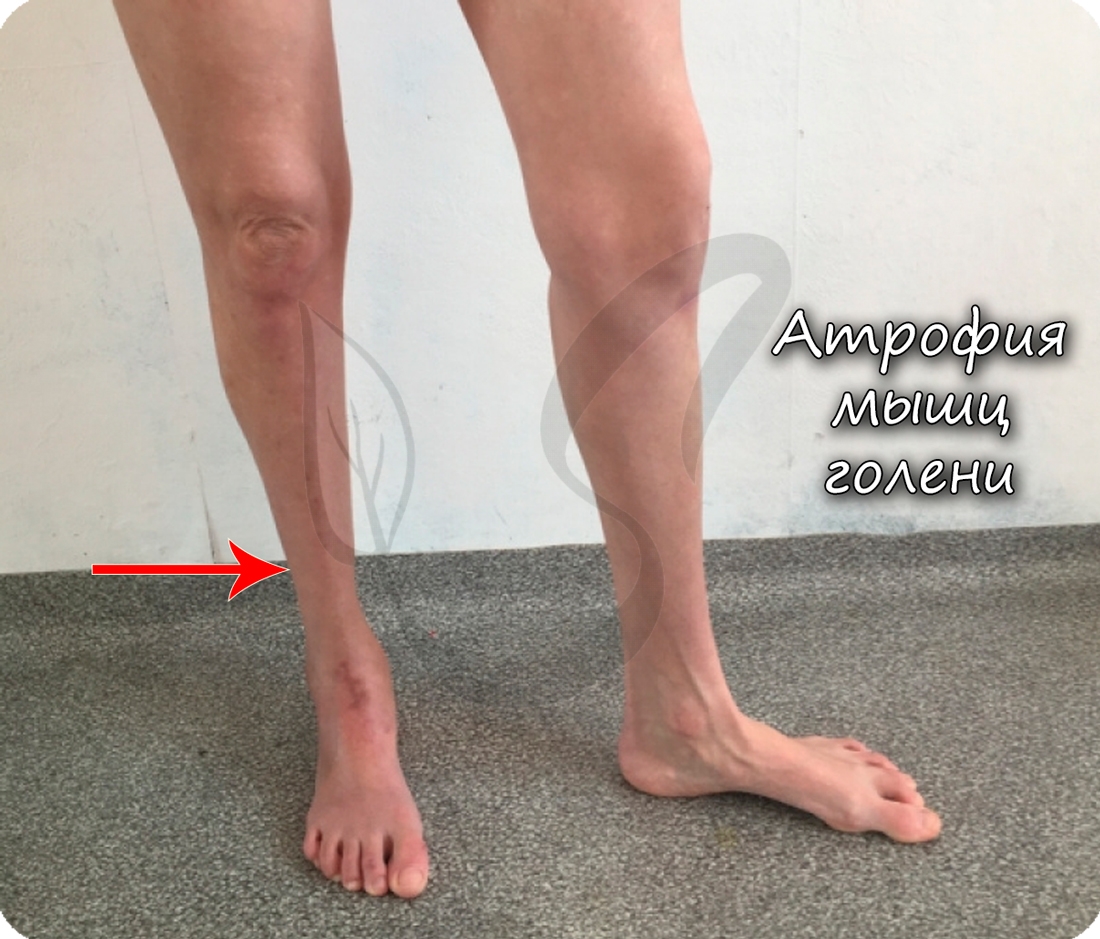
При атрофии миокарда тяжи кардиомиоцитов постепенно становятся тоньше. В случае сильной атрофии исчезает поперечная исчерченость, продольная же сохраняется дольше. В местах атрофии может развиться воспалительный процесс, образование межуточной соединительной ткани.
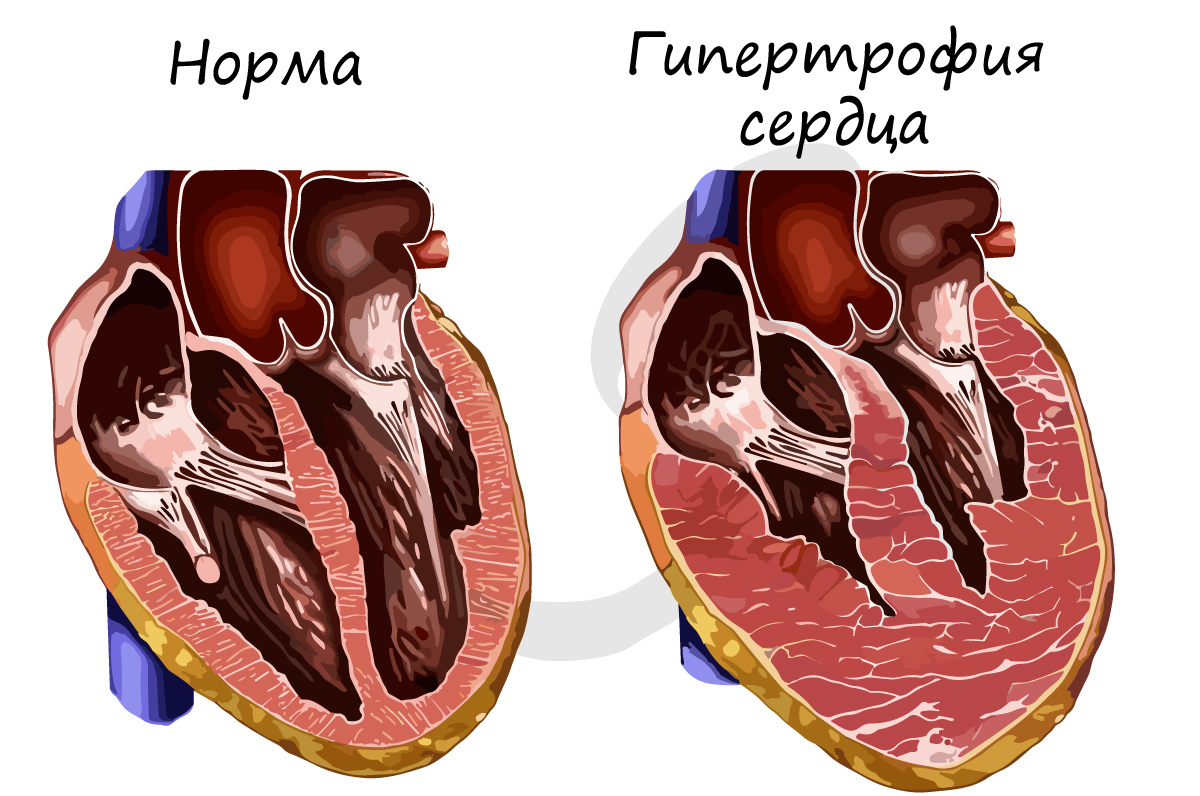
Наиболее типичной приспособительной реакцией миокарда на повышение физической нагрузки является гипертрофия. Гипертрофия сердечной мышцы часто относится к рабочим гипертрофиям, при этом наблюдается утолщение мышечных волокон и кардиомиоцитов, обусловленное увеличением количества саркоплазмы и миофибрилл. Установлено, что в миокарде гипертрофия является реакцией на пролиферативные стимулы и гемодинамическую нагрузку кардиомиоцитов, вышедшие из митотического цикла (исследования гипертрофии миокарда при различных воздействиях: бег, плавание, индивидуальные дозированные физические нагрузки, экспериментальная коарктация аорты и др.)
Процесс гипертрофии включает три основных стадии:
2. Стадия завершающейся гипертрофии и относительной устойчивости гиперфункции;
3. Стадия прогрессирующего кардиосклероза и постепенного истощения при явлениях нарушения синтеза нуклеиновых кислот и белков.
Заключение
Анализ структурно-функциональных особенностей сердечной мышечной ткани показал, что, несмотря на то, что миокардиальная ткань состоит из отдельных клеток, в функциональном отношении она представляет собой единую систему. Способность сердечной мышечной ткани к регенерации, а также адаптация миокарда к конкретным условиям функционирования позволяют по-новому посмотреть на вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых связано с повреждением структуры сердечной мышечной ткани и, как следствие, дисфункцией сердечной деятельности.
На современном уровне полагают, что в проблеме микроциркуляции заложен целый ряд расстройств сердечно-сосудистой деятельности при различных заболеваниях организма. Данная область получила ускоренное развитие особенно во 2-й половине ХХ века и уже сегодня формирует новые принципы в лечении патологий сердца. Импульсом к этому послужило техническое совершенствование исследований трансорганной микрогемодинамики и разработка методологических подходов к анализу гемато-тканевых взаимодействий в системе микроциркуляции.
Проведение научных исследований в различных направлениях, в том числе и микроциркуляционного русла сердца, совершенствование существующих и развитие новых способов оперативного лечения врожденных и приобретенных пороков сердца, применение современного диагностирующего оборудования и эффективных лекарственных препаратов, а также просвещение общества в направлении здорового образа жизни представляют возможность достижения целей, направленных на обеспечение лечения заболеваний сердечно-сосудистой системы и сохранение здоровья человека.
3. Куприянов В.В., Караганов Я.Л., Козлов В.И. Микроциркуляторное русло. М.: Медицина, 1975.