Как йодомарин влияет на ттг
Беззащитная щитовидная железа: профилактика и лечение заболеваний
Проблемы с щитовидной железой начинаются с необычных симптомов, которые не всегда связаны с дефицитом йода. Если вам всегда холодно и сонливо, волосы стали выпадать, а характер изменился не в самую лучшую сторону — возможно, стоит проверить щитовидную железу. Как понять, что с ней не все в порядке? Что делать для профилактики тиреотоксикоза (гипертериоза) и гипотериоза? Опасны ли узлы и токсические зобы? Мы решили узнать ответы на эти вопросы у нашего ведущего эндокринолога Либеранской Натальи Сергеевны!
1. Профилактика заболеваний щитовидной железы йодом
Дефицит йода действительно характерен для жителей России, особенно это касается маленьких детей, подростков и беременных женщин. Щитовидная железа страдает в первую очередь, а когда это происходит, артериальное давление падает, кожа сохнет, волосы выпадают, человек испытывает сильную слабость и апатию, сонливость и озноб.
Картина следующая — дефицит йода приводит к тому, что тиреоидная пероксидаза выходит из тиреоцита. Организм начинает активно продуцировать антитела, которые атакуют щитовидную железу, и она начинает работать как попало — нарушается синтез важных гормонов: тироксина (Т4) и трийодтиронина (Т3).
Распространенность йододефицитных заболеваний щитовидной железы крайне велика. По примерным подсчетам ВОЗ, свыше 650 миллионов людей на планете живут с увеличенной щитовидной железой, а 43 млн страдают когнитивными расстройствами из-за нехватки йода. В профилактических целях имеет смысл покупать в магазинах только йодированную соль и включить морепродукты в дневной рацион. Чего делать точно не стоит, так это пить йод. Его избыток не лучше дефицита.
Проверить, нет ли у вас дефицита йода, можно в домашних условиях — нанесите йод на кожу. Если полоска исчезла ранее чем через 24 часа, то у вас скорее всего не хватает этого микроэлемента.
В клиническом анализе мочи содержание йода должно быть не менее 150 мкг/л. Дозировки определяются индивидуально от 150-1000 мкг считаются безопасными, иногда требуется прием более высоких доз. Йод лучше всего усваивается вместе с селеном. И это далеко не все микроэлементы, которые нужны щитовидке.
2. Микроэлементы для щитовидной железы
Селен
Помогает йоду усваиваться правильно, является отличным антиоксидантом. Рекомендованная суточная норма для взрослого человека — 200-400 мкг селен метионина или хелата. Доказано, что селен снижает уровень антител при аутоиммунном тиреоидите.
Железо
Является основополагающим компонентом. Его дефицит приводит к нарушению работы щитовидной железы и наоборот, нарушение функции ЩЖ, а именно, гипотиреоз, приводит к развитию дефицита железа. В группе риска — все менструирущие и беременные женщины, вегетарианцы, пациенты с пониженной секрецией соляной кислоты в желудке. Дефицит железа снижает уровень Т3 на 43% и Т4 на 67% и приводит к самому распространенному заболеванию — гипотериозу. Целевые показатели — 80-100 мкг/л.
Витамин D
D-гормон необходим для иммунной системы и правильной работы вообще всех эндокринных желез. Низкий уровень витамина D в разы повышает риск аутоиммунного тиреоидита. Целевые показатели витамина D — 65-100 нг/мл, но если у вас уже диагностировали АТ, то не менее 100.
Какие еще микроэлементы и витамины важны для щитовидной железы?
Магний, цинк, витамины А, В1, 12, тирозин — их дефицит необходимо восполнить.
3. Препараты, которые нарушают работу щитовидной железы
Отказаться от этих медикаментов не всегда представляется возможным, но если вы их принимаете, то нужно иметь в виду, что они влияют и на щитовидную железу:
Некоторые антиаритмические препараты могут содержать слишком высокие дозы йода, что повышает вероятность гипер- или гипотериоза.
Препараты, содержащие литий — чаще всего используются для лечения депрессии и биполярных расстройств. Накапливаются в щитовидной железе и блокируют синтез тиреоидных гормонов.
Фторсодержащие препараты — снижают функцию щитовидной железы. К ним относятся некоторые антидепрессанты, антибиотики, статины, противогрибковые и медикаменты для лечения артрита. Избыточное количество фтора мы можем получать и с зубной пастой.
Препараты для снижения кислотности желудка.
Бета-блокаторы — замедляют конверсию Т4 в Т3
Ботокс — в меньшей степени, однако не рекомендован при аутоиммунном тиреоидите.
4. Как понять, что с щитовидной железой не все в порядке?
Симптомы заболеваний щитовидной железы, которые должны насторожить:
5. Как проверяем щитовидную железу?
Шаг 1 — делаем температурный тест
Шаг 2 — сдаем анализы на гормоны щитовидной железы, делаем УЗИ
Ориентируемся на следующие показатели лабораторных анализов:
6. Что делать, если на УЗИ обнаружены узлы щитовидной железы?
1. Не паниковать. Хорошо, что вы вообще о них узнали. Большинство узлов не опасны. По статистике, у каждой 2 женщины они есть.
2. Если размер узла превышает 1 см, то нужно сделать пункционную биопсию. Только после лабораторного исследования образца ткани врач сможет определить, состоит ли узел из доброкачественных клеток, или существует онкологический риск. Доброкачественный узел не перерождается в рак.
3. Сдать анализ на гормоны щитовидной железы, чтобы понять, не нарушена ли ее функция. При гиперфункции (гипертериозе) и наличии узлов нужно точно определить источник избытка гормонов, потребуется сцинтиграфия с технецием.
Хорошо, а что дальше делать с узлами?
Доброкачественные — наблюдаем у врача
7. Гипертериоз (тиреотоксикоз, гиперфункция щитовидной железы)
При тиреотоксикозе беспокоят:
Кроме того, гипертериоз — это наследственное заболевание, которому часто сопутствуют и другие аутоиммунные патологии.
8. Токсический зоб — это опасно?
Нет, но это очень и очень неприятное аутоиммунное заболевание. Переизбыток тиреоидных гормонов отравляет организм, а проблема заключается даже не в щитовидной железе, а в иммунной системе.
Контролировать его и бороться с симптомами очень не просто. Сердцебиение, потеря веса, тремор, выраженная слабость, утомляемость, раздражительность, дискомфорт, жжение, давление в глазах — диагноз можно поставить с порога.
При этом на УЗИ часто выявляют гиперплазию щитовидной железы, диффузные изменение, усиление кровотока. В некоторых случаях опухоль может быть настолько большой, что увидеть ее легко и без УЗИ — она приводит к деформации шеи, мешает глотать и дышать.
Пациенту назначается консервативная медикаментозная терапия (1-1,5 года). Помогает она не всегда — после отмены препаратов только в 30% случаев наступает ремиссия.
Если терапия не помогла, щитовидную железу полностью удаляют. Другой вариант — лечение радиоактивным йодом.
9. Операция на щитовидной железе — это опасно?
При наличии пограничных опухолей, опасных онкогенных узлов и токсических зобов, которые не поддаются консервативному лечению, операция по удалению щитовидной железы или ее части может быть единственным способом восстановить здоровье и даже сохранить жизнь.
Операции на щитовидной железе у многих до сих пор ассоциируются с рубцом на шее, который приходится скрывать, чтобы никого не пугать и не провоцировать лишние вопросы. Сегодня такие операции выполняются с применением эндовидеохирургической техники:
Гормонозаместительная терапия, и тем более пожизненная, назначается не всегда!
10. Гипотиреоз
Когда в организме слишком мало Т4, развивается гипотиреоз — противоположность гипертериоза. Обмен веществ замедляется, лишняя жидкость и продукты распада хуже выводятся, человек набирает вес. Причин для его возникновения много, в том числе и недостаток йода. Еще одна важная и коварная — аутоиммунный тиреоидит: в этом случае иммунитет принимает щитовидную железу за опасное инородное тело и начинает разрушать её. Клеток становится мало, и уровень тироксина снижается.
Причины гипертериоза (стараемся их избегать):
Йоддефицитная патология щитовидной железы: профилактика и лечение
С проблемой диффузного и узлового зоба сталкиваются врачи многих специальностей: эндокринологи, хирурги, онкологи, радиологи, терапевты, кардиологи, педиатры. Диагностика и лечение этих заболеваний касаются врачей-эндокринологов, однако с последствиями ф
С проблемой диффузного и узлового зоба сталкиваются врачи многих специальностей: эндокринологи, хирурги, онкологи, радиологи, терапевты, кардиологи, педиатры. Диагностика и лечение этих заболеваний касаются врачей-эндокринологов, однако с последствиями функциональных нарушений щитовидной железы приходится сталкиваться терапевтам, кардиологам, невропатологам, гастроэнтерологам, а иногда и психиатрам.
В основе развития диффузных и узловых форм зоба лежат разные причины: йодная недостаточность, генетически обусловленные дефекты синтеза тиреоидных гормонов, зобогенные факторы, связанные с пищей, начальные проявления аутоиммунной патологии. Установлено, что в Российской Федерации основной причиной развития диффузных и узловых форм зоба является дефицит йода. Исследования, проведенные в последнее десятилетие, показали, что в России не существует территорий, население которых не подвергалось бы риску развития йоддефицитных заболеваний [2]. С йодным дефицитом связано 90–95% случаев увеличения щитовидной железы.
В странах, где существует дефицит йода, в структуре заболеваний щитовидной железы преобладают диффузные и узловые формы зоба, выше относительная частота низкодифференцированных форм рака.
Исследования, посвященные оптимальным показателям содержания йода в пище, при которых не происходит развития зоба, позволили установить нормативы его потребления в сутки (ВОЗ, 2001) [5]:
В организм йод попадает в виде неорганических соединений или в органической форме.
В организме здорового человека содержится около 15 — 20 мг йода, из которых 70 — 80% находится в щитовидной железе. Ежедневно щитовидная железа при достаточном поступлении йода секретирует 90–110 мкг тироксина и 5–10 мкг трийодтиронина. Главным стимулятором синтеза и секреции тиреоидных гормонов является тиреотропный гормон гипофиза (ТТГ). Тиреоидные гормоны регулируют процессы энергообразования в организме, синтеза нуклеиновых кислот и белка, а также функционирование органов и тканей. Под воздействием тиреодных гормонов происходит формирование ЦНС у плода, становление интеллекта и поддержание умственной и физической работоспособности в течение жизни.
Если поступление йода в организм ограничено, нормальная секреция тиреоидных гормонов может быть достигнута только в результате перестройки функции щитовидной железы. На первом этапе увеличивается поглощение йода щитовидной железой. Далее происходит изменение внутритиреоидного метаболизма йода — организм более экономно расходует йод, образовавшийся в процессе разрушения тиреоидных гормонов, используя его повторно. Свободные атомы йода направляются для синтеза трийодтиронина, биологическая активность которого в три – пять раз выше, чем тироксина. Чтобы захватить больше йода, щитовидная железа увеличивается в размерах — за счет гиперплазии (количества) и гипертрофии (объема) тиреоидных клеток, таким образом формируется эндемический зоб. Эндемический зоб является предрасполагающим фактором для развития многих заболеваний щитовидной железы, в том числе узловых образований и менее дифференцированных форм рака. Если дефицит йода не восполнять, то со временем функциональная активность щитовидной железы снижается, уровень тиреоидных гормонов в крови падает, скорость обмена веществ замедляется, т. е. развивается гипотиреоз.
По современным представлениям, ТТГ является не единственным стимулятором пролиферации тиреоцитов, его пролиферативные и трофические эффекты опосредуются другими внутриклеточными факторами. Исследования последних лет показали, что йод, попадая в тиреоцит, помимо йодтиронинов образует соединения с липидами (йодолактоны). Йодированные липиды служат ингибиторами продукции ИРФ-1 и других ростовых факторов. При отсутствии этой блокады факторы роста запускают пролиферативные процессы, результатом которых является гиперплазия тиреоцитов.
В зобно-измененной щитовидной железе наиболее активно пролиферирующие группы клеток или фолликулов образуют отличные от окружающей ткани участки или «узлы». Узел редко бывает один. Как правило, их много, и они обнаруживаются в разных сегментах щитовидной железы. В ряде случаев в результате соматических мутаций часть узлов приобретает способность функционировать автономно, т. е. независимо от ТТГ. Диффузные формы зоба чаще встречаются у детей и подростков и лиц детородного возраста. Узловые — в старшей возрастной группе.
Самым простым методом диагностики зоба является пальпация щитовидной железы. Если врач на основании пальпации делает вывод о наличии у пациента увеличения щитовидной железы или пальпирует в ней узловые образования, пациенту показано УЗИ щитовидной железы.
С клинических позиций зобом называется диффузное увеличение щитовидной железы, определяемое либо пальпаторно, либо с помощью методов визуализации. Зобом обозначается увеличение объема щитовидной железы более 18 мл у женщин и более 25 мл у мужчин. Равномерное увеличение щитовидной железы называется диффузным зобом, наличие образования в ней — узловым. У женщин, особенно в йоддефицитных районах, зоб развивается в два-три раза чаще, чем у мужчин, как правило, в периоды, когда повышена потребность в гормонах щитовидной железы, — пубертата и беременности.
«Узловой зоб» — это собирательное понятие, объединяющее очаговые поражения щитовидной железы c различными патоморфологическими изменениями. Это могут быть кисты, коллоидные узлы, доброкачественные или злокачественные опухоли, в подавляющем большинстве случаев имеющие эпителиальное происхождение и представляющие собой аденомы и раки. В этой связи обязательным методом исследования при узловом зобе является пункционная биопсия с последующим цитологическим уточнением диагноза. На долю узлового коллоидного в разной степени пролиферирующего зоба приходится 75–90% от всех узловых образований в щитовидной железе. Основная причина развития коллоидного пролиферирующего зоба в РФ — это дефицит йода.
Как правило, зоб (диффузный, узловой) небольших размеров больного не беспокоит. Жалобы появляются при симптомах сдавления органов шеи или при изменении функционального состояния щитовидной железы. Большинство больных с узлами щитовидной железы находятся в эутиреоидном состоянии, но в результате естественного течения заболевания, или после поступления в организм дополнительных количеств йода с йодными добавками, или в составе йодсодержащих фармакологических средств продукция тиреоидных гормонов автономными образованиями может увеличиться, что приводит к развитию тиреотоксикоза. Развитию явного тиреотоксикоза при узловом и многоузловом зобе может предшествовать длительный период субклинического тиреотоксикоза, который определяется как сниженный уровень ТТГ при нормальных показателях свободных фракций тироксина и трийодтиронина. Декомпенсированная функциональная автономия в клинической практике будет проявляться как узловой, многоузловой токсический зоб. При сцинтиграфии щитовидной железы у таких больных выявляются участки, активно поглощающие изотопы 131 I или Tc 99 m («горячие» узлы).
Развитие функциональной автономии преимущественно у лиц пожилого возраста определяет клинические особенности данного заболевания. Обычные симптомы тиреотоксикоза, такие, как зоб, пучеглазие, тахикардия, похудание, потливость, тремор рук и тела, повышенная возбудимость, могут быть выражены незначительно или вовсе отсутствовать. В клинической картине, как правило, доминируют сердечно-сосудистые и психические расстройства: апатия, депрессия, отсутствие аппетита, слабость, сердцебиения, нарушения сердечного ритма, симптомы недостаточности кровообращения. Часто пациенты страдают сопутствующими заболеваниями сердечно-сосудистой системы, патологией пищеварительного тракта, неврологическими заболеваниями, что маскирует основную причину заболевания. Преобладание тех или иных симптомов заставляет больных обращаться к терапевту, кардиологу, невропатологу, гастроэнтерологу, а иногда и к психиатру и очень редко по назначению — к эндокринологу.
Кардиологи после назначения антиаритмического йодсодержащего средства амиодарона или введения йодсодержащих контрастов при коронарографии могут столкнуться с развитием йодиндуцированного тиреотоксикоза на фоне введения фармакологических доз йода [3]. Для уточнения размеров щитовидной железы, наличия узлов, функциональной активности проводятся: УЗИ, цветное допплеровское картирование, сцинтиграфия щитовидной железы, рентгенологическое исследование, компьютерная (КТ) и магнитно-резонансная томография (МРТ). С помощью УЗИ определяются объем и эхоструктура, кровоснабжение щитовидной железы. Рентгенологическое исследование с контрастированием барием пищевода позволяет уточнить локализацию зоба, наличие симптомов сдавления органов шеи. По накоплению и распределению радиофармпрепарата можно судить о функциональной активности щитовидной железы, о характере ее поражения (диффузном или узловом), об объеме ткани после струмэктомии, о наличии эктопированной ткани. Показания для проведения КТ и МРТ ограничены вследствие высокой стоимости и сложности исследования. Результаты помогают диагностировать загрудинный зоб, уточнить расположение зоба по отношению к окружающей ткани, определить смещение или сдавление трахеи и пищевода.
На сегодняшний день к заболеваниям щитовидной железы, причиной которых является дефицит йода, относятся: диффузный нетоксический (эндемический) зоб, узловой (многоузловой) нетоксический зоб, функциональная автономия щитовидной железы, йодиндуцированный тиреотоксикоз.
Парадокс, но в районах с недостаточным потреблением йода частота автономных образований в щитовидной железе значительно выше, чем в тех, где проводится йодная профилактика.
Базовым методом йодной профилактики, доступным всему населению РФ, является йодирование пищевой поваренной соли. Однако в определенные периоды жизни (детство, подростковый период, беременность, кормление грудью) потребность в микроэлементах возрастает, и организм нуждается в регулярном дополнительном приеме физиологических доз йода. В таких случаях проводится индивидуальная или групповая йодная профилактика.
Групповая йодная профилактика — профилактика в масштабе определенных групп повышенного риска по развитию йоддефицитных заболеваний: дети, подростки, беременные и кормящие женщины, лица детородного возраста. Осуществляется путем регулярного длительного приема медикаментозных препаратов, содержащих физиологическую дозу йода, в частности йодомарина 100/200:
Индивидуальная йодная профилактика — профилактика у отдельных лиц путем длительного приема препаратов, содержащих физиологическую дозу йода.
Как мы определили, основной причиной развития зоба (диффузного, узлового/многоузлового коллоидного зоба) в наших регионах является дефицит йода. Следовательно, этиотропным вариантом лечения диффузных и узловых коллоидных форм зоба будет назначение препаратов йода [4]. Препарат йода йодомарин 100/200 назначается соответственно возрастной потребности:
Если через шесть месяцев отмечается значительное уменьшение или нормализация размеров щитовидной железы (пальпация, УЗИ), рекомендуется продолжить прием йодомарина в тех же дозах с целью предупреждения рецидива зоба.
В том случае, если на фоне приема препаратов йода в течение шести месяцев размеры щитовидной железы остаются прежними или увеличиваются, показана патогенетическая терапия супрессивными дозами L-тироксина в его комбинации с йодомарином. Уровень ТТГ должен снизиться ниже 1 МЕ/л (0,3–0,5 МЕ/л). Реальная доза L-тироксина составляет не менее 75–100 мкг в день. Если у больного зоб изначально больших размеров — II степень увеличения по классификации ВОЗ, — лечение начинают с назначения комбинированной терапии L-тироксином и йодомарином в вышеуказанных дозах. Длительность лечения должна составлять не менее 12 месяцев, при нормализации размеров щитовидной железы рекомендуется продолжить прием йодомарина с целью предотвращения рецидива зоба.
У лиц старшей возрастной группы, особенно при наличии сопутствующей кардиальной патологии, лечение L-тироксином следует проводить осторожно. Лечение следует начинать с 12,5–25 мкг, увеличивая дозу по 12, 5–25 мкг каждые один-два месяца до снижения уровня ТТГ не ниже 0,8 мЕ/л. При появлении или ухудшении кардиальных симптомов необходимо уменьшить дозу L-тироксина и провести коррекцию кардиальной терапии. При диффузном поражении щитовидной железы без нарушения ее функции у лиц старшей возрастной группы назначение йодомарина противопоказаний не имеет. При узловом коллоидном зобе до назначения препаратов йода и тиреоидных гормонов необходимо исключить функциональную автономию щитовидной железы. Функциональная автономия может ничем себя клинически не проявлять. У данных больных уровни тиреоидных гормонов и ТТГ остаются в пределах нормы, но при сцинтиграфии щитовидной железы выявляются участки, активно поглощающие изотопы 131I или Tc99m («горячие» узлы). Такая автономия называется компенсированной. Если продукция тиреоидных гормонов автономными образованиями превышает физиологическую потребность, у больного разовьется тиреотоксикоз: субклинический (ТТГ снижен, уровни свободного тироксина и свободного трийодтиронина в пределах нормы) или манифестный (ТТГ снижен, уровни тиреоидных гормонов повышены). Наиболее информативным методом диагностики функциональной автономии является сцинтиграфия на фоне приема L-тироксина в дозе 200 мкг на протяжении 10 дней (супрессивная сцинтиграфия). Однако у лиц пожилого возраста, особенно при наличии ИБС, прием супрессивной дозы L-тироксина может иметь нежелательные последствия.
Надо отметить, что узлы небольших размеров, без функциональных нарушений, с небольшой скоростью роста не оказывают отрицательного влияния на организм и не являются показанием к оперативному лечению или назначению тиреоидных гормонов. Они требуют лишь приема препаратов йода (йодомарина) в физиологических количествах (100 — 150 мкг в день) и наблюдения.
После оперативного лечения по поводу узлового коллоидного зоба, если была проведена двусторонняя субтотальная резекция щитовидной железы, развивается гипотиреоз, и больные в дальнейшем нуждаются в заместительной терапии L-тироксином.
После удаления одной доли L-тироксин назначается больным, у которых уровень ТТГ превышает верхнюю границу нормы через месяц после операции. Препараты йода (йодомарин) назначаются всем больным в обязательном порядке для предупреждения рецидива зоба.
В заключение следует еще раз подчеркнуть, что основной причиной развития диффузных и узловых коллоидных форм зоба в регионах РФ является дефицит йода. Поэтому регулярное восполнение йодного дефицита предупреждает развитие диффузных и узловых форм зоба и функциональных нарушений щитовидной железы в дальнейшем.
По вопросам литературы обращайтесь в редакцию
Н. Ю. Свириденко, доктор медицинских наук
Эндокринологический научный центр РАМН, Москва
Коррекция йодной недостаточности: влияние физиологических доз йода на функциональное состояние щитовидной железы и активность аутоиммунных процессов
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Эндокринологический научный центр РАМН, Москва
Д ефицит йода и связанные с ним заболевания (ЙДЗ) в последние годы приобрели острую социальную значимость и стали одной из приоритетных проблем отечественного здравоохранения.
Во многих регионах Российской Федерации сегодня вводится программа йодной профилактики. В качестве ее основного метода используется йодированная пищевая поваренная соль – эффективный и экономичный способ восполнения дефицита йода на уровне всей популяции [3, 28].
В районах с легкой и умеренной йодной недостаточностью массовая йодная профилактика в большинстве случаев способна обеспечить достаточное поступление йода в организм. Но в определенные периоды жизни, когда потребность в йоде значительно возрастает (подростковый период, беременность, грудное вскармливание), вводимого с солью йода может не хватать, и тогда для восполнения дефицита йода требуется проведение групповой и индивидуальной йодной профилактики препаратами, содержащими физиологическую дозу йода [16, 17]. Регулярное поступление стандартной дозы йода в составе таблетированных препаратов позволяет поддерживать постоянную концентрацию микроэлемента в организме.
Использование физиологических доз йода для компенсации дефицита этого микроэлемента приводит в отдельных случаях к развитию йодиндуцированного тиротоксикоза (ЙИТ). ЙИТ чаще развивается у лиц с автономными образованиями в щитовидной железе [21]. В целом же физиологические дозы йода для организма безвредны (рекомендации Международного Комитета по контролю ЙДЗ, ЮНИСЕФ, ВОЗ ) [25, 40].
С момента проведения йодной профилактики среди ученых обсуждается вопрос о возможной роли йода в индукции и/или манифестации аутоиммунных процессов в щитовидной железе [10,31]. На сегодняшний день имеются лишь косвенные доказательства роли йода в развитии аутоиммунной патологии. Они получены в ходе экспериментов на животных и при проведении эпидемиологических исследований, в которых сравнивалась частота аутоиммунных заболеваний щитовидной железы в районах с нормальным и недостаточным потреблением йода.
Доказано, что введение фармакологических доз йода может приводить к появлению тиреоидных антител у генетически предрасположенных лиц [33]. Развитие неблагоприятных побочных эффектов после введения фармакологических доз йода закономерно поставило вопрос, может ли коррекция йодной недостаточности привести к развитию аутоиммунных заболеваний щитовидной железы? Теоретически такая возможность обсуждалась [11,12]. Однако исследования взаимосвязи между проведением йодной профилактики и последующим развитием аутоиммунных заболеваний не дали убедительных результатов [9].
С учетом вышеизложенного представлялось важным провести изучение возможных эффектов физиологических доз йода на активность аутоиммунных процессов и функцию щитовидной железы у лиц, проживающих в йоддефицитных районах.
Материалы и методы
Для проведения исследований были отобраны два учреждения Юго–западного округа г. Москвы: швейная фабрика (ШФ) и профессионально–техническое училище (ПТУ). Всего был обследован 1301 человек (645 учащихся ПТУ и 656 сотрудников ШФ). Данные пальпации оценивались по классификации ВОЗ (1994) [39].
Для более детального обследования были сформированы 2 группы женщин, имеющих пальпаторное увеличение щитовидной железы:
1–я группа – 70 человек, в возрасте от 20 до 55 лет (сотрудницы ШФ),
2–я группа – 50 человек, в возрасте от 16 до 20 лет (учащиеся ПТУ).
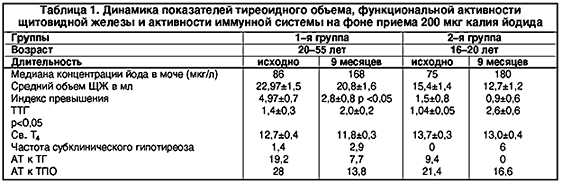
Программа исследования включала ультразвуковое исследование щитовидной железы, определение концентрации йода в моче, исследование содержания тиреотропного гормона гипофиза (ТТГ), свободного тироксина (св. Т4), антител к тиреоглобулину (АТ к ТГ), антител к пероксидазе (АТ к ТПО).
Тиреоидная сонография осуществлялась с использованием портативного сканера ALOKA 500 с датчиком 7,5 мгц. Измерения проводились в продольной и поперечной плоскости для правой и левой доли. Объем щитовидной железы рассчитывался по формуле Bruno:
[(шп x дп x тп)] + [(шл x дл x тл)] x 0,479 = объем,
где: шп, дп, тп, шл, дл, тл – соответственно ширина, длина и толщина правой и левой долей железы; 0,479 – коэффициент поправки на эллипсоидность. Полученные данные оценивались по нормативам F. Delang (1997) [18], рассчитанным относительно площади поверхности тела (ППТ).
Площадь поверхности тела (ППТ) рассчитывалась по формуле:
где В – вес в кг и Р – рост в см.
У женщин старше 18 лет объем щитовидной железы не должен превышать 18 мл.
За частоту зоба в популяции принимали все случаи превышения фактического объема щитовидной железы над верхней границей нормы (97 перцентиль). В процессе исследования для оценки величины зоба использовали показатель – индекс превышения (ИП) – среднее превышение объема щитовидных желез над верхним пределом нормы.
Концентрацию йода определяли в разовой порции мочи церий–арсенитовым методом в лаборатории клинической биохимии ЭНЦ РАМН (руководитель – д.м.н. Б.П. Мищенко).
Определение базального уровня ТТГ, св. Т4, в сыворотке крови проводилось в лаборатории гормонального анализа ЭНЦ РАМН (руководитель – проф. Н.П. Гончаров) с использованием автоматической иммунотест–системы Vitros. Границы нормы для базального уровня ТТГ – от 0,3 до 3,5 мЕ/л, св. Т4 – от 10 до 20 пмоль/л. АТ к ТГ и ТПО были определены иммуноферментным методом с использованием наборов фирмы «DRG» (США). Границы нормы для антител к ТГ и к ТПО Результаты исследования
До приема препарата в 1–й группе средний объем щитовидной железы по данным УЗИ составил 22.97±1,5 мл, при колебаниях от 18,8 до 28,2 мл. У 1,4% лиц выявлен субклинический гипотиреоз. 19,2% лиц имели повышенные титры АТ к ТГ и 28% – АТ к ТПО.
Во 2–й группе средний объем щитовидной железы составил 15.4±1,4 мл, при колебаниях от 5,0 до 28,5 мл. АТ к ТГ выявлены у 9,4% подростков, АТ к ТПО – у 21,4%. Функциональное состояние щитовидной железы по данным исследования тиреоидных гормонов и ТТГ расценено, как эутиреоидное. Данные исследования представлены в таблице 1.
Район считается свободным от йодного дефицита, если медиана концентрации йода в моче в популяции превышает 100 мкг/л.
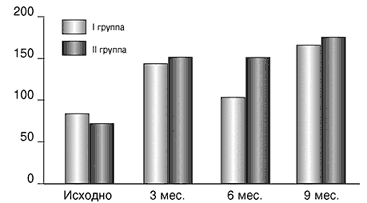
В 1–й группе медиана концентрации йода в моче до и на фоне приема 200 мкг калия йодида варьировала от 86 до 168 мкг/л. Во 2–й группе – от 75 до 180 мкг/л. На рисунке 1 представлены данные исследования экскреции йода в разные периоды наблюдения.
Рис. 1. Медиана концентрации йода в моче на фоне приема калия йодида 200 мкг в разные периоды наблюдения
В 1–й группе средний объем щитовидной железы через 9 месяцев уменьшился от 22,97±1,5 мл до 20,8±1,6 мл (p > 0,5). Индекс превышения (ИП) – среднее отклонение объема щитовидной железы от верхней границы нормы (97 перцентили) уменьшилось от 4,97±0,7 мл до 2,8±0,8 мл (p 0,1), при колебаниях от 0,5 до 6,7 мЕ/мл до лечения и от 0,3 до 8,9 мЕ/мл через 9 месяцев. Уровень св. Т4 уменьшился от 12,7±0,4 до 11,8±0,3 пмоль/л (p > 0,1), но недостоверно, при колебаниях от 9,8 до 16,9 и от 9,1 до 15,2 пмоль/л, соответственно. По данным лабораторного исследования субклинический гипотиреоз был выявлен у 2,9% лиц.
АТ к ТГ были обнаружены только у 7,7% женщин. Уровень антител варьировал от 24 до 106 UV/ml до лечения и от 10 до 1400 UV/ml через 9 месяцев. Высокий уровень антител имела больная с клиникой аутоиммунного тиреоидита (диагноз был поставлен до начала лечения).
Через 9 месяцев антитела к ТПО были выявлены у 13,8% лиц. Уровень антител варьировал от 14 до 126 Uv/ml до лечения и от 10 до 316 Uv/ml через 9 месяцев.
Во 2–й группе объем железы уменьшился от 15,4±1,4 до 12,7±1,2 мл (p > 0,5). Индекс превышения уменьшился от 1,5±0,8 до 0,9±0,6. У 16,3% подростков объем щитовидной железы нормализовался.
Уровень ТТГ достоверно увеличился от 1,04 ±0,05 до 2,6±0,6 мЕ/мл (p Обсуждение
Методом групповой и индивидуальной йодной профилактики является назначение стандартной дозы йода в виде йодсодержащих препаратов. В своем исследовании для восполнения йодной недостаточности в районах с легким дефицитом йода мы использовали препарат калия йодид 200, содержащий физиологическую дозу йода.
Проанализировав результаты исследования, мы не выявили существенного влияния физиологических доз йода на функциональное состояние щитовидной железы, но отметили снижение частоты встречаемости антител к тиреоидной ткани.
Средний уровень ТТГ и тиреоидных гормонов существенно не изменился на фоне лечения. Развитие субклинического гипотиреоза у лиц с исходно повышенным титром тиреоидных антител могло быть обусловлено прогрессированием аутоиммунного процесса вследствие естественного течения заболевания.
Обращает на себя внимание снижение частоты встречаемости и титров антител к ТГ и ТПО в процессе приема препарата, что свидетельствует об отсутствии стимулирующего влияния физиологических доз йода на активность аутоиммунных процессов. С другой стороны данные подтверждают, что тиреоидные антитела в невысоких титрах большого клинического значения не имеют.
Медиана концентрации йода в моче, как показатель йодной обеспеченности, варьировала в диапазоне 100 – 200 мкг/л, т.е. была в пределах установленной нормы.
Объем щитовидной железы на фоне лечения уменьшился, но не достоверно: у лиц старше 20 лет на 9,8%, у подростков – на 17,5%.
Однако на фоне лечения отмечено значительное уменьшение объема железы у пациентов, имеющих зоб. Индекс превышения, т.е. среднее отклонение объема железы от верхнего предела нормы, уменьшился на 43,7% у лиц в возрасте от 20 до 59 лет (p 0,5).
В предыдущих исследованиях [2,4] мы показали высокую эффективность использования физиологических доз йода 100–150 мкг для профилактики и лечения эндемического зоба у детей школьного возраста в районах с легкой и умеренной степенью йодной недостаточности: частота зоба через 6 месяцев от начала приема препарата снизилась в 2 раза, объем щитовидной железы уменьшился на 18,2%. В настоящем исследовании прием калия йодида 200 оказался более эффективным у подростков по сравнению с лицами детородного возраста.
Во время проведения йодной профилактики следует принимать во внимание вероятность увеличения частоты ЙИТ в популяции, особенно у лиц старше 45 лет, имеющих узловые образования в щитовидной железе, даже при относительно небольшом возрастании потребления йода [13,14]. Наибольшая встречаемость ЙИТ в старших возрастных группах определяет и клинику заболевания: у больных преобладают кардиальные симптомы и депрессивное состояние.
О случаях ЙИТ сообщено из разных стран: США, Голландии, Австрии, Югославии и Австралии. После введения йодной профилактики в этих странах увеличение случаев тиреотоксикоза носило транзиторный характер и несмотря на продолжающуюся йодную профилактику снижалось к исходному [6,27,35].
Важно подчеркнуть, что проведение йодной профилактики предупреждает развитие диффузной и узловой автономии щитовидной железы и, следовательно, ЙИТ в дальнейшем. В этой связи ЙИТ в настоящее время рассматривают, как одно из проявлений йоддефицитной патологии [37]. ЙИТ может иметь тяжелые последствия в основном со стороны сердечно–сосудистой системы, и приводить к недостаточности кровообращения, фибрилляции предсердий, ухудшению течения сопутствующих сердечных заболеваний [20]. Диагностика ЙИТ нередко затруднена, особенно в случаях «субклинических» форм заболевания и у лиц пожилого возраста, в то время как раннее выявление и своевременное лечение ЙИТ может предотвратить серьезные осложнения.
Возможность развития ЙИТ требует повышенного внимания работников здравоохранения к состоянию здоровья лиц, подверженных риску заболеть явным тиреотоксикозом. Важнейшей мерой по предупреждению ЙИТ является организация мониторинга йодного потребления и его биологического действия. Если йодная профилактика осуществляется посредством йодирования поваренной соли, необходимо контролировать другие источники йода, особенно различные пищевые добавки, доза йода в которых не нормирована.
Высокие уровни йода в моче и в соли предполагают, что у ряда лиц обязательно разовьется ЙИТ. Для выявления ЙИТ необходимо следить за регистрацией всех случаев тиреотоксикоза в амбулаторных и стационарных учреждениях. Кроме того, необходимо повышать уровень знаний медицинского персонала. Полная информация о ЙИТ должна включаться в программы обучения в медицинских институтах и на курсах усовершенствования врачей.
Тем не менее многие люди регулярно принимают огромные дозы йода – от 6 до 200 мг в день без каких–либо побочных эффектов. Например, в составе амиодарона, йодсодержащих рентгеноконтрастных препаратов [23].
Лица, не имеющие патологии щитовидной железы в анамнезе, как правило, сохраняют толерантность к приему больших доз йода и остаются эутиреоидными. Мировой опыт, накопленный в течение многих лет, свидетельствует о безопасности проведения йодной профилактики, что отмечено в Заявлении Всемирной Организации Здравоохранения в 1996 году [38].
Введение йода как в органической, так и в неорганической форме может приводить к неблагоприятным реакциям со стороны щитовидной железы, которые включают не только развитие тиреотоксикоза, но и гипотиреоза с увеличением или без тиреоидного объема, а также к запуску аутоиммунных реакций [1].
Эксперименты на животных показали, что йод стимулирует или усиливает проявления тиреоидита как за счет увеличения иммуногенности тиреоглобулина, так и за счет повреждения щитовидной железы свободными радикалами [36]. Введение йода чувствительным линиям цыплят и крыс (BB/W, Obese – strain), предрасположенным к развитию тиреоидита, приводит к увеличению титров АТ к ТГ и ТПО, а также лимфоидной инфильтрации щитовидной железы. То же количество йода не оказывает соответствующего эффекта у особей нормальной линии. Из этого следует, что йодиндуцированные тиреоидиты развиваются у генетически предрасположенных животных. В то же время назначение пищевого рациона с низким содержанием йода или препаратов, блокирующих поступление йода в щитовидную железу или органификацию йода (метимазол, пропилтиоурацил), предупреждает синтез АТ к ТГ и ТПО, лимфоидную инфильтрацию и сохраняет эутиреоидный статус у чувствительной линии крыс и цыплят, в то время как у нелеченных особей выраженная лимфоидная инфильтрация и гипотиреоз развиваются в первые 5 недель жизни.
Другие исследования показали, что высокойодированный тиреоглобулин более иммуногенен, чем низкойодированный, и это непосредственно связано с формированием йодированных тиронинов в молекуле тиреоглобулина, т.к. иммунизация высокойодированным тиреоглобулином увеличивала содержание антител к Т3 и Т4 [15,19].
Хорошо известно, что йод может повреждать тиреоциты при определенных условиях. Высокие дозы йода могут вызывать некроз гиперплазированных тиреоцитов у нормальных животных и тиреоидных фолликулов человека in vitro [29]. Если же активность пероксидазы блокирована, повреждение может не произойти, что указывает на оксидант–опосредованный механизм йодиндуцированного повреждения. Кроме того, для развития йодопосредованного окислительного повреждения у животных необходимой предпосылкой является высокая стимуляция щитовидной железы эндогенным ТТГ.
Изучение эффектов антиоксидантов показало, что разрушение, вызванное йодом, опосредуется кислородными радикалами. Так, например, введение экзогенных антиоксидантов или дефицит внутриклеточных антиоксидантов могут ослаблять либо потенцировать эффекты йода, уменьшая или усиливая тяжесть тиреоидитов [7].
Первичное повреждение щитовидной железы является важным фактором в развитии аутоиммунных тиреоидитов у генетически предрасположенных животных.
В то время как роль йода в запуске или обострении аутоиммунной патологии у животных доказана в экспериментах, участие его в патогенезе аутоиммунных заболеваний щитовидной железы человека все еще обсуждается. Имеются лишь косвенные доказательства, что длительный избыток йода может провоцировать развитие аутоиммунных заболеваний щитовидной железы у предрасположенных лиц.
Так, в недавнем исследовании, проведенном в различных районах Англии и Уэльса [32], не было установлено связи между уровнем АТ к ТГ, ТПО, распространенностью зоба и уровнем потребления йода. Авторы пришли к выводу, что генетическая предрасположенность к заболеваниям щитовидной железы, а не различия в потреблении йода, является главной причиной появления тиреоидных антител.
Несмотря на то, что в большинстве эпидемиологических исследований установлена взаимосвязь между уровнем потребления йода и частотой аутоиммунной патологии щитовидной железы, некоторые работы свидетельствуют, что у лиц с эндемическим зобом также распространены аутоиммунные феномены. В частности, более высокая частота АТ к ТГ, ТПО была обнаружена в районах с умеренной йодной недостаточностью по сравнению с йодобеспеченными районами [22].
Переоценка проблемы была произведена после обследования, проведенного в Сардинии, целью которого было изучение распространенности и географическое распределение АТ к ТГ и ТПО и зоба у школьников 6–14 лет в 28 населенных пунктах острова [30]. Дополнительно исследовались антитела к островковым клеткам поджелудочной железы (АОК), так как распространенность диабета I типа в Сардинии высока. Результаты исследования показали колебания уровня АТ к ТГ и ТПО (0–8.7%) и зоба (11–48%) в разных районах. Корреляция между этими показателями отсутствовала. Не было корреляции между АТ к ТГ и ТПО, АОК и тяжестью зобной эндемии. Исследователи пришли к выводу, что в запуске аутоиммунных реакций главную роль играют генетические и/или факторы окружающей среды независимо от уровня потребления йода.
По аналогии с экспериментальными моделями на животных можно предположить, что введение йода способно модулировать активность и/или клинические проявления аутоиммунных заболеваний щитовидной железы у генетически предрасположенных людей.
После введения йодной профилактики в США [34] ремиссия аутоиммунного тиреотоксикоза на фоне приема антитиреоидных препаратов наступала в более отдаленные сроки. Частота рецидивов аутоиммунного тиреотоксикоза после тиреоидэктомии была выше в районах с избыточным потреблением йода, чем в районах с нормальным его потреблением. Одинаковые дозы антитиреоидных препаратов чаще вызывали развитие гипотиреоза у пациентов, проживающих в йоддефицитных районах, чем в йодобеспеченных. За последние 50 лет после введения йодной профилактики было отмечено увеличение распространенности тиреоидита Хашимото (с другой стороны, это можно объяснить появлением новых методов обследования и улучшением качества диагностики).
В эндемичных районах Греции после введения йодной профилактики увеличилась частота встречаемости АТ к ТГ и ТПО, в то время как введение йодной профилактики в Финляндии не привело к увеличению частоты гипотиреоза и аутоиммунного тиреоидита [8,26].
Изучая эффекты введения 400 мг йода в составе пролонгированного препарата йодированного масла (липиодола) у лиц детородного возраста без патологии щитовидной железы, мы не выявили его влияния на функцию щитовидной железы и активность аутоиммунных процессов [5,24].
В настоящем исследовании мы показали, что назначение физиологических доз йода в составе препарата калия йодида 200 с целью профилактики и лечения диффузного эндемического увеличения щитовидной железы у лиц старше 16 лет, проживающих в районах с легкой степенью йодной недостаточности, оправдано и эффективно. Риск развития йодиндуцированных состояний при введении физиологических доз йода лицам без узловых образований в щитовидной железе практически отсутствует.
Однако в настоящее время у населения нет достаточной мотивации проведения индивидуальной йодной профилактики, что сказывается на результатах профилактических мероприятий. Лица, включенные в настоящее исследование, принимали препарат нерегулярно, особенно подростки, ссылаясь на забывчивость, безразличие к своему состоянию, отсутствие возможности приобрести препарат.
1. Групповая и индивидуальная йодная профилактика в районах с легкой степенью йодной недостаточности с использованием калия йодида в дозе 200 мкг в сутки приводит к снижению частоты зоба и уменьшению объема щитовидной железы, а также обеспечивает нормальную экскрецию йода с мочой у подростков и лиц детородного возраста.
2. Физиологические дозы йода у лиц без патологии щитовидной железы не оказывают существенного влияния на ее функциональное состояние и активность аутоиммунных процессов. У лиц с исходно повышенным титром тиреоидных антител отмечается снижение их уровня в процессе коррекции йодной недостаточности.
3. Профилактические дозы йода в составе калия йодида 200 не провоцируют манифестацию аутоиммунных процессов в щитовидной железе, однако у лиц с доказанной аутоиммунной патологией не исключено обострение заболевания.
4. Проведение групповой и индивидуальной йодной профилактики не требует предварительного обследования с целью исключения аутоиммунной патологии.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Калия йодид 200 Берлин–Хеми (торговое название)
1. Герасимов Г.А., Петунина Н.А. Йод и аутоиммунные заболевания щитовидной железы // Пробл. эндокринол. – 1993.– № 3 – С.52– 54.
2. Дедов И.И., Герасимов Г.А., Свириденко Н.Ю. и др. Использование таблетированных препаратов йода для профилактики эндемического зоба // Пробл. эндокринол.– 1998.–N 1.– С. 24–27
3. Дедов И.И., Юденич О.Н., Герасимов Г.А., Смирнов Н.П. Эндемический зоб. Проблемы и решения // Пробл. эндокринол. – 1992.– T.38 – N З. – С. 6–15.
4. Петеркова В.А., Герасимов Г.А., Свириденко Н.Ю. и др. Альтернативные методы проведения йодной профилактики с целью компенсации йодной недостаточности у детей. Применение в качестве йодной профилактики поливитаминного препарата юникап М и йодида калия // Педиатрия.– 1996.– N6.– С. 72–75
5. Свириденко Н.Ю., Майорова Н.М., Назаров А.Н. и др. Использование препарата иодированного масла (липиодол) в районах с умеренной йодной недостаточностью // Проб. эндокринол.- 1995.- №6.- С. 8- 11.
6. Свириденко Н.Ю., Майорова Н.М., Назаров А.Н. и др. Использование препарата иодированного масла (липиодол) в районах с умеренной йодной недостаточностью // Пробл. эндокринол.– 1995.– №6.– С. 8 – 11.
8. Adams D., Kennedy T., Stewart J. Hyperthyroidism in Tasmania following iodide supplementation: measurments of thyroid– stimulating autoantibodies and thyrotropin // J. Clin. Endocrinol. Metab. – 1975. – Vol.41 – N. 2.– P.221–228.
9. Bagchi N, Brown TR, Herdegen DM, Dhar A et al. Antioxidants delay the onset of thyroiditis in Obese strain chickens. // Endocrinol. – 1990 – Vol.127 – P.1590–1595.
10. Boukis M.A., Koutras D.A., Souvatzoglou A. Thyroid Hormone and Immunological Studies in Endemic Goiter//J. Clin. Endocrinol. Metab. – 1983. – Vol.57 – N. 4. – P.859–862.
11. Bourdoux P., Mahangaiko E., Batende J. et al. Iodine–induced thyrotoxicosis five years after iodine supplementation // J. Endocrinol. Invest.– 1999.–Vol.22, Suppl. №6.–P.120
12. Boyages S.C., Bloot A.M., Maberly G.F. Thyroid autoimmunity in endemic goitre caused by excessive iodine intake // Clin. Endocrinol. – 1989.– Vol.31 – N. 4 – P.453–465.
13. Braverman L. Adequate iodine intake: the good far outweighs the bad //Eur.J. Endocrinol.–1998.–Vol.139,№1.–P.14–15.
14. Bravermann L. Iodine induced thyroid disease // AMA. – 1990. – Vol. 17 – P. 29–33
15. Corvilain B., Sande J., Dumont J. Autonomy in endemic goiter // Thyroid. – 1998. – Vol.8. – N.1. – P. 107–113.
16. Galofre J., Fernandez–Calvet L., Rios M., Garcia–Mayor R. Increased incidence of thyrotoxicosis after iodine supplementation in an iodine sufficient area //J. Endocrinol. Invest. – 1994 – Vol. 17. – P. 23–27
17. Champion BR, Rayner DC, Byfield PGH, Page CTJ et al. Critical role of iodization for T cell recognition of thyroglobulin in experimental murine thyroid autoimmunity. // J. Immunol. – 1987. – Vol. 139. – P.3665–3670.
18. Glinoer D. Maternal and neonatal thyroid function in mild iodine deficiency // In: The thyroid and iodine. – Stuttgart, New York – 1996 – P. 129–143.
19. Glinoer D., De Nayer P., Delange F., Lemone M., et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects //J. Clin. Endocrinol. Metab. – 1995. – V. 80 – P. 258–269
20. Delange F, Benker G., Caron P. et al. Thyroid and urinary iodine in European schoolchildren: standardization of values for assessment of iodine deficiency //Eur. J. Endocrinol. – 1997. – Vol. 136. – P. 180–187.
21. Ebner SA, Lueprasitsakul W, Alex S, Fang SL et al. Iodine content of rat thyroglobulin affects its antigenicity in inducing lymphocytic thyroidits in the BB/W or rat. //Autoimmunity. – 1992. – Vol.13. – P. 209–14.
22. Dunn J., Semigran M., Delange F. The prevention and management of iodine–induced hyperthyroidism and its cardiac features // Thyroid. – 1998. – Vol.8. – N.1. – P. 101–106.
23. Dremier S., Coppee F., Delange et al. Thyroid autonomy: mechanism and clinical effects //J. Clin. Endocrinol. Metab.–1996.–N.– 81.–P. 4187–4193.
24. Fenzi G.F., Bartalena L, Lombardi A. Thyroid Autoimmunity and Endemic Goiter // Endocr. Exp. – 1986.–Vol.20 – N.1. – P.49–56.
25. Franklyn J., Sheppard M. Amiodarone and thyroid dysfunction // Trends Endocrinol. Metab. – 1993 – Vol. 4. – P. 128–131.
26. Gerasimov G., Sviridenko N., Delange F. // Iodine in Pregnancy / Eds. J. Stanbury. et al.– New Delhi, 1998.– P. 171–180.
27. ICCIDD. Guidelines for assessment of progress towards IDD elimination // IDD Newsletter.– 1996.– Vol. 12.– P.64.
28. Lamberg B.A. Endemic goitre in Finland and changes duiring 30 of iodine prophilaxis.//Endocrinol. Exper.– 1986. –Vol.20. – P.35–47.
29. Lima N., Medeiros–Neto G. Transient thyrotoxicosis in endemic goiter patients following exposure to a normal iodine intake // Clin. Endocrinol. – 1984. – Vol.21 – N.6. – P.631–637.
30. Mannar M. The iodization of salt the elimination of Iodine Deficiency Disorders // Hetzel B., Pandav C. S.O.S for a Billion. – New Delhi, 1996. – P.99 – 119.
31. Many MC, Mestdagh C, Hove MFVD, Denef JF. In vitro study of acute toxic effects of high iodine doses in human thyroid follicles. // Endocrinol. – 1992. – N. 131. – P. 621–30.
32. Mariotti S., Loviselli A., Cambosu A., Velluzi F. et al. The role of iodine in autoimmune thyroid disease in humans /In: The thyroid and iodine //Stuttgart, New York. – 1996. – P.155–168.
33. Pennington J. A review of iodine toxicity reports // J. Amer. Diet. Assoc. – 1990. – Vol. 90 – P.1571–1581.
34. Prentice L., Phillips D., Sarsero D. et al. Geographical distribution of subclinical autoimmune thyroid disease in Britain: a study using highly sensitive direct assays for autoantibodies to thyroglobulin and thyroid peroxidase // Acta Endocr. (Copenh) – 1990. – Vol.123 – P.493–498.
35. Roti E., Braverman L. Iodine excess and thyroid function. In: The thyroid and iodine //Stuttgart, New York. – 1996. – P. 7 – 17.
36. Roti E., Gardini E., Minelli R., Bianconi L. et al. Effects of chronic iodine administration on thyroid status in euthyroid subjects previously treated with antithyroid drugs for Graves’ Hyperthyroidism //J. Clin. Enocrinol. Metab. – 1993. – Vol. 26. – P. 928 – 932
37. Stanbury J., Ermans A., Bourdoux P. et al. Iodine–induced hyperthyroidism: occurrence and epidemiology //Thyroid. – 1998. – Vol.8. – N.1. – P. 83–100.
38. Sundick R., Bagchi N., Brown T. The role of iodine in experimental thyroiditis. /In: The thyroid and iodine //Stuttgart, New York. – 1996. – P. 148 – 154.
39. WHO: Assessment of Iodine Deficiency Disorders and Monitoring their Elimination. – Geneva, 2001.
40. WHO. Eliminationg Iodine Deficiency Disorders Safely Through Solt Iodization: A WHO Statement.– 1994.–WHO/NUT/94.4
41. WHO: Indicators for Assessing Iodine Deficiency Disorders and their Control Programmes: Report of a Joint WHO/UNICEF/ICCIDD Consultation.– Geneva, 1993.
42. WHO: Recommended iodine levels in salt and guidelines for monitoring their adequacy and effectiveness. – Geneva, WHO/NUT/96.13
43. Wilson R., Mckillop J., Thomson J. The effect of pre–operative potassium iodide therapy on antibody production //Acta Endocr. (Copenh.) – 1990 – Vol. 123 – P. 531 – 534.