Serratia spp что это
Serratia spp что это
Интерес к изучению серраций подтолкнула способность этих бактерий к образованию красного пигмента. В древние времена появление кровавых пятен на различных продуктах, особенно освящённой пище, считали дьявольским наваждением, что нередко становилось причиной народных волнений.
Серрации впервые выделил итальянский бактериолог Б. Бизио и назвал их Serratia marcescens (в честь лоцмана Серафино Серрати, проводившего суда по реке Арнб).
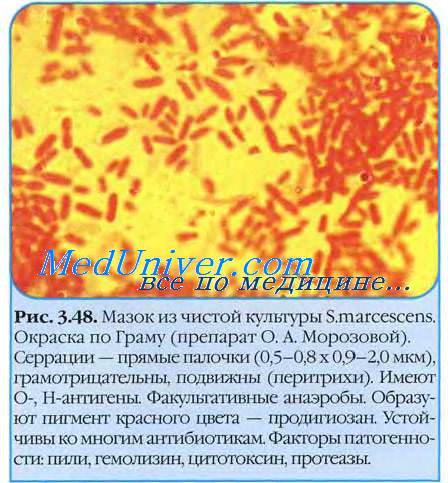
Род серраций образуют прямые подвижные (перитрихи) палочки размером 0,9-2,0×0,5-0,8 мкм, отдельные штаммы имеют капсулу. Серрации образуют розово-красный водорастворимый пигмент продигиозин.
Эпидемиология серраций. Распространенность серраций
Серрации распространены повсеместно в окружающей среде — их выделяют из почвы, воды, воздуха, с растений, различных предметов, а также из испражнений насекомых и грызунов.
Серрации, особенно serratia marcescens, ранее считали непатогенными и даже использовали при испытаниях аэрозолей или исследованиях циркуляции воздуха в помещениях из-за их ярко-красного пигмента. Экология S. marcescens аналогична таковой у синегнойной палочки.
В 60-х годах была установлена способность серраций вызывать бактериемию у стационарных пациентов и наркоманов. Позднее выяснилось, что у взрослых людей серрации наиболее часто колонизируют мочевыводящие и воздухоносные пути, а у детей — ЖКТ.
Serratia marcescens вызывает до 10% госпитальных бактериемии и пневмоний, 5% инфекций мочевыводнщих путей, хирургических ран и гнойничковых поражений кожи.
Важный момент — способность серраций к горизонтальной передаче (через руки медицинского персонала). Наиболее часто серрации проникают в организм через постоянные катетеры, интубационные устройства, а также препараты и растворы для внутривенных инфузий. У наркоманов, вводящих препараты внутривенно, часто возникают септические артриты, эндокардиты и остеомиелиты.
Семейство Enterobacteriaceae. Часть 2
Автор: врач – клинический фармаколог Трубачева Е.С.

Автор: врач – клинический фармаколог Трубачева Е.С.
Сегодня мы закончим разговор о микроорганизмах из семейства Enterobacteriaceae, которое, как мы помним, является одним из самых проблематичных источников внутрибольничных инфекций, потому что возбудители умеют делиться и передавать в рамках почти всего семейства свои механизмы резистентности, и это при том, что изначально почти каждый представитель имеет природную устойчивость к целым классам антибиотиков.
Героями сегодняшнего разговора станут энтеробактеры, серрации, морганеллы. Конечно, есть и другие представители и, возможно, в постковид они начнут встречаться намного чаще, но пока нам в рамках Азбуки достаточно вышеперечисленных плюс кишечные палки и клебсиеллы, о которых мы говорили ранее.
Enterobacter spp.
Микробиологические аспекты
Род энтеробактера включает несколько видов, но наиболее клинически значимыми из них являются:
Очень важно помнить, что энтеробактеры проявляют природную устойчивость к большому спектру антибиотиков, таким как бета-лактамы, к которым они продуцируют хромосомные AmpC бета-лактамазы, плазмидные бета-лактамазы расширенного спектра, а также карбапенемазы. Так как клинически значимые представители Enterobacter spp. обитают в желудочно-кишечном тракте человека, то основным источником инфицирования для пациента становится медицинский персонал, который просто по факту своей ежедневной работы в больнице с антибиотиками является резервуаром всевозможных антибиотикорезистентностей.
Клинически значимые аспекты
Enterobacter spp. является причиной:
Инфекций мочевыводящих путей: катетер— или инструментально-ассоциированных (как результат эндоскопических манипуляций контаминированным инструментарием).
Внутрибольничных пневмоний, в том числе вентилятор-ассоциированных.
Инфекций кожи и мягких тканей, таких как раневые инфекции, инфицирование пролежней, ожоговые инфекции и послеоперационные инфекции. Кроме того в случае полимикробного характера инфицирования пролежней возможно развитие сепсиса как исхода раневой инфекции.
Инфекций кровотока — катетер— и инструмент-ассоциированные.
Инфекций центральной нервной системы — менингиты, чаще всего внутрибольничные, как следствие нейрохирургических вмешательств.
Неонатальных инфекций, таких как некротический энтероколит, сепсис и менингит.
Чем лечить?
Ответ будет традиционным — лучше вообще не инфицировать, тогда не придется ломать голову, чем все это лечить. В основе терапии лежит обязательное микробиологическое исследование с определением антибиотикочувствительности.
В случае выявления представителей Enterobacter spp. при лечении тяжелых инфекций предпочтение следует отдавать комбинированной терапии, и самыми подходящими будут пиперациллин-тазобактам в комбинации с аминогликозидами или фторхинолонами. А для преодоления резистентности, вызванной бета-лактамазами расширенного спектра, можно использовать карбопенемы.
Для лечения инфекций мочевыводящих путей самым первым и наиважнейшим является удаление мочевого катетера до момента прекращения пиурии. Далее лечим либо исходя из профиля антибиотикограммы, либо ципрофлоксацином в правильно подобранной дозе, либо, как было указано выше, рассматриваем назначение нитрофуранов и фосфомицина.
Serratia spp.
Серрации по своей сути являются родными сестрами клебсиелл, но в отличие от последних только S.marcescens вызывает клинически значимые заболевания у людей, а остальные виды — S.liquefaciens и S.rubidaea — делают это значительно реже, и в обычной, доковидной жизни, ими можно было пренебречь.
Клинические аспекты
Что вызывает?
Катетер-ассоциированные инфекции и как их исход — сепсис.
Инфекции мочевыводящих путей как следствие медицинских манипуляций необработанным инструментом.
Раневые инфекции в послеоперационном периоде.
Нозокомиальные пневмонии как следствие интубации.
Конъюнктивиты и кератиты.
И редко вызывали остеомиелиты и эндокардиты
Терапевтические аспекты
В первую очередь про серрацию надо узнать, а значит, необходимо микробиологическое исследование. Во-вторую, вспомнить о природной устойчивости. В-третью, держать в уме то, что очень часто цефалоспорины третьего и четвертого поколения тоже не будут работать, так как посредством плазмид получают устойчивость от родственников по семейству Enterobacteriaceae, например, от родной сестры — клебсиеллы. Точно таким же образом серрация может оказаться устойчивой и к карбопенемам. К фторхинолонам резистентность так же уже давно описана.
Так чем лечить?
Лучше вообще не заражать — потому что если бак. лаборатория дает серрацию, то ниоткуда кроме как с наших рук она появиться не может, так как ни ходить, ни летать сия зверюшка до сих пор не научилась.
В случае развития тяжелых инфекций — сепсиса, вентилятор-ассоциированной пневмонии и т. п., и только при документированной чувствительности, препаратами выбора могут быть цефепим или меропенем, или ципрофлоксацин в вену в стандартных дозировках. Если чувствительность утеряна, то зовем клинического фармаколога, а если такового нет, то смотрим в сторону амикацина, пиперациллина-тазобактама и азтреонама, только помним об их побочных эффектах. Курс лечения соблюдать жизненно необходимо, чтобы зверюшка еще куда-нибудь не мутировала и новыми механизмами защиты не обзавелась. Обычно речь идет о 10–14 днях (но так как польза превышает вред, то нефротоксичность аминогликозидов со временем отступит, а ототоксичность — тут уж как повезет).
Инфекции мочеполового тракта лечим так же с учетом чувствительности, и если таковая располагает, то препаратом выбора становятся фторхинолоны, либо комбинация двух антибиотиков, например фторхинолон с карбапенемом или бета-лактам с аминогликозидом.
Эндокардиты с остеомиелитами бывают хоть и редко, но крайне метко, а потому снова сначала исследуем чувствительность, потом индивидуально в каждом случае подбираем антибиотики (а лучше зовем клинического фармаколога, пусть он мучается). И снова крайне важно соблюдение сроков лечения, для эндокардита это порядка четырех, а то и шести недель внутривенной антибактериальной терапии, а для остеомиелита не менее двух недель. Почему нельзя меньше? Потому что последует мутация и новый рецидив, а антибиотиков просто может не хватить, ибо, как и сестра-клебсиелла, серрация тоже умеет в панрезистентность.
В заключении хочется повторить, что и в этом случае проще помыть руки, чем разгребать последствия инфицирования серрацией. Мытье рук и проще, и дешевле, и, что самое главное, спокойнее.
Morganella spp.
Морганеллы будут последними представителями семейства Enterobacteriaceae, которых мы обсуждаем в рамках нашей Азбуки. Если кому-то станет интересно покопаться дальше, то к их услугам всегда будет четырехтомник по медицинской микробиологии под редакцией Лабинской, конкретно второй и третий том, в которых все очень подробно расписано, правда, чтение это для неподготовленного человека будет довольно сложным. Но вернемся к нашей морганелле.
Микробиологические аспекты
Морганелла существует только одна — M.morganii, но имеет два подвида — M.morganii и M.sibonii, которые отличаются только по ферментации треалозы, и никакого клинического значения данное отличие не имеет.
Конечно, и морганелла умеет в природную устойчивость к антибиотикам, а именно к пенициллинам, цефалоспоринам первого и второго поколения, макролидам и ко-тримоксазолу. При этом сохраняет высочайшую чувствительность к аминогликозидам, пиперациллину, цефалоспоринам третьего и четвертого поколения, фторхинолонам и карбопенемам. То есть данную зверюшку есть чем победить.
Клинические аспекты
Морганелла является представителем нормальной микрофлоры человека и самостоятельно крайне редко что-то вызывает. Этим крайне редким являются инфекции мочевыводящих путей, чему способствуют крайне пожилой возраст, длительная госпитализация, мочевой катетер и иммунодефицит любой этиологии.
В плане приобретенной антибиотикорезистентности морганелла обзавелась факторами устойчивости к фторхинолонам, что и понятно, учитывая какие именно заболевания она вызывает и чем их чаще всего лечат.
Что еще может вызывать?
Крайне редко — сепсис, как исход инфекции мочевыводящих путей.
Раневую хирургическую инфекцию.
Неонатальный сепсис и хореоамнионит.
Но стоит иметь в виду, что данные ситуации крайне редки, и стоит изначально подумать не об этом возбудителе, а о том, какой за ним может прятаться в виду контаминации материала, и лучше бы все еще раз пересеять и перепроверить.
Терапевтические аспекты
Если результат микробиологического исследования сомнений не вызывает и вы убеждены, что имеете дело с морганеллами, то препаратами выбора становятся карбопенемы, и только в случае их недоступности и документированной бактериологом чувствительности, можно посмотреть в сторону цефалоспоринов, например, цефтазидима (для которого нужна отдельная цефалоспориназа, чтобы он был инактивирован), а лучше цефтазидим-авибактама. Хотя если недоступны карбопенемы, то и Завицефте, скорее всего, взяться будет неоткуда.
Какие препараты могут быть использованы в качестве резервных? Решать этот вопрос также необходимо только после получения результата микробиологии и чувствительности в идеале по МПК, и только после этого рассматривать назначение цефепима или ципрофлоксацина, или аминогликозидов (они, к слову, в случае морганеллы могут обоснованно выступать в качестве монотерапии инфекций мочевыводящих путей).
На этом автор заканчивает обзор семейства Enterobacteriaceae и в сотый раз призывает: «Коллеги, мойте руки! Это намного проще, дешевле и быстрее, чем лечить то, что с немытых рук может упасть в пациента».
Инфекции, вызываемые Klebsiella, Enterobacter, и Serratia
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, FACP, Wellington Regional Medical Center
Инфекции, вызываемые Klebsiella, Enterobacter и Serratia часто являются внутрибольничными и встречаются главным образом у пациентов со сниженной резистентностью. Все три микроорганизма могут быть причинами большого разнообразия инфекций, включая бактериемию, инфекции в области хирургических вмешательств, внутрисосудистые инфекции после установки сосудистых катетеров и инфекции дыхательных или мочевых путей, которые проявляются как пневмония, цистит или пиелит и могут прогрессировать до абсцесса легкого, эмпиемы, бактериемии и сепсиса, как указано ниже:
Пневмония, обусловленная Klebsiella, редкое и тяжелое заболевание с темно-коричневой или ярко-красной желеобразной мокротой, формированием абсцесса легкого и эмпиемой, наиболее распространена среди диабетиков и алкоголиков.
Serratia, особенно S. marcescens, оказывают большее воздействие на мочевые пути.
Enterobacter наиболее часто вызывает нозокомиальные инфекции, но может вызывать средний отит, целлюлит и неонатальный сепсис.
Диагноз ставится на основе результатов бактериологического посева крови и/или другой пораженной ткани. Проводятся также тесты чувствительности.
Лечение
Антибиотики исходя из результатов анализа чувствительности
Лечение – цефалоспорины 3-го поколения, цефепим, карбапенемы, фторхинолоны, пиперациллин/тазобактам или аминогликозиды. Однако поскольку некоторые изоляты являются резистентными к многим антибиотикам, важен анализ антибиотикочувствительности.
Штаммы Klebsiella, которые вырабатывают бета-лактамазу расширенного спектра (ESBL), могут развивать устойчивость к цефалоспоринам во время лечения, особенно к цефтазидиму; эти ESBL-штаммы подавляются в разной степени ингибиторами бета-лактамазы (например, сульбактам, тазобактам, клавуланат, ваборбактам, авибактам). Виды K. pneumoniae, которые вырабатывают карбапенемазы (KPC), выделены как во всем мире, так и в США, что делает лечение некоторых инфекций очень проблематичным. Цефтазидим/авибактам имеропенем/ваборбактам (которые включают новые ингибиторы бета-лактамаз, подавляющие также КРС-карбапенемазу) также, как и эравациклин, обладают активностью в отношении KPC-изолятов.
Штаммы Enterobacter могут стать резистентными к большинству beta-лактамных антибиотиков, включая цефалоспорины 3-го поколения; фермент бета-лактамаза, который они продуцируют (AmpC бета-лактамаза), не подавляется обычными ингибиторами бета-лактамазы (клавуланат, тазобактам, сульбактам). Однако эти штаммы Enterobacter могут быть восприимчивы к карбапенемам (например, имипенем, меропенем, дорипенем, эртапенем). Также были обнаружены карбапенемаза-устойчивые энтеробактерии. В некоторых случаях цефтазидим/авибактам, меропенем/ваборбактам, имипенем/релебактам, тигециклин, эравациклин, и, возможно, колистин могут быть единственными доступными активными антибиотиками (1 Справочные материалы по лечению Грамотрицательные бактерии Klebsiella, Enterobacter и Serratia – тесно связанная нормальная флора кишечника, которая редко вызывает заболевание у здоровых хозяев. Диагноз подтверждается посевом. Прочитайте дополнительные сведения ).
Справочные материалы по лечению
1. Thaden JT, Pogue JM, Kaye KS: Role of newer and re-emerging older agents in the treatment of infections caused by carbapenem-resistant Enterobacteriaceae. Virulence 8(4):403–416, 2017. doi: 10.1080/21505594.2016.1207834.
Serratia spp. (качественный метод)
Описание исследования
Serratia species (серрации) – это имеющие форму палочек грамотрицательные условно-патогенные бактерии семейства Enterobacteriaceae. Они являются факультативными анаэробами*, отличаются подвижностью и широким распространением в окружающей среде. Значительное количество серраций содержится в человеческом кале. Наиболее распространенным и изученным видом Serratia species является Serratia marcescens. Виды S. plymuthica, S. liquefaciens, S. rubidaea и S. odoriferae более редкие.
Заражение Serratia species происходит:
Serratia species являются возбудителем:
У взрослых пациентов серрации обычно поражают мочевыводящие пути и органы дыхательной системы. У детей бактерия является возбудителем желудочно-кишечных инфекций. У наркозависимых лиц результатом инфицирования чаще всего становится развитие септических артритов (при данном заболевании суставы опухают и болят, становятся горячими и малоподвижными), эндокардита, остеомиелита.
Поскольку Serratia species проявляют резистентность (устойчивость) ко многим антибактериальным препаратам, то в случае их выявления и перед определением тактики лечения пациенту рекомендуется пройти обследование на индивидуальную чувствительность к антибиотикам.
Данное обследование проводится методом полимеразной цепной реакции, позволяющим выявить в исследуемом биоматериале (соскобе урогенитальном, соскобе с задней стенки глотки, сперме, моче) специфические фрагменты генетического материала – ДНК Serratia species.
*Факультативные анаэробы – это микроорганизмы, процесс жизнедеятельности которых проходит без доступа кислорода, но его присутствие не является для них смертельным.
Подготовка к исследованию
Соскоб урогенитальный (цервикальный канал, влагалище, уретра)
Цервикальный канал, влагалище
Соскобы у женщин отбираются не ранее пятого дня от начала менструального цикла и не позже пятого дня до предполагаемой даты следующей менструации. Если наблюдаются явные признаки заболевания, отбор пробы проводится непосредственно в день обращения.
Требования по подготовке к тестированию:
Проба не отбирается:
Мочеиспускательный канал (уретра)
У лиц обоего пола проба отбирается не ранее чем через 14 дней после применения антибиотиков местного действия и 30 дней после перорального приема противобактериальных средств.
За неделю до манипуляции рекомендуется прекратить прием всех медицинских препаратов. Если отказ от лечения невозможен, то пациенту необходимо поставить об этом в известность специалиста, направляющего его на обследование.
При отборе эпителиальных клеток из мочеиспускательного канала, манипуляция проводится перед мочеиспусканием или через 1,5-2 часа после него (при обильных выделениях из уретры у мужчин – через 1 час).
Соскоб клеток эпителия с задней стенки глотки
Перед отбором биологического материала необходимо учесть следующее:
При подготовке к взятию соскоба:
Перед проведением соскоба необходимо прополоскать рот, используя для этого воду комнатной температуры.
Для получения корректного результата тестирования все эти условия необходимо соблюсти в точности. Лечащий врач может рекомендовать иные условия проведения обследования.
Сперма
Отбор материала с целью диагностики проводится до начала противобактериального, антивирусного и противопаразитарного лечения, химиотерапии, а также до лечебных или диагностических мероприятий в месте предполагаемой локализации агента инфекции. После курса лечения проба отбирается не ранее, чем через 10-14 дней при проведении локальной терапии и через 30 дней после перорального приема антибиотиков.
На анализ собирается порция первой утренней мочи, выделенной не ранее, чем через 2-3 часа после предыдущего (ночного) мочеиспускания. Ее объем должен составлять порядка 20-30 мл. Емкость, используемая для сбора биоматериала – стерильный медицинский контейнер.
Моча собирается либо до проведения химиотерапии или лечения антибиотиками, либо через месяц после окончания курса лечения.
Перед началом манипуляции необходимо тщательно обмыть гениталии. Женщинам желательно воспользоваться гигиеническим тампоном во избежание попадания в пробу слизи из влагалища. Во время менструации материал не собирается.
После наполнения контейнера на треть-половину объема, емкость с мочой плотно закрывается крышкой, дабы избежать ее вытекания.
Доставка биоматериала должна быть организована в течение максимум 6 часов. До отправки в лабораторию моча может храниться как в холодильнике (при t⁰ от +2⁰С – замораживать ее нельзя), так и в комнате, но при этом температура не должна быть выше +25⁰С.
Показания к исследованию
Тестирование предназначено для выявления в образцах биоматериала специфических фрагментов ДНК Serratia species и проводится с целью:
Интерпретация исследования
Данный тест – качественный, результат выдается в формулировках «обнаружено» или «не обнаружено».
Нормой является отсутствие в исследуемой пробе специфических фрагментов ДНК Serratia spp.
Результат анализа выдается на бланке лаборатории медицинской компании «Наука». Пример результата по данному анализу представлен ниже:
Ф.И.О.: Иванов Иван Иванович Пол: м Год рождения: 01.01.0000
Дата исследования: 12.12.0000
Serratia spp что это
Инфекционные заболевания бактериальной этиологии являются наиболее актуальной проблемой современной медицины и занимают одно из основных мест среди всей инфекционной патологии. Причины сохранения большого числа инфекционных заболеваний бактериальной этиологии до конца не известны. Они связаны со снижением видового и адаптивного иммунитета макроорганизма, с биологическими свойствами возбудителей заболеваний, эпидемиологическими особенностями распространения возбудителей, что в итоге и определяет патогенез бактериальных инфекций. Зарегистрированное популяционное снижение иммунитета человечества и нарушение нормальной микрофлоры, являющейся одной из основных систем защиты макрорганизма, приобретают решающее значение.
Особую значимость среди бактериальных инфекций имеют нозокомиальные заболевания [1]. С каждым годом число возбудителей внутрибольничных инфекций (ВБИ) увеличивается в основном за счет условно-патогенных микроорганизмов. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), представители грамотрицательной микрофлоры, аскомицеты рода Candida [2, 3]. Главной особенностью возбудителей внутрибольничных инфекций является их выраженная вирулентность и устойчивость к антибактериальным препаратам и дезинфектантам [4, 5]. В последние годы наряду с вышеперечисленными возбудителями ВБИ все чаще выделяются представители рода Serratia [6, 7].
Серрации – условно-патогенные микробы, вызывающие у человека гнойно-воспалительные заболевания различной локализации. Наиболее изученным видом является Serratia marcescens. В настоящее время бактерии рода Serratia marcesens описаны как возбудители диарейных заболеваний у человека, инфекций мочевыводящих путей, менингита, артрита, сепсиса [8]. Постоянный мониторинг изменяющихся биологических свойств выделенных клинических изолятов является одним из важнейших этапов эпидемиологической работы, в связи с чем актуально исследование постоянно меняющихся свойств бактерий этой группы.
Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia.
Материал и методы исследования. В работе использовано 58 клинических штаммов, отнесенных на основании биологических свойств к роду Serratia. Штаммы Serratia были выделены из различного патологического материала: из испражнений (15 штаммов) от пациентов с кишечными инфекциями, мочи (20 штаммов) от больных с уретритами и гнойного (раневого) отделяемого (23 штамма) от пациентов с абсцессами и флегмонами мягких тканей.
Способность к адгезии у бактерий изучали с помощью формалинизированных эритроцитов человека. Определяли основные показатели адгезии. Вычислили индекс адгезивности микроорганизмов. По данному показателю все бактерии разделили на 4 группы: 1 – неадгезивные (индекс адгезивности 4,0).
Адсорбцию бактериями красителя конго красного выявляли на 1,5%-ном мясопептонном агаре с добавлением 0,02% казаминовых кислот и 0,01% конго красного.
Способность к гемагглютинации у бактерий определяли в реакции гемагглютинации с 3%-ной взвесью свежих эритроцитов человека и барана, которую проводили на панелях из органического стекла.
Для выявления D-маннозорезистентной гемагглютинации во взвесь эритроцитов добавляли 1,5% D-маннозы [9].
Антилизоцимную активность изучали по методике О.В. Бухарина. Исследования антилизоцимной активности проводили в диапазоне концентраций от 1 до 6 мкг/мл. В качестве тест-культуры использовался штамм Micrococcus luteus var. Lysodeikticus № 2665. Гемолитическую способность бактерий определяли на мясопептонном агаре с 3–5% отмытых в растворе Хенкса эритроцитов кролика. Для выявления тиолзависимых гемолизинов использовался мясопептонный агар с 0,002% L-цистеина.
Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
Исследование адгезивных свойств бактерий рода Serratia выявило, что адгезивные штаммы с индексом адгезивности выше 2,5 составили 70,6% (41 штамм) из общего количества изученных штаммов, из которых 13 штаммов серраций (86,7%) были выделены из испражнений, 18 штаммов серраций (78,3%) были выделены из гнойного отделяемого, 10 штаммов серраций (50%) были выделены из мочи.
Все адгезивные штаммы разделили на две группы: высокоадгезивные и со средней степенью адгезивности. К штаммам, обладающим высоким индексом адгезивности (более 4), отнесли 3 штамма серраций (20%), выделенных из испражнений, 5 штаммов серраций (21,7%), выделенных из гнойного отделяемого, все адгезивные штаммы (10 бактериальных культур), выделенные из мочи.
Сренеадгезивными оказались 23 штамма (39,7%). Индекс адгезивности у них составил от 2,5 до 4. Среди выделенных из испражнений штаммов со средним показателем ИАМ было 10 штаммов (66,7%), а выделенные из гнойного отделяемого составили 13 штаммов (56,5%). Все остальные штаммы были отнесены к низкоадгезивным с индексом адгезивности микроорганизмов от 1,76 до 2,5. 40 штаммов (68,9%) из всех изученных клинических культур серраций обладали способностью адсорбировать конго красный. Из выделенных из испражнений такой способностью обладало 14 штаммов (93,3%), 10 культур серраций, выделенных из мочи (50%), а среди выделенных из гнойного отделяемого это свойство было выявлено у 16 штаммов (69,6%) (табл. 1).
Адгезивная активность штаммов рода Serratia