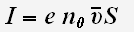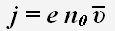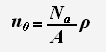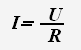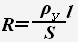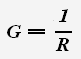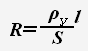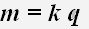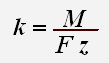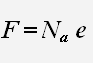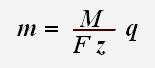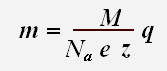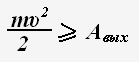упорядоченным движением каких частиц создается электрический ток в растворах электролитов
Тест с ответами: “Электрические явления”
1. Упорядоченным движением каких частиц создается электрический ток в металлах:
а) электронов +
б) отрицательных ионов
в) положительных ионов
2. Как называется единица измерения силы тока:
а) Вольт
б) Ампер +
в) Ватт
3. Как называется единица измерения электрического сопротивления:
а) Вольт
б) Ампер
в) Ом +
4. Какой формулой выражается закон Ома для участка цепи:
а) I = U/R +
б) I = R/U
в) U= R/I
5. По какой формуле вычисляется мощность электрического тока:
а) I = PU
б) P = UI
в) P = IU
6. Сила тока, проходящая через нить лампы, 0,3 А, напряжение на лампе 6 ; Каково электрическое сопротивление нити лампы:
а) 2 Ом
б) 20 Ом +
в) 0,2 Ом
7. Каково напряжение на участке электрической цепи сопротивлением 20 Ом при силе тока 200 мА:
а) 400 В
б) 40 В
в) 4 В +
8. Какова мощность электрического тока в электрической плите при напряжении 200 В и силе тока 2 А:
а) 400 Вт +
б) 40 Вт
в) 4 Вт
9. Определите работу силы тока за 2 мин в электрической плите при напряжении 200 В и силе тока 2 А:
а) 200 Дж
б) 20 Дж
в) 48 кДж +
10. Какое количество теплоты выделяется в проводнике сопротивлением 0,02 кОм за 10 мин при силе тока в цепи 2 А:
а) 480 кДж
б) 48 кДж +
в) 4,8 кДж
11. Напряжение U на концах проводника 20 B, а сопротивление R равно 10 Oм. Рассчитайте силу тока в цепи:
а) 2 А +
б) 200 А
в) 20 А
12. Электрический заряд, полученный на стеклянной палочке, потертой о шелк:
а) отрицательный
б) положительный +
в) нет заряда
13. Если потереть эбонитовую палочку о мех, электрический заряд будет:
а) отрицательный +
б) положительный
в) нет заряда
14. Силу тока в цепи измеряет:
а) омометр
б) амперметр
в) вольтметр +
15. Сила тока в цепи равна 5 А, а напряжение на концах проводника 15 В. Какое сопротивление проводника (Ом):
а) 3 +
б) 5
в) 4
16. Вольтметр подcоединяют в цепь:
а) не подсоединяют вообще
б) параллельно +
в) последовательно
17. Упорядоченным движением заряженных частиц называют:
а) магнитный поток
б) магнитное поле
в) электрический ток +
18. Сила тока … сопротивлению:
а) равна
б) обратно пропорциональна +
в) прямо пропорциональна
19. Упорядоченным движением каких частиц создается электрический ток в растворах электролитов:
а) электронов
б) положительных и отрицательных электронов
в) положительных и отрицательных ионов +
20. Как называется единица измерения напряжения:
а) Ватт
б) Вольт +
в) Ампер
21. Как называется единица измерения электрической мощности:
а) Ватт +
б) Ампер
в) Вольт
22. По какой формуле вычисляется работа электрического тока:
а) T = AIU
б) A = IUt
в) A = UIt
23. Сила тока, проходящая через нить лампы, 2 А, напряжение на лампе 10 ;Каково электрическое сопротивление нити лампы^
а) 50 Ом
б) 0,5 Ом
в) 5 Ом +
24. Каково напряжение на участке электрической цепи сопротивлением 40 Ом при силе тока 100 мА:
а) 40 В
б) 4 В +
в) 0,4 В
25. Какова мощность электрического тока в электрической лампе при напряжении 100 В и силе тока 0,5 А:
а) 500 Вт
б) 5 Вт
в) 50 Вт +
26. Определите работу силы тока за 5 мин в электрической лампе при напряжении 100 В и силе тока 0,5 А:
а) 150 кДж
б) 15 кДж +
в) 1,5 кДж
27. Какое количество теплоты выделяется в проводнике сопротивлением 0,1 кОм за 20 с при силе тока в цепи 0,2 А:
а) 80 Дж +
б) 8 Дж
в) 800 Дж
28. Совокупность электрических явлений в атмосфере, а также раздел физики атмосферы, изучающий эти явления:
а) аморфное электричество
б) атмосферные магнитные потоки
в) атмосферное электричество +
29. Начало изучению атмосферного электричества было положено в этом веке:
а) XVIII +
б) XVI
в) XVII
30. Совокупность физических явлений, обусловленных взаимосвязью между тепловыми и электрическими процессами в металлах и полупроводниках:
а) термальные явления
б) термоэлектрические явления +
в) эффект Дембера
Упорядоченным движением каких частиц создается электрический ток в растворах электролитов
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы.
Основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований. Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза (рис.9.10).
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году.
Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
где k – электрохимический эквивалент вещества:
F = eNA = 96485 Кл / моль. – постоянная Фарадея.
Второй закон Фарадея электрохимические эквиваленты различных веществ относятся их химические эквиваленты 
Объединенный закон Фарадея для электролиза:
Электролитические процессы классифицируются следующим образом:
получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.);
получение металлов (литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.);
очистка металлов (медь, серебро,…);
получение металлических сплавов;
получение гальванических покрытий;
обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка);
получение органических веществ;
электродиализ и обессоливание воды;
нанесение пленок при помощи электрофореза.
Практическое применение электролиза
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами – процесс электрорафинирования или с нерастворимыми – процесс электроэкстракции. Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах. В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки.
Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др. Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов 1 в электролизер 3 (рис.9.11). При пропускании тока металл, подлежащий очистке 1, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде 2, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми 4, либо переходят в электролит и удаляются.
На рисунке 9.11 приведена схема электролитического рафинирования меди.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегиюи гальванопластику.
Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера (рис. 9.12).
Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
 |  |
| Рис. 9.12 | Рис. 9.13 |
Рекомендуем просмотреть демонстрацию «Гальванопластика».
Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами (рис. 9.13).
С помощью гальванопластики изготовляют бюсты, статуи и т. д. Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование «накладного» слоя никеля, серебра, золота и т. д.).
Упорядоченным движением каких частиц создается электрический ток в растворах электролитов
Электрическим током называют всякое упорядоченное движение электрических зарядов. Электрический ток может проходить через различные вещества при определенных условиях. Одним из условий возникновения электрического тока является наличие свободных зарядов, способных двигаться под действием электрического поля.
Поэтому в этом разделе мы попытаемся установить, какие частицы, переносят электрический заряд в различных средах.
Электрический ток в металлах.
Под действием внешнего электрического поля меняется характер движения свободных электронов внутри металла. Электроны, продолжая хаотичные движения, вместе с тем смещаются в направлении действия сил электрического поля.
Сила тока в металлическом проводнике определяется по формуле:
Плотность тока проводимости численно равна заряду, проходящему за 1с через единицу площади поверхности, перпендикулярной направлению тока.
У большинства металлов практически каждый атом ионизирован. А так как концентрация электронов проводимости одновалентного металла равна
Закон Ома для однородного участка цепи:
Для однородного участка цепи:
Удельное сопротивление проводника зависит от температуры и эта зависимость выражается соотношением:
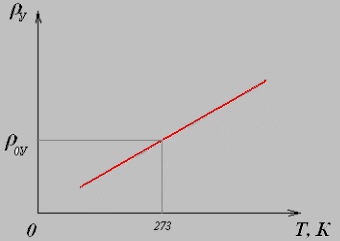
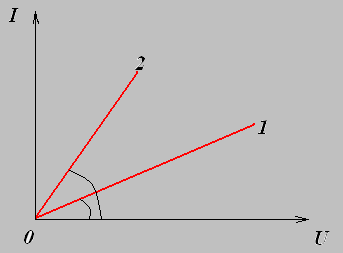
Вольт-амперная характеристика металлов.
Сила тока в проводниках по закону Ома прямо пропорциональна напряжению. Такая зависимость имеет место для проводников со строго заданным сопротивлением ( для резисторов ).
Тангенс угла наклона графика равен проводимости проводника. Проводимостью называется величина, обратная сопротивлению
Но так как сопротивление металлов зависит от температуры, то вольт-амперная характеристика металлов не является линейной.
Электрический ток в растворах и расплавах электролитов.
При движении внутри электролитов ионы взаимодействуют с молекулами воды и другими ионами, т.е. электролиты оказывают некоторое противодействие движению, а, следовательно, обладают сопротивлением. Электрическое сопротивление электролитов зависит от концентрации ионов, величины заряда иона, от скорости движения ионов обоих знаков.
Сопротивление электролитов так же определяется по формуле:
При увеличении температуры электролита уменьшается его вязкость, что ведет к увеличению скорости движения ионов. Т.е. при повышении температуры сопротивление электролита уменьшается.
1. Масса вещества, выделяемого на электроде, прямо пропорциональна электрическому заряду, прошедшему через электролит.
2. Электрохимический эквивалент вещества прямо пропорционален его химическому эквиваленту.
постоянная Фарадея численно равна заряду, который должен пройти через электролит, чтобы выделить из него массу вещества, численно равную химическому эквиваленту.
Объединенный закон Фарадея.
Электрический ток в газах.
Ионизировать молекулы можно при нагревании газа, при облучении его различного рода лучами. Благодаря дополнительной энергии возрастает скорость движения молекул, нарастает интенсивность их теплового движения и при соударении отдельные молекулы теряют электроны, превращаясь в положительно заряженные ионы.
Электроны, оторвавшись от молекулы могут присоединятся к нейтральным молекулам, образуя при этом отрицательно заряженные ионы.
Следовательно, при ионизации появляются три типа носителей зарядов: положительные ионы, отрицательные ионы и электроны.
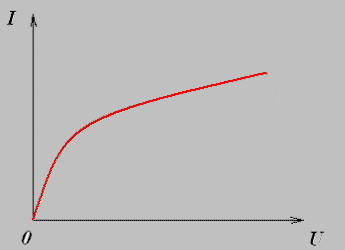
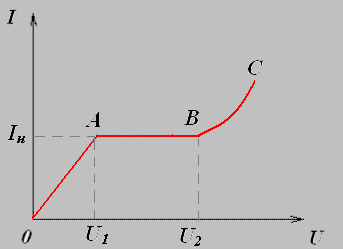
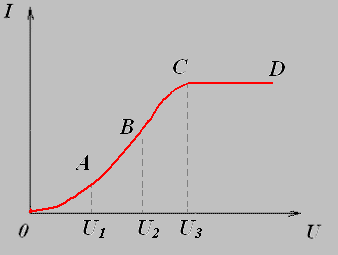
Вольт- амперная характеристика газов.
Зависимость силы тока от напряжения выражена кривой ОАВС.
На участке графика ОА сила тока подчиняется закону Ома. При малом напряжении сила тока мала, т.к. ионы двигаясь с малыми скоростями рекомбинируют, не достигая электродов. При увеличении напряжения между электродами скорость направленного движения электронов и ионов возрастает, поэтому большая часть заряженных частиц достигает электродов, а, следовательно возрастает сила тока.
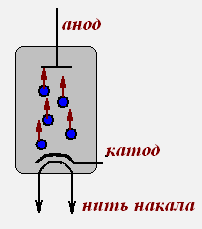
Электрический ток в вакууме.
В вакууме отсутствуют заряженные частиц, а следовательно, он является диэлектриком. Т.е. необходимо создать определенные условия, которые помогут получить заряженные частицы.
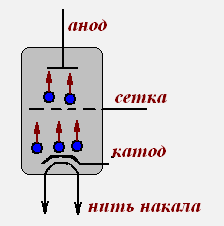
Явление термоэлектронной эмиссии лежит в основе принципа действия электронных ламп: вакуумного диода, вакуумного триода.
Вакуумный диод Вакуумный триод
Вольт-амперная характеристика вакуумного диода.
При испускании электронов катод приобретает положительный заряд и поэтому удерживает возле себя электроны. При отсутствии электрического поля между катодом и анодом, вылетевшие электроны образуют у катода электронное облако.
Нелинейная зависимость на участке ВС D объясняется тем, что число электронов, устремляющихся к аноду, стает больше числа электронов, вылетающих с катода.
При достаточно большом значении напряжения U3 все электроны, вылетающие с катода, достигают анода, и электрический ток достигает насыщения.
Так же в качестве источника заряженных частиц можно использовать радиоактивный препарат, испускающий α-частицы.Под действием сил электрического поля α-частицы будут двигаться, т.е. возникнет электрический ток.
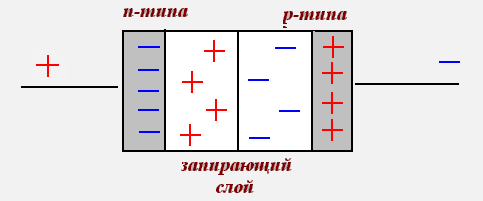
Электрический ток в полупроводниках.
В этих кристаллах атомы соединены между собой ковалентной связью. При нагревании ковалентная связь нарушается, атомы ионизируются. Это обуславливает возникновение свободных электронов и «дырок»- вакантных положительных мест с недостающим электроном.
При повышении температуры собственная проводимость полупроводника увеличивается, т.к. увеличивается число свободных электронов и «дырок».
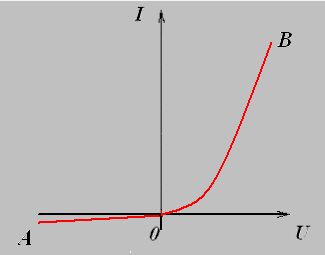
Вольт-амперная характеристика полупроводникового диода.
Зависимость силы тока от напряжения выражена кривой АОВ.
Ветвь ОВ соответствует пропускному направлению тока, когда ток создается основными носителями зарядов, и при увеличении напряжения сила тока возрастает. Ветвь АО соответствует току, созданному неосновными носителями зарядов, и значения силы тока невелики.
Электрический Ток в Растворах и Расплавах Электролитов
Электрический Ток в Растворах и Расплавах Электролитов
Электрический ток в растворах (или расплавах) электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях. Опыт показывает, что сила тока при постоянном сопротивлении электролитов линейно зависит от напряжения, т. е. для растворов электролитов справедлив закон Ома.
Величины N A и е являются универсальными постоянными, а М и z постоянны для данного вещества. Поэтому выражение

Масса вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через раствор (или пропорциональна силе тока и времени). Эта зависимость носит название закона Фарадея.
Коэффициент k называется электрохимическим эквивалентом данного вещества. Он выражается в килограммах на кулон (кг/Кл).
Закон Фарадея позволяет определить заряд одновалентного иона:
Электролиз получил широкое применение в технике:
Электрический ток в электролитах
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
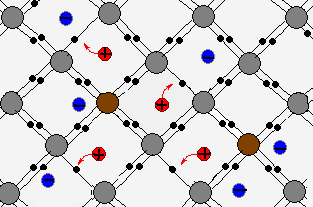
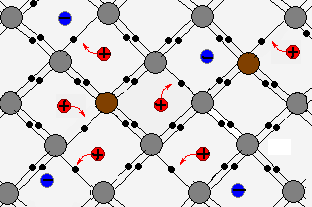
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).
Рис. 1. Молекулы воды
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
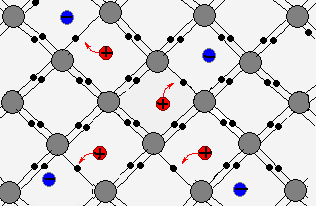
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.
Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4 ). Это и является необходимым условием прохождения тока через раствор.
Рис. 4. Раствор в воде
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
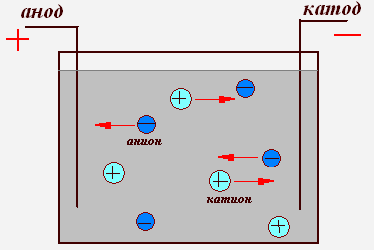
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5 ). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).
Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
Формула (3) с постоянной Фарадея запишется так: