So3 что за элемент
Оксиды серы SO2 и SO3
Автор текста Анисимова Е.С. Из курса лекций по химии
Оксиды серы: SO2 и SO3
Атомы, элементы
1. В природе есть атомы, а в атомах есть протоны.
2. О. – Атомы с восемью протонами называются атомами кислорода (атомами химического элемента кислород).
3. Не путать атом кислорода с веществом «кислород», которым люди дышат:
дышат люди молекулами кислорода, которые состоят из двух атомов кислорода каждая.
4. Атом кислорода обозначается буквой О, а молекула из двух атомов О – это О2.
5. S. – Атомы с 16-тью протонами называются атомами серы (атомами химического элемента сера) и обозначаются буквой S.
6. Атомы с одинаковым числом протонов считаются атомами одного химического элемента.
7. Сера – это химический элемент.
Оксиды
8. Атомы кислорода могут соединяться с атомами другого химического элемента.
9. Соединения атомов кислорода с атомами серы называются оксидами серы.
10. Соединение из двух атомов водорода (Н) и одного атома кислорода (О) называется: молекулой оксида водорода или молекулой ВОДЫ.
S и 2О = SО2
11. Атом серы (S) может соединиться с двумя атомами кислорода (О).
12. Объединение одного атома серы S и двух атомов О даёт соединение состава SО2.
13. SО2 – это молекула. Формула молекулы.
14. SО2 является газом. В обычных условиях.
15. Вещество, молекулы которого имеют состав (и формулу) SО2, называется сернистым газом или оксидом серы IV.
16. SО2 – это формула молекулы сернистого газа.
SО2 и воздух
17. SО2 в атмосфере почти нет в норме. (Очень мало)
18. SО2 выделяется вулканами, заводами и автомобилями.
19. SО2 образуется при сжигании бензина, угля и т.д. Потому что примеси серы есть в угле и бензине.
20. В современной атмосфере SО2 больше, чем сто или тысячу лет назад.
21. Почему сейчас SО2 больше, чем сто лет назад? См. выше.
22. Поступление SО2 в атмосферу приводит к кислотным дождям.
23. Кислотные дожди портят здания, автомобили, памятники – всё созданное людьми. В том числе древние памятники искусства, шедевры архитектуры.
24. Из-за кислотных дождей во многих озёрах не стало рыбки.
25. Из-за кислотных дождей во многих лесах не стало листьев: листва опадает, деревья погибают.
26. Из-за кислотных дождей на многих полях не стало нормальной почвы: почва становится слишком кислой.
27. Из-за кислотных дождей на многих полях снизились урожаи.
28. Снижение урожаев грозит голодом.
29. Кислотные дожди портят леса, поля и озёра и создают угрозу голода.
30. Избавиться от кислотных дождей нужно за счёт снижения выбросов SO2 в атмосферу.
31. SO2 может быть источником серы для промышленности и с/х.
32. В атмосфере SO2 превращается в серную кислоту. (через…)
33. Много SO2 есть в атмосфере Венеры, вокруг неё целые облака из серной кислоты.
34. S и 3О = SО3
35. Атом серы (S) может соединиться с тремя атомами кислорода (О).
36. Объединение одного атома серы S и трёх атомов О даёт соединение состава SО3.
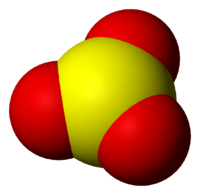
37. SО3 – это молекула. Формула молекулы.
38. SО3 является жидкостью. В обычных условиях.
39. SO3 – это единственный жидкий оксид, кроме воды.
40. Вещество, молекулы которого имеют состав (и формулу) SО3, называется оксидом серы-VI.
41. SО3 – это формула молекулы оксиды серы VI.
42. Контакт молекул SO3 с молекулами воды даёт серную кислоту.
Оксид серы (VI)
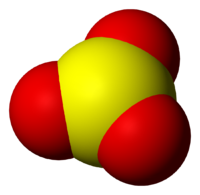
Оксид серы (VI)
| Оксид серы(VI) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(VI) |
| Химическая формула | SO3 |
| Отн. молек. масса | 80.06 а. е. м. |
| Молярная масса | 80.06 г/моль |
| Физические свойства | |
| Плотность вещества | 1.92 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | 16,9 °C |
| Температура кипения | 45 °C |
| Энтальпия (ст. усл.) | −397.77 кДж/моль |
| Классификация | |
| номер CAS | [7446-11-9] |
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
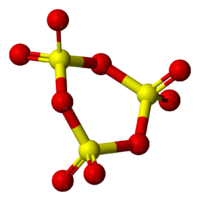
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
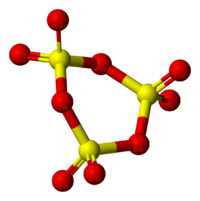
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул тримера. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Содержание
Получение
Можно получить термическим разложением сульфатов:
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
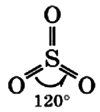
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
















 Серная кислота
Серная кислота Реакция серной кислоты с цинком
Реакция серной кислоты с цинком Реакция серной кислоты с сахаром
Реакция серной кислоты с сахаром Железный купорос
Железный купорос