тимус до какого возраста функционирует
Тимус до какого возраста функционирует
Иммунные реакции в организме человека осуществляются тремя основными системами иммунитета — гуморальной, связанной с В-лимфоцитами, продуцентами Ig- и специфических антител, клеточной, связанной с различными субпопуляциями Т-лимфоцитов (хелперов, киллеров, супрессоров и лимфоцитов, влияющих на дифференцировку), и фагоцитарной, включающей системы микро- и макрофага.
Соответственно направлениям иммунных реакций можно схематически различать следующие основные дефекты иммунной системы: дефект гуморального, клеточного иммунитета, фагоцитарной и комплементарной систем и комбинированный иммунный дефект.
Анатомическим субстратом, осуществляющим иммунные реакции, являются лимфоидные органы — тимус, селезенка, групповые лимфатические и солитарные фолликулы, особенно пищеварительного тракта, лимфатические узлы и костный мозг.
Костный мозг — не только источник стволовых клеток, но, как показывают исследования последних лет, регулятор миграции и дифференцировки стволовых клеток. Кроме того, в иммунных реакциях принимают участие лимфоциты, макро- и микрофаги, мигрирующие в периферическую кровь, в слизистые оболочки, периваскулярные и периневральные пространства, в интерстиции паренхиматозных органов и серозные листки.
Тимус как орган иммунитета играет ведущую роль, особенно в пренатальном периоде и в периоде первых лет жизни, и поэтому оценка морфологических изменений в тимусе имеет большое значение в педиатрической патологоанатомической практике.
Как показывают наши исследования, изменения в тимусе имеют основное значение для решения вопроса о наличии или отсутствии врожденных и приобретенных иммунодефицитпых состояний. Однако для подтверждения характера иммунного дефекта необходимо исследовать Т- и В-зависимые зоны периферических лимфоидных органов и изучить клинические иммунологические данные.
Возрастная инволюция тимуса
Для правильной оценки изменения в тимусе следует прежде всего различать возрастные изменения органа.
К моменту рождения у доношенных новорожденных тимус полностью сформирован. У недоношенных мертворожденных плодов 28—30 нед можно Наблюдать незрелую структуру тимуса, которая характеризуется наличием зрелых долек, имеющих вид пластов ретикулоэпителия, не заселенных лимфоцитами.
Тимус у этих плодов, кроме того, может состоять из долек, умеренно заселенных лимфоцитами, с хорошо различимым камбиальным слоем эпителия на периферии, расположенного на базальной мембране. Наряду с этим имеются зрелые дольки с хорошо различимым корковым и мозговым слоем. Эти изменения, характерные для незавершенного созревания тимуса, весьма вариабельны и могут наблюдаться в более поздние периоды у плодов и младенцев при недоношенности и даже у доношенных новорожденных как свидетельство задержки созревания.
В постнатальном онтогенезе тимус претерпевает возрастную инволюцию, которая начинается с 5—8 лет жизни и завершается к пубертатному периоду.
Процесс возрастной инволюции характеризуется постепенным развитием в железе жировой ткани, врастающей в дольки тимуса. Возрастной жировой метаморфоз тимуса протекает синхронно с возрастным жировым метаморфозом костного мозга длинных трубчатых костей. Несмотря на разрастание жировой ткани, в костном мозге и в тимусе сохраняются элементы паренхимы органов (стволовые клетки костного мозга, ретикулоэпителий тимуса), которые при определенных патологических состояниях могут обусловливать пролиферативный процесс.
Постнатальный онтогенез периферических лимфоидных органов заметно запаздывает по сравнению с морфогенезом тимуса.
Раньше всех лимфоидных органов развиваются лимфатические фолликулы тонкой и толстой кишки, а из лимфатических узлов — мезентсриальные узлы. В групповых и солитарных лимфатических фолликулах кишки у доношенных, а иногда и у недоношенных новорожденных уже имеются сформированные фолликулы, почти одновременно мелкие фолликулы появляются в селезенке; в лимфатических узлах они развиваются позже, формируясь в первый месяц внеутробной жизни.
Соответственно этому деление на Т- и В-зоны в лимфатических узлах у детей первых трех месяцев жизни, учитывая также и индивидуальные колебания, бывает очень трудно выявить, так как ориентиром для распознавания зональности являются прежде всего фолликулы коркового слоя лимфатического узла. С появлением фолликулов и особенно с формированием в них светлых центров, которые наблюдаются в первые три месяца жизни, возможно определение зональности с оценкой их состояния.
— Вернуться в оглавление раздела «Акушерство.»
Тимус – что это? Роль тимуса на первому году жизни ребенка
Консультация педиатра со скидкой 20%
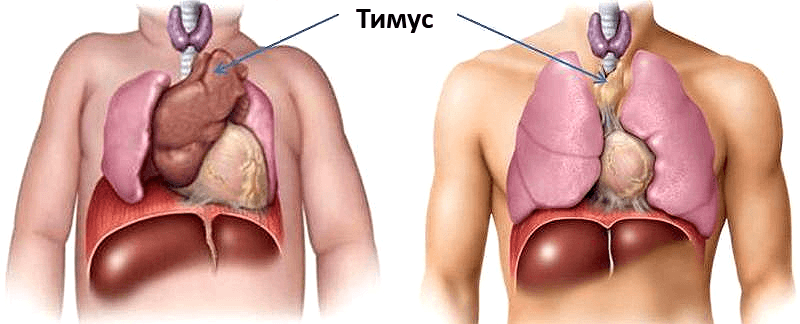
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе. Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами. Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую. Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием. Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем. Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
Возрастные перестройки тканевой организации тимуса позвоночных
Осуществлено сравнительно-морфологическое изучение возрастных изменений тканевой организации тимуса позвоночных животных, относящихся к разным систематическим группам. У большинства позвоночных, независимо от таксономической принадлежности, по мере развития явлений, связанных с возрастной инволюцией, эффективно срабатывают механизмы поддержания иммунологического гомеостаза. Об этом свидетельствует ряд общих тенденций: увеличение количества волокнистой соединительной ткани, снижение корково-мозгового индекса и способность поддерживать процентный показатель лимфоидной ткани на стабильно высоком уровне. Данные, полученные на примере норки американской (клеточное содержание) и человека, указывают на то, что по мере старения, организм, находящийся под воздействием факторов антропогенной среды, очень быстро утрачивает возможности поддерживать гомеостаз лимфоцитопоэтической функции на должном уровне. Это обстоятельство определяет повышенные темпы деградации лимфоидного компонента тимуса данных видов позвоночных, в сравнении с представителями природной среды обитания. Данные, полученные в процессе сравнительно морфологического исследования тимуса позвоночных, актуальны для ряда отраслей фундаментальной и прикладной биологии и медицины.
Жизнеспособность организма во многом зависит от состояния иммунной защиты. Являясь первичным лимфоидным органом, тимус находятся в центре функциональных систем, связанных с формированием и управлением иммунными реакциями. Тесная связь с красным костным мозгом, участие в формировании клеточного и гуморального иммунитета, активные гормональные явления в тканях тимуса приводят к повышенной чувствительности данного органа к широкому спектру внешних и внутренних воздействий. По этой причине тимус представляет собой орган-индикатор, морфологическое состояние которого надежно отражает главные характеристики иммунного статуса организма, свидетельствует о состоянии здоровья и указывает на степень оптимальности условий жизни. Как показывают результаты исследований, при тех или иных воздействиях на организм, в тимусе особенно динамично изменяются количественные и качественные показатели, характеризующие состояние соединительно-тканного и лимфоидного компонентов. Именно поэтому состояние данных тканевых компонентов тимуса позволяет быстро и качественно оценивать степень функциональной активности органа, а также определять масштабы возрастных перестроек и наличие патологий. К настоящему моменту научное сообщество достаточно далеко продвинулось в изучении морфофункциональных характеристик тимуса позвоночных животных и человека. Изучены главные показатели тканевой организации тимуса у различных представителей типа хордовые, начиная с круглоротых и рыб, заканчивая теплокровными позвоночными. Однако разнонаправленность целей, задач, методических подходов в изучении тимуса животных, отсутствие единого плана сравнения результатов исследований, наталкивают на простой и вполне очевидный вывод о сходстве тканевого строения тимуса, а также сходстве характеристик возрастной инволюции данного органа у всех позвоночных. На наш взгляд данный вывод не вполне объективен, поскольку животные, находящиеся на разных ступенях эволюционной лестницы, располагают отличающимися характеристиками иммунной и эндокринной систем. Дефицит сравнительно-морфологических исследований тимуса является главной причиной отсутствия более точных сведений о степени сходств и различий микроморфологического строения этого органа у представителей разных систематических и возрастных групп позвоночных.
В нашем исследовании проведено сравнительно-морфологическое изучение основных характеристик соединительной и лимфоидной ткани тимуса в ряду позвоночных животных с учетом возрастных изменений. Исследование тимуса проводили на примере 14-ти видов позвоночных животных, относящихся к четырем классам, отличающихся уровнем организации: класс Земноводные (Amphibia), класс Пресмыкающиеся (Reptilia), класс Птицы (Aves), класс Млекопитающие (Mammalia). Исследование проводили на примере неполовозрелых особей и особей II периода зрелого возраста.
Полученные результаты показали, что у всех позвоночных животных, независимо от уровня организации возрастные изменения тимуса подчиняются общеизвестным закономерностям: с возрастом наблюдается уменьшение площади коркового вещества тимуса, что связано со снижением лимфоцитопоэза в красном костном мозге и снижением интенсивности формирования зрелых тимоцитов тимусе (Заглавная иллюстрация).
Впервые выявлено, что у позвоночных животных имеются отличия в характере границ коркового вещества тимуса с его мозговым веществом и субкапсулярной зоной. Причиной тому отличающиеся характеристики взаимодействия красного косного мозга и тимуса. В основе такого взаимодействия лежат гормональные взаимовлияния, настройка и совершенствование которых заняла достаточно продолжительный период времени в филогенезе, и окончательно сформировалась только у теплокровных позвоночных. Жизнеспособность представителей различных таксономических групп позвоночных наглядно иллюстрирует тот факт, что любой из них способен поддерживать параметры гомеостатической регуляции на достаточном уровне. Однако представители разных классов типа Chordata отличаются, порой существенно, по уровню морфофункциональной организации. Несомненно, в этих условиях достижение одного и того же конечного результата (гомеостаз) возможно благодаря некоторому расхождению механизмов частного характера, что и приводит к наблюдаемым нами отличиям морфологической картины.
В литературе имеются работы, указывающие на высокую энергетическую «стоимость» иммунитета. Повышенная энергоемкость иммунных реакций приводит к расхождению в масштабах возрастной трансформации корково-мозгового индекса у разных представителей сравнительно морфологического ряда. Соответственно наиболее сильное возрастное снижение доли коркового вещества наблюдается в тимусе птиц, использующих наиболее затратный способ передвижения, и землероек, отличающихся максимальными, среди всех позвоночных, темпами энергетического обмена веществ.
Известно, что у человека, а также у животных лабораторного назначения характерно ускоренное сокращение лимфоидной составляющей в тимусе с возрастом. Полученные результаты указывают на то, что у животных, обитающих в природной среде, активность процессов, направленных на формирование иммунокомпетентных Т-лимфоцитов в тимусе, сохраняется на протяжении более длительного промежутка времени. Об этом свидетельствует повышенный процент лимфоидной ткани в тимусе, как у неполовозрелых, так и у половозрелых особей.
Минимальное снижение процентного содержания лимфоидного компонента в тимусе с возрастом у животных природных популяций свидетельствует о том, что условия природной среды, к которым данные виды организмов адаптировались на протяжении значительного срока, способствуют более длительному сохранению активности процессов, связанных с формированием Т-лимфоцитов в тимусе. Однако в условиях клеточного содержания (норка американская) функциональный дисбаланс, возникающий в рамках нейроиммунноэндокринной системы, приводит к более масштабному возрастному сокращению процентного содержания лимфоидной ткани в тимусе, что во многом связано с гормональными перестройками и запуском процессов жирового перерождения.
Возрастное снижение активности иммунитета сопровождается увеличением количества соединительной ткани в органах лимфоидной системы. Тимус не является исключением из этого правила. Однако полученные нами данные свидетельствуют о зависимости развития соединительной ткани от размеров органа и организма в целом. При этом обращает на себя внимание факт отсутствия влияния уровня организации на эту тканевую характеристику тимуса.
Таким образом, по мере совершенствования морфофункциональной организации позвоночных животных темпы становления центральных органов лимфоидной системы были не одинаковыми. Функциональная активность и стабильность работы красного костного мозга развивалась опережающими темпами, по сравнению с функциональной активностью эпителиальных клеток коры тимуса, обеспечивающих формирование зрелых Т-лимфоцитов. Возрастная инволюция тимуса, как глобальное явление, имеет место у всех позвоночных изученного ряда, и сопровождается сходными тенденциями изменения морфологии органа. Однако конкретные количественные характеристики тканевой перестройки тимуса отличаются в зависимости от особенностей биологии представителя, что отражается в особенностях гистологической структуры тимуса.
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
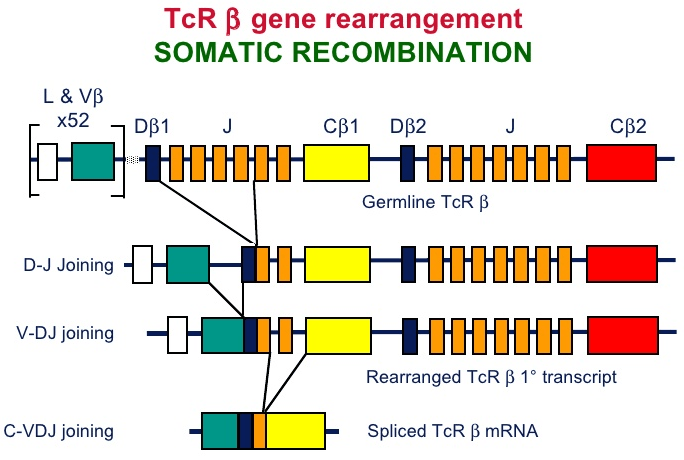
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.