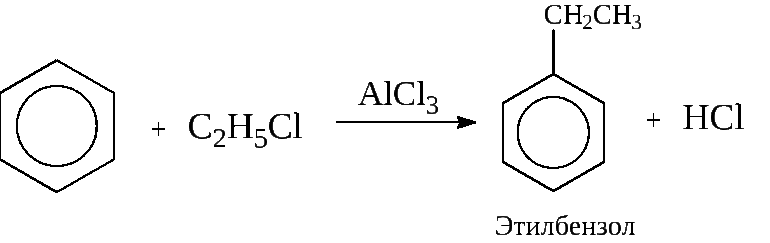толуол какой класс органических соединений
Толуол
Содержание
Общая характеристика [ ]
Химические свойства [ ]
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положения относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной.
Получение [ ]
Определение [ ]
Применение [ ]
Опасность и обращение [ ]
Пары могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушение вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит необходимо в резиновых перчатках в хорошо проветриваемом помещении.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам, (САНПИН, меры предосторожности при работе с летучими органическими растворителями) — Толуол (метилбензол) — является сильно токсичным ядом, влияющим на функцию кроветворения организма, также, как и его предшественник Бензол. Нарушение кроветворения проявляется в цианозе, гипоксии. Существует также толуольная токсикомания, которая имеет и канцерогенное влияние. В целом, бензольные углеводороды очень токсичны, длительное их воздействие может привести к необратимым поражениям ЦНС, кроветворных органов, и создать предпосылки для возникновения энцефалопатии.
ar:تولوين bs:Toluen ca:Toluè cs:Toluen de:Toluol en:Toluene eo:Tolueno es:Tolueno fa:تولوئن fi:Tolueeni fr:Toluène gl:Tolueno he:טולואן hr:Toluen hu:Toluol id:Toluena it:Toluene ja:トルエン ko:톨루엔 lmo:Toluen lt:Toluenas lv:Toluols mk:Толуен nl:Tolueen no:Toluen pl:Toluen pt:Tolueno ro:Toluen sk:Toluén sv:Toluen ta:தொலுயீன் tr:Toluen vi:Toluen zh:甲苯
Толуол
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Содержание
Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь.
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
C6H6 + CH3Br → FeBr3 C6H5CH3 + HBr
Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»).
Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646 являются галлюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея «Момент», заменив его ацетоном.
Ароматические УВ. Бензол
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:
Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:
Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование
2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование
4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:
Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):
II. Реакции присоединения
1.Гидрирование
2.Присоединение хлора
III. Реакции окисления
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1) переработка нефти и угля;
2) дегидрирование циклогексана:
3) дегидроциклизация (ароматизация) гексана:
В лаборатории:
Сплавление солей бензойной кислоты со щелочами:
Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.
Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:
а) галогенирование
При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:
б) нитрование
в) сульфирование
г) алкилирование
2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:
При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:
II. Реакции присоединения
Гидрирование
III.Реакции окисления
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:
Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:
3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Физиологические качества
Толуол (метилбензол) считается мутной эмульсией с резким запахом, показывает слабое наркотическое влияние, нерастворим в воде, превосходно открывается в базовых растворителях, воздействует на полимеры. Температура полного кипения — 110.60 гр. Содержит сладковатый аромат, напоминающий запах красок, лаков. Горючее вещество коптит сажей. Метилбензол менее токсичен, чем бензол.
Улетучивания толуола запросто создают взрывоопасную консистенцию, которая воспламеняется, довольно искры от электроэнергии, чтобы стартовало горение. У толуола есть химическая формула: C7H8. Её вполне вероятно образовать любым способом: C6H5 — CH3. При этом количество атомов остаётся прежним.
Структурная основа
Состав базового продукта, состоящего лишь только из атомов углерода и водорода, демонстрирует формулу толуола. Между ним и бензолом есть однотипность, которая состоит в кольце из 6 углеродных атомов при гибридизации. В гомологах отличие от составляющих одного и того же соответствующего ряда есть.
Любая из составляющих формирует 3 сигма-связи с примыкающими частичками (2 атома углерода и 1 водорода). Отвесно кольцу есть только 1 система из негибридных P-орбиталей (единственная из 6 углеродных атомов). В итоге вещество получает свои свойства от пройденного цикла.
Уплотнённость между углеродными атомами, компонентами ядра, распределена пропорционально. Наружный вид отражается в бензольной формуле. Ключевая формула в этом случае отражает главные структурированные особенности молекулы. Метильная категория обладает возможностью быть в любом из 6 атомов ядра, они эквивалентны друг другу.
Получение этилбензола
Существует несколько типов технологических моделей, используемых для производства. Установки для создания бензола, за некоторыми исключениями, служат одновременно для получения толуола и ксилола (который либо разделяется в виде чистого продукта, либо алюминия на бензол). Выбор метода производства является стратегическим решением, которое зависит от доступного сырья, стоимости и спроса на рынке.
Сырье, используемое для производства ароматических соединений, пиролитического газа и риформиата, является побочным продуктом процесса производства олефинов и бензина, это также смесь фракций, которые можно разделить способом, который индивидуально выбран под конкретный состав сырья.
Наиболее распространенным методом отделения бензола от других компонентов, образующих азеотропную смесь, является сложный метод физического разделения, включая дистилляцию и экстракцию растворителем. Используются азеотропная, экстракционная перегонка, жидкокристаллическая кристаллизация и адсорбция на цеолитах. Установки для производства ароматизаторов, как правило, расположены вблизи комплексов нефтеперерабатывающего отделения.
Реакция окисления
Атомы водорода в молекулах могут быть реакцией замещения, что практически подготавливает арены. Метилбензол больше реактивен, чем бензол. Общее вещество характеризуется окислением. Горение связано с выделением углекислого газа и воды. С толуолом и калием метильная молярная категория в передней цепочке молекулы окисляется вплоть до алкилирования карбоновой кислоты.
В итоге взаимодействия с формулой толуола химические свойства могут меняться. Бромирование, которое проводят с катализаторами, выходит на галогенированное вещество. Нитрование бромтолуола осуществляется консистенцией, складывающейся из фиксированной серной и азотной кислот. Нитрогруппа толуола имеет возможность откликаться на орто- и параположение. Реакция идёт сообразно электрофильному замещению. При высочайшей температуре элемент может реагировать и бывает обнаружен взрывчатый бензойный тринитротолуол (ТНТ), который несет опасность.
Внедрение толуола
Вещество имеет многочисленные коммерческие и промышленные применения и является растворителем в красках, лаках, разбавителях, клеях, корректирующей жидкости для снятия лака, а также используется в процессах печати и дубления кожи.
Толуол химического качества является весомым сырьём для органического синтеза, изготовления высокооктановых составляющих моторных топлив, приготовления взрывчатых веществ, медицинских препаратов, красителей и растворителей. Как ведомый компонент он входит в состав лаков. Толуол молекулярный обширно применяется в качестве начального вещества в органическом синтезе и гидрировании. Это значительный элемент при дегидрировании большого числа веществ.
Использование толуола:
Метилбензол действует как индустриальный класс растворителя, применяющийся в различной работе. Он видится предшественником части нефтепродуктов, оксибензола, метанола, пестицидов и иных сочетаний. Толуол больше нужен как растворитель и разбавитель для всех химикатов.
Он сокращает микровязкость покрытий, применяется для лаков и красок. Его сочетания могут вступать в реакцию при многих производствах. Растворители присваивают краске особенную густоту, уничтожают твёрдые вещества (сухой лак). Метилбензол растворяет полимер.
Используется вещество в базовом синтезе, парфюмерии и косметологии, военной промышленности, топливной, врачебной, лакокрасочной индустрии. Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен.
Структурная формула акцентирует представление о составе и текстуре. Есть информация о действии на организм человека. Было определено, что метилбензол токсичен и владеет канцерогенным воздействием. Улетучивания его быстро попадают на кожу, в органы дыхания, провоцируют изменения в нервной системе, недоброкачественность покрова, воспаление.
При вдыхании нефтяных паров у человека отмечается затормаживание, трепет, нарушается работа вестибулярного аппарата. При работе с толуолом, красками, растворителями надо всё делать в резиновых перчатках, хорошо проветривать здание. Метилбензол считается наркотическим веществом, вызывающим подневольность при злоупотреблении.
Иные побочные эффекты:
Значимость в применении
Толуол производится в больших количествах на нефтезаводах или же в качестве второстепенного продукта на коксохимических предприятиях и имеет различную плотность, массу. Он считается важным сырьём для крупномасштабного органического синтеза, применяемого в фармацевтической индустрии.
Метилбензол не опасается света и выпускается буквально во всех формах растворителей, что применяются при работе с красками. При работе с материалом сосредоточение его паров в атмосфере не должно превышать показателей, определённых санитарно-гигиеническими общепринятыми стандартами.
При работе с толуолом у открытого огня искру предотвратить нельзя, и это может послужить предпосылкой для взрыва. Нужно быть осторожными.
Вещество воздействует на экологию, и это связано с выбросом его в атмосферу:
Ядовитые качества толуола небезопасны для самочувствия человека, вследствие этого его надо использовать с предосторожностью.