у какого элемента больше всего изотопов
Рекорды в науке и технике. Элементы
В природе встречаются 94 химических элемента. К настоящему времени искусственно получены ещё 15 трансурановых элементов (элементы с 95-го по 109-ый), существование 10 из них бесспорно.
Самые распространенные
Литосфера. Кислород (O), 46,60% по весу. Открыт в 1771 г. Карлом Шееле (Швеция).
Атмосфера. Азот (N), 78,09% по объему, 75,52% по массе. Открыт в 1772 г. Резерфордом (Великобритания).
Вселенная. Водород (Н), 90% всего вещества. Открыт в 1776 г. Генри Кавендишем (Beликобритания).
Самый редкий (из 94)
Литосфера. Астат (At): 0,16 г в земной коре. Открыт в 1940 г. Корсоном (США) с сотрудниками. Встречающийся в природе изотоп астат 215 ( 215 Аt) (открыт в 1943 г. Б. Карликом и Т. Бернертом, Австрия) существует в количестве лишь 4,5 нанограмма.
Атмосфера. Радон (Rn): всего 2,4 кг (6·10 –20 объема одной части на 1 млн). Открыт в 1900 г. Дорном (Германия). Концентрация этого радиоактивного газа в районах залежей гранитных пород предположительно стала причиной ряда раковых заболеваний. Общая масса радона, находящегося в земной коре, из которой и пополняются атмосферные запасы газа, равна 160 т.
Самый легкий
Газ. Водород (Н) имеет плотность 0,00008989 г/см 3 при температуре 0°С и давлении в 1 атм. Открыт в 1776 г. Кавендишем (Великобритания).
Максимальная плотность
Самый тяжёлый газ
Им является радон (Rn), плотность которого 0,01005 г/см 3 при 0°С. Открыт в 1900 г. Дорном (Германия).
Последний из полученных
Элемент 108, или уннилоктий (Uno). Это предварительное название дано Международным союзом теоретической и прикладной химии (IUPAC). Получен в апреле 1984 г. Г. Мюнценбергом с сотрудниками (Западная Германия), которые наблюдали всего 3 атома этого элемента в лаборатории Общества по исследованию тяжёлых ионов в Дармштадте. В июне того же года появилось сообщение о том, что этот элемент был получен также Ю.Ц. Оганесяном с сотрудниками в Объединённом институте ядерных исследований, Дубна, СССР.
Единственный атом унниленния (Une) был получен в результате бомбардировки висмута ионами железа в лаборатории Общества по исследованию тяжёлых ионов, Дармштадт, Западная Германия, 29 августа 1982 г. У него самый большой порядковый номер (элемент 109) и самая большая атомная масса (266). По самым предварительным данным, советские ученые наблюдали образование изотопа элемента 110 с атомной массой 272 (предварительное название – унуннилий(Uun)).
Самый чистый
Гелий-4 ( 4 Не), полученный в апреле 1978 г. П.В. Маклинтоком из Ланкастерского университета, США, имеет менее 2 частей примесей на 10 15 частей объема.
Самый твёрдый
Углерод (С). В аллотропной форме алмаза имеет твёрдость по методу Кноопа – 8400. Известен с доисторических времен.
Самый дорогой
Калифорний (Сf) продавался в 1970 г. по цене 10 долл. за микрограмм. Открыт в 1950 г. Сиборгом (США) с сотрудниками.
Самый пластичный
Золото (Аu). Из 1 г можно вытянуть проволоку длиной 2,4 км. Известно с 3000 г. до н.э.
Самый высокий предел прочности на разрыв
Бор (В) – 5,7 ГПа. Открыт в 1808 г. Гей-Люссаком и Тенаром (Франция) и X. Дэви (Великобритания).
Точка плавления/кипения
Самая низкая. Среди неметаллов гелий-4 (4Не) имеет самую низкую точку плавления –272,375°С при давлении 24,985 атм и самую низкую точку кипения –268,928°С. Гелий открыт в 1868 г. Локьером (Великобритания) и Жансеном (Франция). Одноатомный водород (Н) должен быть несжижаемым сверхтекучим газом. Среди металлов соответствующие параметры у ртути (Hg): –38,836°С (точка плавления) и 356,661°С (точка кипения).
Самая высокая. Среди неметаллов самая высокая точка плавления и точка кипения у известного с доисторических времен углерода (С): 530°С и 3870°С. Однако представляется спорным, что графит стабилен при высоких температурах. Переходя при 3720°С из твёрдого в парообразное состояние, графит может быть получен как жидкость при давлении в 100 атм и температуре 4730°С. Среди металлов соответствующие параметры у вольфрама (W): 3420°С (точка плавления) и 5860°С (точка кипения). Открыт в 1783 г. Х.Х. и Ф. д’Элуярами (Испания).
Изотопы
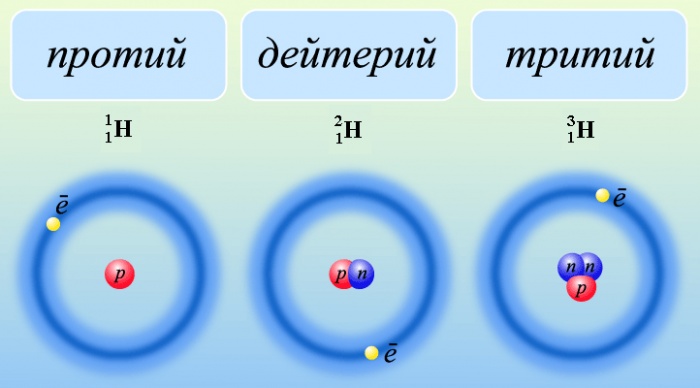
Наибольшее количество изотопов (по 36 у каждого) у ксенона (Xe), открыт в 1898 г. Рамзаем и Траверсом (Великобритания), и у цезия (Cs), открыт в 1860 г. Бунзеном и Кирхгофом (Германия). Наименьшее количество (3: протий, дейтерий и тритий) у водорода (Н), открыт в 1776 г. Кавендишем (Великобритания).
Самый стабильный. Теллур-128 ( 128 Те), по данным двойного бета-распада, имеет период полураспада 1,5·10 24 лет. Теллур (Те) открыт в 1782 г. Мюллером фон Райхенштайном (Австрия). Изотоп 128 Те впервые обнаружен в естественном состоянии в 1924 г. Ф. Астоном (Великобритания). Данные о его сверхстабильности были вновь подтверждены в 1968 г. исследованиями Е. Александера-младшего, Б. Шринивасана и О. Маньюэла (США). Рекорд альфа-распада принадлежит самарию-148 ( 148 Sm) – 8·10 15 лет. Рекорд бета-распада принадлежит изотопу кадмия 113 ( 113 Cd) – 9·10 15 лет. Оба изотопа были обнаружены в естественном состоянии Ф. Астоном, соответственно, в 1933 и в 1924 гг. Радиоактивность 148 Sm была открыта Т. Уилкинсом и А. Демпстером (США) в 1938 г., а радиоактивность 113 Cd в 1961 г. обнаружили Д. Уотт и Р. Гловер (Великобритания).
Самый нестабильный. Время жизни лития-5 ( 5 Li) ограничено 4,4·10 –22 с. Изотоп впервые обнаружен Е. Титтертоном (Австралия) и Т. Бринкли (Великобритания) в 1950 г.
Жидкостный ряд
Учитывая разницу между точкой плавления и точкой кипения, элементом с самым коротким жидкостным рядом является инертный газ неон (Ne) – всего навсего 2,542 градуса (от –248,594°С до –246,052°С), тогда как самый продолжительный жидкостный ряд (3453 градуса) характерен для радиоактивного трансуранового элемента нептуния (Np) (от 637°С до 4090°С). Однако если принять во внимание истинный ряд жидкостей – от точки плавления до критической точки, –то самый короткий период имеет элемент гелий (Не) – всего 5,195 градуса (от абсолютного нуля до –268,928°С), а самый продолжительный – 10200 градусов – для вольфрама (от 3420°С до 13 620°С).
Самое ядовитое
У какого элемента наибольшее число известных изотопов?
Свинец, стабильный, от него же всё пошло. а там по таблице Менделеева, всех не помню кроме Актиния и Урана.
Насколько помнится в истории фигурирует,что Гелл- Манн, раздумывая о названии гипотетической частицы, взял его из романа Джойса, где была фраза- три кварка для мистера Марка. Тем более что первоначально кварков и предполагал ось три.
Дело в том, что радиоактивный распад (спонтанный) происходит не зависимо от внешних условий..
Из всего объёма радиоактивного вещества нельзя сказать, какой атом распадётся..
Просто происходит туннельный эффект в масштабе ядра, который ограничен неопределённостью Гейзенберга (не совсем строго) dEdt=h..
Как только составляющие ядра (предположительно кварки) преодолеют некий барьер ядерные силы резко уменьшаются и под воздействием кулоновых сил части ядра разлетаются..
Есть только одно описание распада: статистическое, за сколько времени распадётся половина вещества и это называется ПЕРИОД ПОЛУРАСПАДА..
Изотопы.
Изотопы имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Для названий и символов изотопов обычно используют названия и символы соответствующих химических элементов.
Верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре.
Нижний индекс – порядковый номер элемента в периодической системе химических элементов.
Изотопы записываются так (например, изотопы калия):
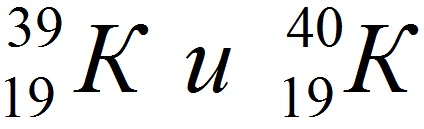
Водород имеет три изотопа:
Углерод имеет три изотопа с массой 12, 13, 14, кислород также имеет три изотопа с массой 16, 17, 18.
Изотопы, имеющие одинаковые массовые числа, но различные заряды ядер, называются изобарами.
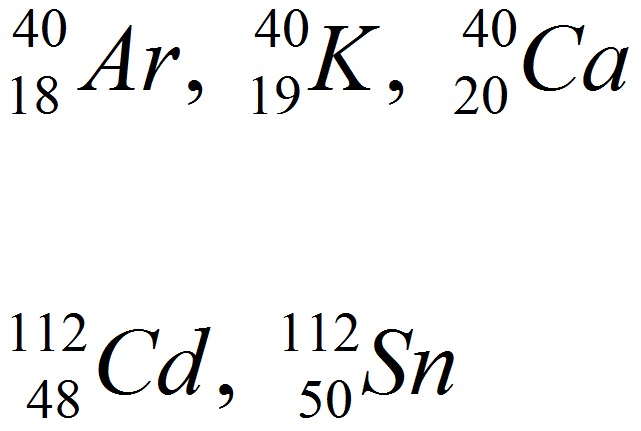
На данный момент науке известно около 280 стабильных и более 2000 радиоактивных изотопов у 116 природных и искусственно полученных химических элементов.
Радиоактивность (от лат. radio – излучаю, radius – луч и activus – действенный), самопроизвольное превращение неустойчивого изотопа химического элемента в другой изотоп (зачастую – изотоп другого элемента), сопровождаемое испусканием ядер элементарных частиц.
У какого элемента больше всего изотопов
Изотопы
Стабильные элементы представлены в природе примерно 280 изотопами. Однако некоторые из них оказались в слабой степени радиоактивными, с огромными периодами полураспада (например, 40 К, 87 Rb, 138 La, 147 Sm, 176 Lu, 187 Re). Продолжительность жизни этих изотопов столь велика, что позволяет рассматривать их как стабильные.
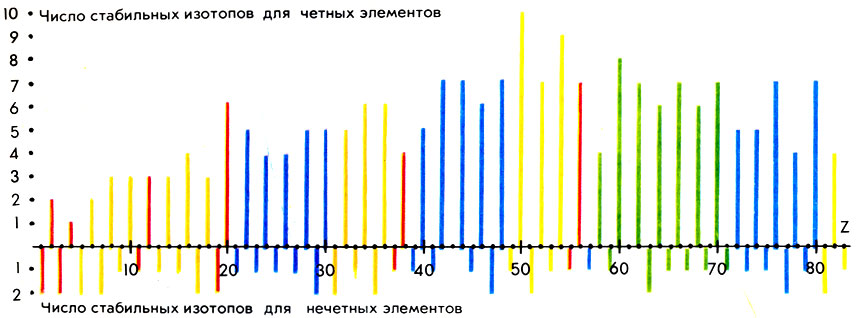
В мире стабильных изотопов пока немало загадок. Так, неясно, почему их количество у разных элементов так сильно различается. Около 25% стабильных элементов (Be, F, Na, Al, Р, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tu, Та, Au) представлены в природе лишь одним видом атомов. Это так называемые элементы-одиночки. Интересно, что все они (кроме Be) имеют нечетные значения Z. И вообще для нечетных элементов число стабильных изотопов не превышает двух. Напротив, некоторые элементы с четными Z состоят из большого числа изотопов (например, Хе имеет 9, Sn-10 стабильных изотопов). Строгого научного объяснения этих фактов до сих пор не существует.
Совокупность стабильных изотопов у данного элемента называют плеядой. Содержание их в плеяде нередко сильно колеблется. Интересно отметить, что больше всего изотопов с величинами массовых чисел, кратных четырем ( 12 С, 16 О, 20 Са и т. д.), хотя есть и исключения из этого правила.
Числа стабильных изотопов для четных и нечетных элементов
У какого элемента больше всего изотопов
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Добавить в закладки
Вы сможете увидеть эту публикацию в личном кабинете
Подпишитесь на нашу рассылку и получайте новости о последних проектах, мероприятиях и материалах ПостНауки