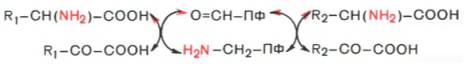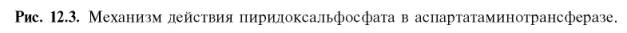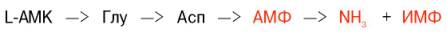В чем заключается биологическая значимость трансаминирования
Биологическое значение трансаминирования
Диагностическое значение определения аминотрансфераз в клинической практике
В клинической практике широко используют определение активности АСТ и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
Реакции окислительного и неокислительного дезаминирования.
Существует несколько способов дезаминирования аминокислот:
Окислительное дезаминирование
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает ФМН (FMN). Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Биологическое значение трансаминирования



Трансаминирование – первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза заменимых аминокислот из соответствующих кетокислот, если они необходимы в данный момент клеткам. В результате происходит перераспределение аминнного азота в тканях. При трансаминированиии общее количество аминокислот в клетке не меняется.
Оксидазы D-аминокислот. При физиологических значениях рН в тканях высоко активны оксидазы D-аминокислот. Они также обнаружены в почках и печени и находятся в микросомах. Роль оксидаз D-аминокислот невелика и до конца не понятна, потому что в белки пищи и тканей человека входят только природные L-аминокислоты.
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования серина, треонина, цистеина и гистидина неокислительным путем.
Дезаминирование аминокислот
Дезаминирование аминокислот – реакция отщепления a-аминогруппы от аминокислоты с выделением аммиака. Различают два типа реакций дезаминирования: прямое и непрямое.
Прямое дезаминирование – непосредственное отщепление аминогруппы от аминокислоты без промежуточных посредников. В живой природе возможны следующие типы прямого дезаминирования: окислительное, восстановительное, гидролитическое и путем внутримолекулярной перестройки. Но у человека дезаминирование происходит преимущественно окислительным путем в результате чего образуется соответствующая a-кетокислота и выделяется аммиак. Процесс идет с участием ферментов оксидаз. Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
Трансаминирование аминокислот
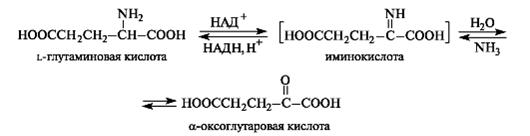
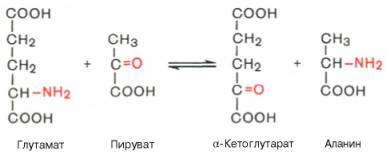
Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Впервые реакции трансаминиро-вания (прежнее название «переаминирование») были открыты в 1937 г. советскими учеными А.Е. Браунштейном и М.Г. Крицман при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Было замечено, что при добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного свободного аммиака; добавление аланина и α-кетоглутаровой кислоты приводило к образованию соответственно пировиноградной и глутаминовой кислот.
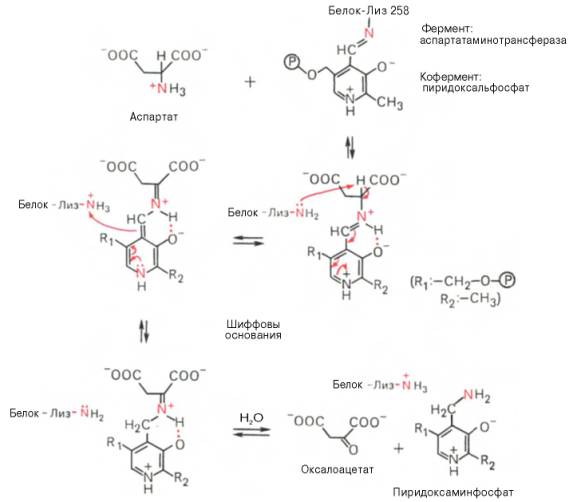
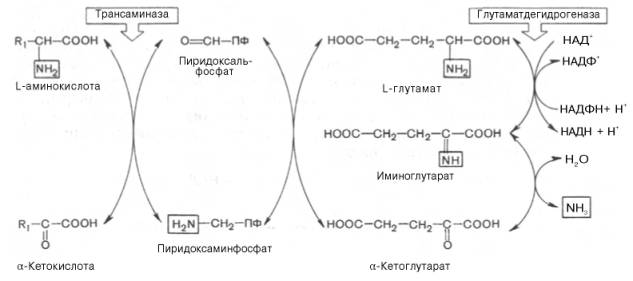
В переносе аминогруппы активное участие принимает кофермент транс-аминаз пиридоксальфосфат (производное витамина В6; см. главу 5), который в процессе реакции обратимо превращается в пиридоксаминфосфат.
Более подробно механизм действия трансаминаз представлен на рис. 12.3.
В связи с тем что во всех пиридоксалевых ферментах (включая транс-аминазы) карбонильная группа кофермента (—СНО) оказалась связанной с ε-аминогруппой лизина белковой части, в классический механизм реакции трансаминирования А.Е. Браунштейн и Э. Снелл внесли следующее дополнение. Оказалось, что взаимодействие между субстратом, т.е. L-амино-кислотой (на рисунке – аспартат), и пиридоксальфосфатом происходит не путем конденсации с выделением молекулы воды, а путем реакции замещения, при которой NH2-группа субстрата вытесняет ε-NН2-группу лизина в молекуле ферментного белка, что приводит к формированию пиридоксальфосфатного комплекса.
Существование представленного механизма реакции трансаминирова-ния доказано разнообразными методами, включая методы спектрального анализа по идентификации промежуточных альдиминных и кетиминных производных пиридоксальфосфата.
Роль трансаминаз и реакций трансаминирования в обмене аминокислот.
Суммарная реакция при этом следующая:
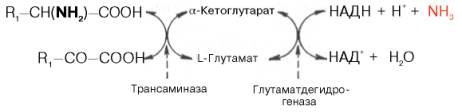
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организм животных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот), так называемых незаменимых аминокислот; этой способностью обладают только растения и многие микроорганизмы.
Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровой кислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака. Роль реакций трансаминирования как в дезаминировании, так и в биосинтезе аминокислот может быть представлена в виде схемы:
Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот (черные стрелки) и биосинтез аминокислот (красные стрелки). В более упрощенной форме роль этих ключевых ферментов азотистого обмена представлена на рис. 12.4.
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезами-нирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическое дезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
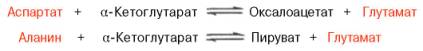
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза (AcAT) и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
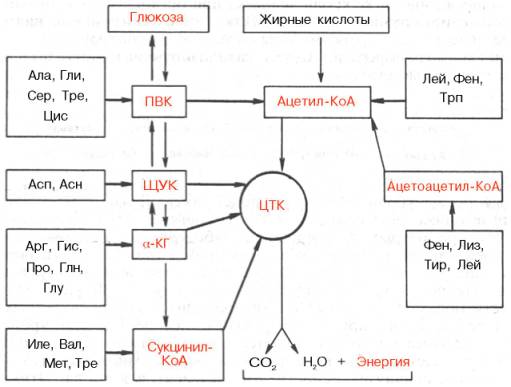
Превращения α-кетокислот. Образовавшиеся в процессе дезаминиро-вания и трансдезаминирования α-кетокислоты подвергаются в тканях животных различным превращениям и могут вновь трансаминироваться с образованием соответствующей аминокислоты. Это так называемый синтетический путь превращения. Опыты с перфузией растворов α-кето-кислот и аммиака через изолированную печень показали, что в оттекающей из печени жидкости действительно имеются соответствующие исходным кетокислотам L-аминокислоты. Открыты, кроме того, гликогенные, кето-генные и окислительные пути, ведущие к образованию соответственно глюкозы, жирных кислот, кетоновых тел и компонентов цикла трикарбоновых кислот (ЦТК). Эти процессы можно представить в виде общей сводной схемы:
Углеродные скелеты аминокислот могут включаться в ЦТК через ацетил-КоА, пируват, оксалоацетат, α-кетоглутарат и сукцинил-КоА. Пять аминокислот (Фен, Лиз, Лей, Трп, Тир) считаются «кетогенными», поскольку они являются предшественниками кетоновых тел, в частности ацетоуксусной кислоты, в то время как большинство других аминокислот, обозначаемых как «гликогенные», служат в организме источником углеводов, в частности глюкозы. Подобный синтез углеводов de novo усиливается при некоторых патологических состояниях, например при сахарном диабете, а также при гиперфункции коркового вещества надпочечников и введении глюкокортикоидов (см. главу 8). Разделение аминокислот на «кетогенные» и «гликогенные» носит, однако, условный характер, поскольку отдельные участки углеродных атомов Лиз, Трп, Фен и Тир могут включаться и в молекулы предшественников глюкозы, например Фен и Тир – в фумарат. Истинно «кетогенной» аминокислотой является только лейцин.
Биологическая роль трансаминирования.



Трансаминирование играет огромную роль в оптимизации смеси аминокислот, поступающих из кишечника во внутреннюю среду организма. Природные белки при расщеплении в кишечнике дают смесь аминокислот в которых соотношение отдельных аминокислот может быть очень далеким от потребности наших клеток.
В организме синтезируются ряд кетокислот которые в результате трансаминирования могут превращаться в заменимые аминокислоты За счет этого синтеза и происходит оптимизация смеси аминокислот. При трансаминировании происходит перераспределение аминного азота поступающего из кишечника, кроме того трансаминирование входит в качестве одного из этапов в более сложные процессы превращения аминокислот: трансдезаминирование и трансреаминирования.
Активность в миокарде в печени очень высокая и при поражении этих тканей ферменты выходят в кровь. Поэтому повышение активности трансаминаз в крови свидетельствует о поражении той или иной ткани какого-либо органа. Например при инфаркте миокарда активность асат (аспартатаминотрансферазы) увеличивается уже через 3-5 часов, при благоприятном течении заболевания активность через 3-4 дня возвращается к исходному уровню. При болезни Боткина в крови резко увеличивается активность второй трансаминазы алат (аланинаминотрансферазы), нормализация этого показателя используется для контроля за эффективностью проводимой терапии.
Обмен простых белков и аминокислот лекция №2.
1 В виде прямого дезаминирования
2 В виде непрямого дезаминирования (трансдезаминирование).
Прямое дезаминирование аминокислот в свою очередь на разных уровнях организации живых объектов встречается в 4 основных вариантах:
а) окислительное дезаминирование
б) внутримолекулярное дезаминирование
в) гидролитическое дезаминирование
г) восстановительное дезаминирование
В клетках человека работают только 2 из перечисленных: окислительное и внутримолекулярное дезаминирование.
Прямое окислительное дезаминирование аминокислот:
При прямом окислительном дезаминирование аминокислот образуются a-кетокислоты и аммиак.
Процесс идет в 2 этапа.
На первом этапе при участии фермента оксидазы от аминокислоты отщепляется 2 атома водорода и аминокислота превращается в иминокислоту.
На втором этапе образованная иминокислота спонтанно присоединяет воду без участия фермента с образованием кетокислоты и аммиака.
Дегидрирование, происходящее на первом этапе сопровождается переносом водорода на ФАД или ФМН т.е. на простетические группы ферментов оксидаз т.е. вначале образуется восстановленный ФАД или ФМН и эти же восстановленные формы переносят затем водород на кислород (аэробные дегидрогиназы) и образуется токсическая перекись водорода.
В организме человека присутствует оксидаза L-аминокислот в качестве кофермента ФМН. Эта оксидаза обладает низкой активностью, в то же время в тканях обнаружена оксидаза D-аминокислот, в качестве кофермента она содержит ФАД. Считают, что оксидаза D-аминокислот обеспечивает превращение D-аминокислот, которые образуются в кишечнике.
Образуется иминокислота, водород переноситься на ФМН и этот кофермент переносит водород на кислород с образованием перекиси водорода. Перекись водорода немедленно разрушается каталазой.
Иминокислота спонтанно присоединяет воду с образованием кетокислоты и отщеплением иминогруппы в виде аммиака. Принято считать, что прямое дезаминирование аминокислот L ряда не вносит существенного вклада в метаболизм этих соединений у человека. В то же время практически во всех тканях организма человека обнаружена высоко активная дегидрогиназа L-глютаминовой кислоты.
Наибольшая активность этого фермента обнаружена в почках и печени. Этот фермент обладает высокой специфичностью и катализирует прямое окислительное дезаминирование L-глютамата по схеме.
В качестве кофермента дегидрогназа содержит НАД.
На первом этапе водород с участием фермента переноситься на НАД с образованием восстановленного НАД, окисление которого несомненно сопровождается с образованием 3 молекул АТФ. Образуется имниоглютамат. Далее спонтанное присоединение воды обеспечивает образование 2-оксоглютарата (a-кетоглютаровая кислота) и отщепляется аммиак.
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ
1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты.
Эта функция позволяет ругулировать содержание различных аминокислот в клетках организма (корректировка аминокислотного состава клеток).
Для большинства реакций трансаминирования эта константа равновесия близка к единице.
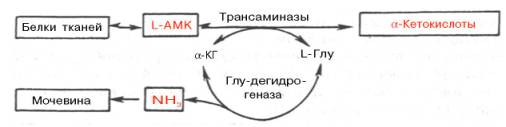
Оксидазы аминокислот в клетках организма человека имеют очень низкую активность. Поэтому прямое окислительное дезаминирование аминокислот почти не протекает. Исключением является никотинамидный фермент глутаматдегидрогеназа, который легко дезаминирует глутаминовую кислоту, расщепляя ее до NH3 и альфа-кетоглутарата. Альфа-кетоглутарат может легко вступать в реакции трансаминирования с другими аминокислотами, превращаясь обратно в глутаминовую кислоту.
Значит, если аминокислота не может дезаминироваться прямо, то она может дезаминироваться косвенно с участием пары «альфа-кетоглутарат/глутамат».
Некоторые аминокислоты не имеют «своей собственной» трансаминазы, которая могла бы перенести их аминогруппу на альфа-кетоглутарат (лизин, треонин, пролин, оксипролин), но для этих аминокислот есть специальные реакции, в результате которых аминогруппа этих аминокислот оказывается в составе глутаминовой кислоты.
Таким образом, глутаминовая кислота работает в паре с альфа-кетоглутаровой: альфа-кетоглутарат принимает у разных аминокислот азот в форме аминогруппы, превращаясь в глутамат; глутамат легко дезаминируется прямым путем высокоактивной глутаматдегидрогеназой с образованием аммиака.
Общий итог косвенного дезаминирования такой же, как и результат прямого окислительного дезаминирования.
Это вариант дезаминирования, который протекает в две стадии: