В чем заключается коррозия металлов
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
Различают химическую и электрохимическую коррозию.
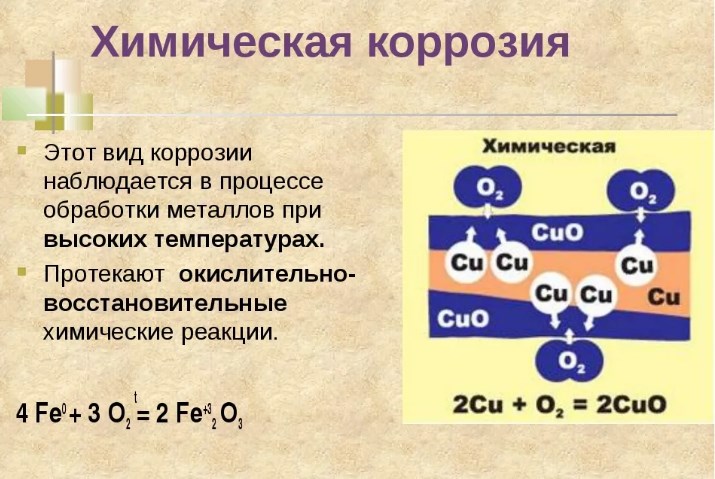
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
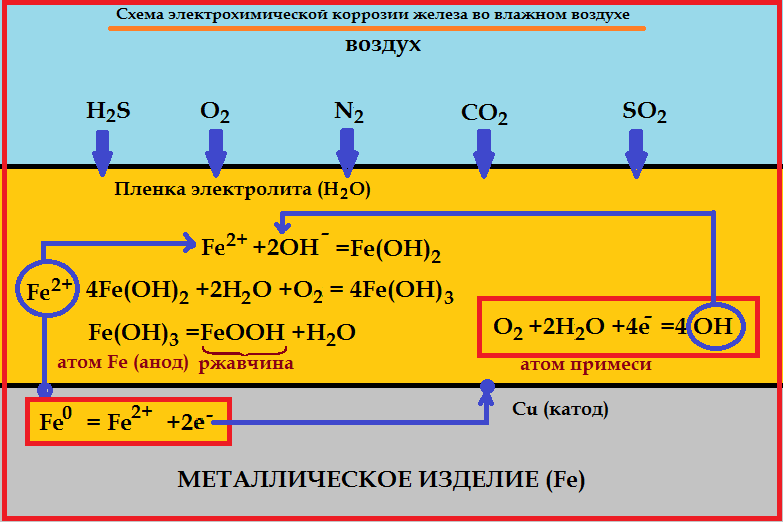
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
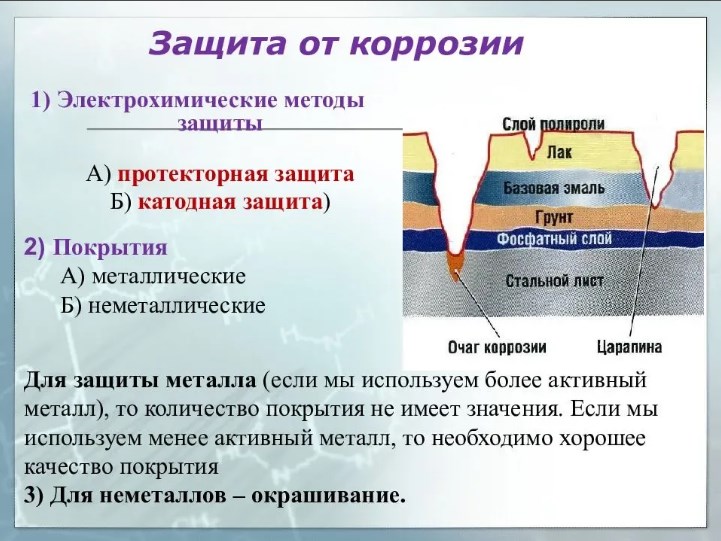
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Х
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
Fe(OH)3= t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н + – в кислой среде.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Основы теории коррозии металлов и способы защиты от нее
Коррозия (от позднелатинского corrōsiōn «грызть, жевать») представляет собой постепенно развивающийся процесс поверхностного повреждения металлов, обладающих способностью активно реагировать с кислородом. Один из наглядных примеров этого явления – коррозия металла из-за образования оксида железа Fe2O3 или ржавчины.
Теория коррозии предполагает, что для начала разрушения металла необходимо наличие четырёх основных компонентов:
Электрического соединения, которое существует между катодом и анодом.
Электролита или любой другой токопроводящей среды, облегчающей направленное перемещение ионов.
Обычное образование ржавчины на стали можно рассматривать как электрическую батарейку. Когда атомы металлов подвергаются воздействию окружающей среды, которая содержит кислород, металл производит электроны. Это действие можно локально ограничить, чтобы создать трещину или микроуглубление. С развитием процесса коррозия распространяется на прилегающую территорию, что приведет к общему ухудшению состояния поверхности. Ограниченная (точечная) коррозия способна вызвать усталость металла – снижение его прочностных характеристик, а имеющиеся коррозионные агенты, например, морская вода, могут привести к прогрессирующему росту трещины.
Теория коррозии утверждает также, что интенсификации поверхностного разрушения металла способствуют микроструктурные изменения, возникающие при повышенных температурах, в частности, при сварке. Это объясняется повышенными значениями энергии активации, из-за чего количество ионов, проводящих электрический ток, лавинообразно возрастает.
Определение коррозии
Суть коррозионного процесса – наличие постоянно действующей анодной реакции. Она вызывается за счёт растворения металла, который генерирует электроны. Часть энергии активации дополнительно расходуется на другой процесс, называемый катодной реакцией. Эти два процесса уравновешивают произведенные заряды. Зоны, вызывающие эти процессы, могут быть расположены близко или далеко друг от друга, в зависимости от ситуации.
Электроны, генерируемые в процессе, должны потребляться посредством катодной реакции. Ионы водорода и электроны вступают в реакцию с образованием атомарного, а затем и газообразного водорода. Однако водород является сильнейшим восстановителем, поэтому дальнейшую коррозию можно предотвратить, создав на поверхности металла тонкую газовую плёнку. Она служит поляризатором, уменьшающим контакт металла с водой и уменьшающим коррозию. Таким образом, всё, что разрушает барьерную плёнку, увеличивает скорость коррозии.
Основными факторами, определяющими интенсивность процесса, являются:
Уровень возникающих механических и термических напряжений;
Характер протекающих химических реакций.
Коррозия сдерживает внедрение в производство новых металлических материалов и причиняет значительный ущерб экономике.
Виды коррозии металлов
Классификация всех коррозионных явлений может быть произведена по следующим параметрам:
По степени равномерности. Различают поверхностную коррозию, которая равномерно уменьшает толщину поверхности, и неравномерную коррозию – точечную или язвенную;
По интенсивности воздействия на металл. Например, избирательная коррозия разрушает только определённые структурные составляющие, а контактная воздействует на менее коррозионно стойкие («неблагородные») составляющие пар трения;
При межкристаллитной коррозии разрушение происходит по границам зёрен и распространяется вглубь металла.
Фреттинг-коррозия, когда два контактирующих между собой тела совершают относительно друг друга колебательные движения малой амплитуды (не более 100 мкм).
При одновременном воздействии растягивающих напряжений и агрессивной среды наблюдается коррозионное растрескивание межкристаллитного или транскристаллитного характера, а при наложении знакопеременных напряжений начинается коррозионно-усталостное разрушение. Защита металлов от коррозии, таким образом, предполагает также и одновременное уменьшение износа деталей.
Далее рассматриваются основные явления, которые происходят в повреждающихся зонах при различных видах коррозии.
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3, эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Электрохимическая
Для моделирования процесса необходимо рассмотреть железную пластину, покрытую любым электропроводящим покрытием, например, оксидной окалиной, которая образовалась во время высокотемпературной обработки. При погружении пластины в раствор хлорида натрия, обнаруживается, что, если повредить целостность окалины, в этом месте ржавление железа пойдёт значительно быстрее. Электрохимическая коррозия наиболее достоверно объясняет ржавление железа в аэробных условиях.
Теория электрохимической коррозии предполагает наличие дополнительных химических реакций:
Когда ионы металла растворяются, их заряд уравновешивается ионами хлорида, которые мигрируют в область атаки, притягиваясь образующимися ионами положительного заряда. Хлорид железа растворяется в воде, но это не создаёт препятствий для дальнейшей коррозии, поскольку раствор хлорида железа вследствие гидролиза очень кислый. По мере того, как ионы Fe ++ удаляются из этого места, они сталкиваются с гидроксильными ионами, которые либо присутствуют в воде естественным образом, либо образуются в результате катодной реакции. Результатом является образование и осаждение гидроксида железа Fe (OH)2. Далее, в присутствии растворённого кислорода, он быстро окисляется до оксигидроксида железа FeOOH.
Таким образом, при электрохимической коррозии происходят три реакции, причём в трёх разных местах. Анодная происходит в зонах потери металла, катодная – там, где растворённый в воде кислород может принимать электроны, а сама твёрдая окалина формируется в местах механических повреждений на поверхности изделия.
В последнее время выделяют ещё один вид коррозии – механохимическую, которая происходит в результате динамического взаимодействия контактирующих элементов окружающей среды в условиях высоких контактных давлений.
Методы защиты от коррозии
Ржавчина и другие коррозионные проявления могут приводить к проблемам с безопасностью, нарушать целостность производственного оборудования и расходных материалов. Даже плановое техническое обслуживание по удалению и устранению ржавчины увеличивает эксплуатационные затрат. Отработано ряд способов, используя которые, можно минимизировать коррозию.
Металлические покрытия
Эти методы предотвращения коррозии заключаются в погружении стали в расплав металла, электрический потенциал которого меньше, чем железа (чем больше разница, тем эффективнее покрытие).
Практическое применение находят гальванические покрытия цинком или оловом, а также диффузионные покрытия никелем, хромом, кремнием или алюминием. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
Поскольку расход металла-протектора довольно велик, преимущество получают технологии, отличающиеся экономичностью используемых компонентов и прочностью создаваемых покрытий. Первым в этом списке находится цинкование. Железо в стали вступает в реакцию с цинком, образуя прочное покрытие из сплава, которое служит защитой.
Неметаллические покрытия
Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, который исходит от коррозионно опасных соединений. Обычно используют комбинацию различных слоёв краски, которые выполняют разные функции. Грунтовка действует как ингибитор, промежуточный слой увеличивает общую толщину краски, а финишный слой обеспечивает устойчивость к факторам окружающей среды.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты. Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента. После окончания штамповки покрытие удаляют.
Изменение состава технического металла и коррозионной среды
Заключается в специальном легировании стали элементами, повышающими её коррозионную стойкость. Если это возможно, то в механическую систему, которая работает в условиях повышенной температуры и влажности, вводят смазку, содержащую противокоррозионные компоненты (восстановители).
Элементом, который положительно влияет на коррозионную стойкость стали, является хром. Для реализации этого эффекта сталь должна содержать не менее 13% хрома. Каждые дополнительные 5% хрома обеспечивают еще лучшую коррозионную стойкость.
Электрохимическая защита
Катодная защита очень эффективна в бытовой технике, однако аноды необходимо часто проверять, что увеличивает расходы на техническое обслуживание.
Коррозия металлов. Виды коррозии металлов
Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов