В чем заключается механизм действия катализатора
Катализ и катализаторы
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
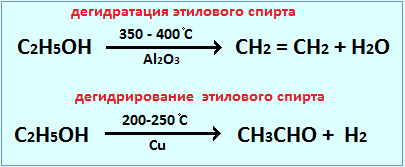
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
В чем заключается механизм действия катализатора
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
Рис. 9-12. В присутствии катализатора Al2O3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.
Как же работают катализаторы? Ответ на этот вопрос известен далеко не всегда. Однако в ряде случаев каталитические превращения изучены хорошо и химикам понятен механизм этих реакций. Термин «механизм реакции» раньше нам не встречался, поэтому необходимо объяснить его значение. Выяснение механизма реакции – это установление строения короткоживущих промежуточных частиц, возникающих на пути от реагентов к продуктам реакции. Такие неустойчивые промежуточные вещества часто невозможно выделить, но они могут быть изучены косвенными методами. Именно от строения и устойчивости (или неустойчивости) промежуточных частиц зависит скорость любой реакции и выбор того или иного её направления.
Например, использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 о С. Это говорит о еще более значительном снижении энергии активации и ускорении реакции:
Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н + (первая строчка в приведенной ниже схеме):
Разрыв связи С-О в этаноле происходит с образованием двух частиц, из которых неустойчива только одна (карбокатион), а вторая (Н2О), напротив, очень устойчива. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 23 Мб).
** Эта реакция называется реакцией дегидрирования (отщепления водорода). Она такая же эндотермическая, как и реакция дегидратации (отщепления воды). Однако при каталитическом дегидрировании, по сравнению с реакцией без катализатора, возникает новый, весьма важный фактор: выделяющийся в реакции водород тут же окисляется на меди кислородом воздуха с выделением большого количества теплоты. Это приводит к тому, что суммарный тепловой эффект всей последовательности реакций оказывается экзотермическим. Избыточной теплоты выделяется так много, что медная спираль (катализатор) в ходе реакции раскаляется.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 16 Мб).
Если механизмы многих гомогенных каталитических реакций с участием кислот (кислотный катализ) или оснований (основной катализ) хорошо изучены, то о гетерогенном катализе этого сказать нельзя. Однако некоторые его закономерности все же известны.
Во-первых, в гетерогенном катализе большую роль играет адсорбция, то есть концентрирование веществ на поверхности раздела между ними. Например, адсорбция молекул газа происходит на поверхности твердого пористого катализатора. Благодаря адсорбции на поверхности катализатора растет концентрация реагирующих частиц, что уже само по себе может приводить к ускорению реакции. Поэтому важным фактором в гетерогенном катализе является площадь поверхности катализатора, его пористость. Чем больше поверхность, тем выше каталитическая активность твердого катализатора. Количество взятого катализатора тоже влияет на скорость реакции.
В этих реакциях образуются цис-алкены. Геометрическое строение продуктов реакции позволяет предположить, что молекула водорода присоединяется к алкину с поверхности катализатора. Если бы это было не так, то образовывался бы более устойчивый транс-алкен:
Еще одна особенность гетерогенного катализа заключается в том, что около поверхности работающего катализатора всегда концентрируются как исходные вещества, так и продукты реакции. Если продукты адсорбируются на катализаторе слишком прочно, то они плохо вытесняются с поверхности и катализатор постепенно теряет активность. В этом случае говорят, что катализатор отравляется продуктами реакции. Однако во многих случаях каталитическими ядами являются даже не продукты реакции, а различные примеси в исходных веществах. Например, для платиновых катализаторов такими каталитическими ядами являются примеси HCN, H2S, соединений As, Se, Te.
Наибольшее применение гетерогенный катализ находит в промышленном производстве органических веществ. Однако не менее необходим он и при получении таких важных неорганических продуктов, как аммиак NH3 и оксид серы SO3 (последний нужен для производства серной кислоты).
В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al2O3 и K2O. Эти оксиды служат промоторами.
В производстве серной кислоты для получения SO3 раньше в качестве катализатора использовали металлическую платину. На современных сернокислотных заводах работают значительно более дешевые ванадиевые катализаторы (V2O5) с добавками SiO2 и K2О.
В более короткой форме реакцию получения полиэтилена можно выразить уравнением:
Индекс n в формуле полимера называется степенью полимеризации (значение n может достигать десятков тысяч). В результате происходящей сшивки молекул этилена образуются длинные макромолекулы полиэтилена с молекулярной массой от 30000 до 800000 в зависимости от условий реакции. На конце каждой такой гигантской молекулы имеется «пришитый» к ней инициатор, однако его содержание в общей массе полиэтилена ничтожно мало.
В одном параграфе невозможно рассмотреть все многообразие каталитических реакций, известных в неорганической и органической химии, в биохимии (ферментативный катализ), в технике (автомобильные катализаторы дожигания выхлопных газов) и т.д. Здесь мы ставили задачу разобраться лишь в некоторых ключевых вопросах, а именно:
Рекомендуем читателю еще раз вернуться к этим вопросам и ответить на них самостоятельно для закрепления пройденного материала.
Скорость химических реакций. Действие катализаторов.
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Если при постоянных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за определенный промежуток времени от t1 до t2, то скорость химической реакции равна:
где k — коэффициент, не зависящий от концентрации, называется константой скорости реакции,
vA и vB – постоянные числа – показатели порядка скорости реакции по реагентам А и В.
Следует отметить, что показатели порядка скорости реакции vA и vB о реагентам никогда не равны стехиометрическим коэффициентам a и b (исключение может быть только в одном случае – если реакция представляет собой элементарный акт).
Для сложных реакций показатели порядка реакции не равны стехиометрическим коэффициентам и определяются только экспериментально.
Такая зависимость справедлива для газов и жидкостей (гомогенные системы). Для гетерогенной реакции (с участием твердых веществ) скорость реакции зависит еще и от величины поверхности соприкосновения между реагирующими веществами. Любое увеличение площади поверхности приводит к увеличению скорости реакции.
Влияние катализаторов на скорость химической реакции.
Механизм действия катализаторов (упрощенный).
В ходе катализируемой химической реакции происходит образование промежуточных продуктов (образование связи между катализатором и реагирующим веществом).
Реакция без катализатора идет очень медленно, а при добавлении катализатора К, о реагирует с одним из исходных веществ (например, с А), образуя очень непрочное и реакционноспособное промежуточное соединение АК:
Это промежуточное соединение реагирует с другим исходным веществом В, образуя конечный продукт АВ и катализатор выходит в первоначальном виде:
Катализатор может участвовать в реакции бесконечное число раз. Но следует учесть, что в реакциях могут присутствовать соединения, понижающие активность катализатора. Такие вещества называется каталитическими ядами, а сам процесс – отравлением.
Гомогенный катализ.
Гетерогенный катализ.
При гетерогенном катализе происходит адсорбция реагирующих веществ поверхностью катализатора (она неоднородна, и здесь расположены активные центры, под действием которых связь между атомами реагентов ослабляется, молекула деформируется, а иногда даже распадается).
Для катализатора характерна избирательность действия (определенный катализатор для определенной реакции). Подбор оптимальных катализаторов является насущной проблемой многих производств: переработка газов, крекинг углеводородов, нефтяная промышленность, получение полимеров, каучука и т. д.
В живой природе катализаторы также играют большую роль, только называются они ферментами.
Катализатор
Определение катализатора, механизм действия катализатора
Определение катализатора, механизм действия катализатора, применение катализатора
Содержание
Содержание
1. Катализаторы в химии
— Механизм действия катализаторов
— Требования, предъявляемые к катализаторам
2. Катализаторы в автомобилях
— Выбросы загрязняющих веществ
— Как катализаторы сокращают вредные выбросы в выхлопных газах
— Контроль загрязнения и повышение эффективности выхлопной системы
— Экономия топлива и катализаторы горения
Катализатор — это вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на товар и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется.
Катализаторы в химии
Виды катализаторов
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO.
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, никель). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный товар.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции (Имянитов, Temkin). Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Каталитическое воздействие может быть оказано на большинство химических реакций. Число катализаторов очень велико, а их каталитическая активность весьма различна. Она определяется изменением скорости реакции, вызываемым катализатором.
Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
При этом образуется активированный комплекс с более низким уровнем энергии и скорость реакции сильно возрастает.
Механизм действия катализаторов
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается:
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение быстро протекающей реакции:
Эта реакция протекает медленно. Но при введении катализатора образуется промежуточное соединение:
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах, в результате чего увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. И в этом случае реакция ускоряется благодаря снижению энергии активации (в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора. Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути, свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы. В производственных условиях реагирующие вещества подвергают очистке от каталитических ядов, а уже отравленные катализаторы регенерируют.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому, применяя разные катализаторы, можно получить из одного и того же вещества разные продукты. Так, например, в присутствии катализатора оксида алюминия Аl2О3 при 300° С из эт лового спирта получают воду и этилен:
Скорость протекания химической реакции можно значительно увеличить, если добавить вещество, которое участвует в этой реакции, но при этом само не расходуется. Чтобы лучше это понять, представим себе работу брокера по операциям с недвижимостью. Брокер находит и собирает вместе людей, желающих продать какое-либо имущество, и людей, желающих его купить, таким образом способствуя его продаже и передаче другому владельцу. При этом сам брокер в ходе договора ничего реально не покупает и не продает. Так же и катализатор, или фермент, способствует протеканию реакции между двумя веществами, но к концу реакции остается в первоначальном виде.
Пожалуй, самый известный катализатор находится у нас в машине, в каталитическом нейтрализаторе отработавших газов. Он представляет собой мелкоячеистую металлическую сетку, сделанную из палладия и платины, через которую пропускаются выхлопы из автомобильного двигателя. Эти металлы катализируют ряд химических взаимодействий. Во-первых, они абсорбируют окись углерода (CO), окись азота (NO) и кислород, причем каждая молекула NO распадается на составляющие ее атомы. CO соединяется с атомом кислорода, образуя диоксид углерода, а атомы азота соединяются, и получаются молекулы азота. В то же время избыток кислорода дает возможность углеводородам, не до конца сгоревшим в автомобильных цилиндрах, полностью окислиться до диоксида углерода и воды. Вот так выхлопные газы, которые содержат окись углерода (смертельный яд) и вещества, приводящие к кислотным дождям, а также несгоревшие фрагменты исходных молекул бензина, превращаются в относительно безвредную смесь диоксида углерода, азота и воды.
Чтобы понять действие ферментов, необходимо знать, что для взаимодействия сложных органических молекул недостаточно их простого контакта. Чтобы реакция протекала, определенные атомы в сближающихся молекулах должны быть правильно сориентированы друг относительно друга (так же как ключ определенным образом должен быть вставлен в замок), только тогда смогут образоваться химические связи. То есть для химических процессов, протекающих в биологических системах (см. Биологические молекулы), чрезвычайно важную роль играет пространственная геометрия.
В биохимии крайне мала вероятность того, что две сложные молекулы, предоставленные сами себе, случайно окажутся друг относительно друга в правильной ориентации, необходимой для взаимодействия. Чтобы такая реакция протекала с ощутимой скоростью, нужна помощь молекул определенного типа — ферментов. Фермент притягивает к себе две другие молекулы и удерживает их в правильном положении, чтобы взаимодействие состоялось. Как только реакция произошла, фермент освобождается и повторяет те же действия с другим набором молекул. Все ферменты в биологических системах представляют собой белки, которые могут принимать разнообразные сложные формы. Как и все белки, они закодированы в ДНК и в качестве ферментов управляют скоростью протекания химических реакций.
Требования, предъявляемые к катализаторам
Катализаторы, используемые в промышленности, должны обладать постоянной высокой каталитической активностью, селективностью, мех. прочностью, термостойкостью, устойчивостью к действию каталитических ядов, большой длительностью работы, легкой регенерируемостью, определенными гидродинамическими характеристиками, незначительной стоимостью. Эти требования относятся, в первую очередь, к катализаторам для гетерогического катализа. Единой теории подбора катализаторов не существует.
Многие катализаторы, широко применяемые в промышленности, подобраны эмпирическим путем. Однако развитие представлений о механизме катализа позволяет сформулировать некоторые принципы подбора катализаторов, пригодных для отдельных типов реакций. Принимая за основу ту или иную теорию действия катализаторов, стремятся найти к.-л. независимую, хорошо изученную характеристику катализатора, которую можно связать с каталитической активностью. Например, установлены корреляции активности катализаторов с числом d-электронов на орбитали катиона (для простых оксидов), параметром кристаллической решетки, электрической проводимостью, зарядом и радиусом иона, энергией хим. связи, кислотностью и др. Основой этих корреляций, как правило, является положение элементов, входящих в катализаторы, в периодической системе.
В технологичных расчетах каталитической активность определяется скоростью реакцции, отнесенной к единице объема или массы катализатора, и зависит от его хим. состава. Поскольку формирование свойств катализатора происходит не только во время его приготовления, но и во время эксплуатации, метод приготовления катализатора должен учитывать возможность образования активных центров в условиях катализа. Кроме того, во мн. случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).
Степень использования внутреной поверхности катализатора можно повысить, применяя т. наз. бидиспeрсные структуры, состоящие, напр., из мелких плотных зерен малого радиуса, соединенных в более крупные пористые частицы размером 103-104 нм. В случае нанесенных катализаторов дисперсность активного компонента, как правило, не влияет на скорость диффузии, т.к. структура пор создается носителем. Селективностью катализатора называют отношение скорости накопления целевого товара к сумме скоростей всех превращает исходного вещества.
Можно выделить несколько факторов, которые определяют селективность и связаны с составом гетерог. Катализаторов. Т. наз. эффект ансамбля определяется числом атомов катализатора, с которыми взаимодеет одна молекула реагента.
Селективность может также изменяться благодаря изменению электронных свойств и окружения активных центров катализатора (т. наз. эффект лиганда). Кроме того, в реакциях сложных орг. молекул большое значение имеет преимуществ. образование товара, близкого по своей форме и размерам к размерам микропор катализатора. Напр., при алкилировании толуола метанолом на цеолитах наблюдается макс. селективность образования n-ксилола, т. к. поперечное сечение его молекулы меньше, чем у м- или о-ксилола, и он легко диффундирует по микропорам цеолита диаметром 0,6 нм. В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы. Их селективность выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Таковы, напр., Bi-Mo-Fe-Co-Ni-K-оксидные катализаторы окислит. аммонолиза пропилена.
Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки. Если целевой товар является промежуточным в цепи последовательных реакций, увеличение пористости снижает селективность катализатора относительно этого товара. Применение высокопористых катализаторов в этом случае невыгодно.
Термостойкость катализаторов особенно важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов. Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители. В процессах с большим тепловым эффектом применяют теплопроводные носители для устранения местных перегревов. Напр., катализаторы глубокого окисления углеводородов наносят на нихромовую проволоку. В состав катализаторов включают также добавки, предотвращающие рекристаллизацию вследствие разъединения кристалликов катализаторов. Такова роль Al2О3 в составе железного катализатора синтеза NH3.
Устойчивость катализатора к действию ядов каталитических определяется спецификой взаимодействие последних с катализатором. Металлические катализаторы отравляются соединение кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и др. веществами, образующими более прочную хим. связь с катализатором, чем реагирующие вещества.
Приготовление катализаторов. Для катализаторов с развитой уд. полностью наиболие распространение получил метод осаждения из водных растворов солей с послед. прокаливанием образующихся соединений. Мн. оксиды металлов получают осаждением гидроксидов из растворов солей под действием щелочи с послед. прокаливанием. При этом предпочтительно использование водного NH3, поскольку отпадает необходимость отмывки осадка от щелочных металлов. При увеличении рН среды образуется гидроксидов содержащий примеси основных солей.
Для большинства гидроксидов металлов размер частиц после осаждения составляет 4-5 нм. В дальнейшем более растворимые гидроксиды могут подвергаться рекристаллизации с образованием укрупненных частиц размером 10-103 нм. Для получения смешанных оксидных катализаторов применяют методы осаждения из смеси различных солей, напр., осаждение нерастворимых СоМоО4 из растворов молибдата аммония и нитрата кобальта. Для получения сложных оксидных и гидроксидных осадков используют методы комплексообразования, напр., образование оксалатных комплексов при взаимодействие ионов Al(Ш), Сr(III), Fe(III) с щавелевой кислотой или оксалатом аммония. Осадок катализатора после фильтрования, центрифугирования или декантации и промывки сушат. При этом удаляется кристаллизации вода и создается первичная пористая структура катализатора. При дальнейшем прокаливании гидроксидов происходит превращает их в оксиды, а в ряде случаев – взаимодеют между оксидами и др. хим. или фазовые превращения. Напр., при прокаливании смеси гидроксидов Со и Сr образуется СоСr2О4, применяемый в качестве катализатора глубокого окисления углеводородов. Уд. повехность и пористость при разложении гидроксидов возрастают.
Для равномерного распределения активного компонента на носителе применяют спец. режимы сушки. Окончательно металлические катализаторы требуемой дисперсности формируются при нагревании, восстановлении оксидов на носителе газами-восстановителями (Н2, СО) перед катализом или непосредственно во время катализа. Пористые металлические катализаторы, т. наз. скелетные, получают из двух- или многокомпонентных сплавов каталитически активных металлов (никель, Со, Сu, Fe) с Al или Si с послед. выщелачиванием Al или Si р-рами электролитов, отгонкой в вакууме или др. методами. Напр., для приготовления широко применяемых скелетных Ni-катализаторов гидрирования (Ni-Ренея) в расплав Al вводят никель и затем медленно охлаждают. При этом образуется мелкокристаллическая структура никель и его соединений с Al (Ni3Al, NiAl, Ni2Al3 и др.). Охлажденный сплав подвергают дроблению и обработке р-ром NaOH. Полученный катализатор пирофорен, поэтому его хранят и транспортируют под слоем масла. Перед использованием активируют Н2 при 120-200 °С. Уд. пов-сть 5-50 мг/г, диаметр пор 2-12 нм.
Катализаторы в автомобилях
В современных автомашинах присутствует каталитический преобразователь или автомобильный катализатор. Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
Автомобильный катализатор и его роль в выхлопной системе
Катализатор имеет удивительно простое устройство, но воздействие его очень велико. Из этой статьи вы узнаете, какие загрязняющие вещества образуются в результате работы двигателя, и как каталитический преобразователь справляется с каждым из них, сокращая выбросы вредных выхлопных газов.
Каталитический преобразователь
Выбросы загрязняющих веществ
Основные загрязняющие вещества, вырабатываемые двигателем, это:
Это выбросы в основе своей не опасны, хотя, как считается, выброс углекислого газа (СО2) способствует глобальному потеплению. Но так как процесс горения никогда не совершенен, небольшое количество гораздо более вредных выхлопных газов выделяется при работе двигателя автомобиля. Именно на снижение их уровня ориентированы каталитические преобразователи:
В следующем разделе мы рассмотрим, какие именно процессы происходят внутри каталитического преобразователя.
Как катализаторы сокращают вредные выбросы в выхлопных газах
В каталитических преобразователях существуют два различных типа катализаторов: восстанавливающий катализатор и окислительный катализатор. Оба типа состоят из керамической структуры, покрытой металлическим катализатором (обычно это платина, родий и/или палладий). Идея заключается в том, чтобы создать структуру, которая подставляет под поток выхлопных газов максимальную площадь катализатора и свести к минимуму задействованное при этом количество самого катализатора, так как используемые материалы весьма дороги. В некоторых преобразователях даже стали использовать золото с примесью более традиционных катализаторов. Золото дешевле по сравнению с остальными катализаторами, и может повысить степень окисления на 40 процентов, что необходимо для снижения количества вредных газов.
Большинство современных выхлопных систем в автомобилях оснащены тремя каталитическими преобразователями, по одному для каждого из веществ, выброс которых необходимо уменьшить.
Следующий раздел посвещен третьей стадии процесса преобразования, и тому, как добиться от своего каталитического преобразователя лучшего результата.
Контроль загрязнения и повышение эффективности выхлопной системы
Третьим этапом преобразования является система управления, которая контролирует поток выхлопных газов и использует эту информацию для управления системой впрыска топлива. Один датчик кислорода установлен выше автомобильного катализатора, то есть ближе к двигателю, чем сам преобразователь. Этот датчик говорит компьютеру двигателя, сколько кислорода содержится в выхлопе. Компьютер двигателя уменьшает или увеличивает количество кислорода в выхлопных газах за счет регулировки количества воздуха, поступающего к топливу. Эта схема позволяет контролировать двигатель компьютера, чтобы убедиться, что двигатель работает на соотношении, близком к стехиометрической точке, а также чтобы убедиться, что в выхлопных газах достаточно кислорода для работы окислительного катализатора для окисления несгоревших углеводородов и СО.
Каталитический преобразователь проделывает большую работу по уменьшению загрязнения окружающей среды, но его производительность может быть существенно улучшена. Одним из недостатков является то, что каталитический преобразователь работает только при достаточно большой температуре. Когда вы только заводите машину, каталитический преобразователь почти не работает.
Простое решение этой проблемы состоит в том, чтобы передвинуть каталитический преобразователь ближе к двигателю. Тогда выхлопные газы, поступающие в каталитический преобразователь, будут более горячими,и он нагреется быстрее, но это одновременно сокращает срок службы конвертера из-за воздействия чрезмерно высоких температур. Большинство автопроизводителей размещает каталитический преобразователь под передним пассажирским сиденьем, достаточно далеко от двигателя, именно для того, чтобы высокие температуры не вредили ему.
А теперь можно рассмотреть все эти три состояния и как ведет себя машина (двигатель) при каждом из них. В рабочем состоянии и описывать-то нечего. Машина работает нормально, лампочка перегрева катализатора на панели приборов не загорается при работе двигателя, претензий ни к чему нет.
Временами (или всегда) пропадает тяга и «приемистость» машины на больших оборотах; вчера вот «тянула» нормально, а сегодня ее вроде бы что-то «за зад держит».
По утрам, да и в состоянии «на горячую» машина стала заводиться все хуже и хуже, двигатель приходится долго «гонять» стартером, что бы завелся.
Иногда «куда-то пропадают обороты»: Вы давите на педаль газа, а стрелка тахометра с трудом добирается до двух или четырех тысяч и там останавливается. Ваш кошелек стремительно пустеет – машина начинает прямо-таки «жрать» бензин.
В «нерабочем» состоянии машина может вести себя таким образом:
Заводится долго, а когда заведется – то глохнет почти сразу же или не заводится вообще, т.е. даже не «схватывает».
Вот это – «третье состояние» проверить просто: надо в момент заведения машины подойти к выхлопной трубе и посмотреть (почувствовать, например, приложенной рукой) – идут оттуда выхлопные газы или нет.
Вопросы экологии и покупки нового катализатора мы не рассматриваем – 99.9% просто удаляют его, а не бегут покупать новый за «сотку баксов». При выполнении данной работы надо учитывать, что в 90% гаек «прикипели намертво». Поэтому, прежде чем набрасываться на них с инструментом – не пожалейте денег на «преобразователь ржавчины».
Хочется предостеречь от распространенной ошибки при удалении катализатора: всегда удаляйте весь и полностью, а не пробивайте только отверстие. Кто даст гарантию, что через какое-то время это отверстие не забьется лопнувшим и отвалившимся куском.
После удаления внимательно осмотрите с «переноской» внутренность той емкости, в которой находился катализатор и Вы увидите «прикипевшую» к поверхности металлическую сеточку, одну или несколько. Ее удаляйте тоже.
Экономия топлива и катализаторы горения
Катализатор топлива предназначен для снижения энергии, которую необходимо затратить на возгорание различных компонентов бензина и дизельного топлива (а их там более пятисот). При добавлении катализатора, увеличивается скорость горения топлив с высокой температурой воспламенения. Следовательно, наиболее активно катализатор действует на высококипящие углеводороды топлива, которые горят в самом конце. Снижая температуру их возгорания, обеспечивается полнота сгорания топлива в двигателе при более низких температурах. Понижение температуры в камере сгорания приводит к уменьшению максимального давления в ней и, следовательно, к снижению жесткости работы двигателя, а также к уменьшению вредности выхлопных газов.
Катализатор топлива также частично выполняет роль каталитических нейтрализаторов. Так в бензин вводят соединения палладия, рения, платины, родия, которые после камеры сгорания, отлагаются в виде металлов на стенках выхлопной системы и действуют как обычные катализаторы дожига. В более тяжелых топливах хороший эффект достигается введением соединений железа, например ферроцена в количестве 0,001-0,003%.
Присадки, в состав которых входят органические соединения металлов, применяют уже давно (с 1950 г). Наиболее широко известны присадки ферроцена (дициклопентадиенилжелеза) и его производных, соединений марганца, меди, никеля, лития и других органических соединений металлов, а в некоторых случаях даже их оксиды. Бензины с такими присадками, в сравнении с топливом без них, дают некоторое изменение денежной эмиссии углеводородов, оксидов азота, оксида углерода. Особенно хорошо это заметно на автомобилях с большим пробегом (более 60 тыс. км). Также катализатор горения повышает эффективность работы каталитических преобразователей отработавших газов, за счет догорания топлива в камере сгорания.
Введение ферроцена в концентрации 15 ppm (0,0001%) не оказывает отрицательного воздействия на работу двигателя, но положительно влияет на работу катализаторов дожига и увеличивает октановое число бензинов. Более того, ферроцен оказывает еще и каталитическое воздействие на процесс горения топлива, частично уменьшая нагар в камере сгорания и улучшая некоторые экологические характеристики двигателя, при одновременном небольшом снижении затраты топлива.
Для предотвращения возможного образования отложений, при использовании металлсодержащих органических соединений в составе катализаторов горения, широко используются присадки-выносители, способствующие удалению металла из камеры сгорания и со свечей зажигания.
Применение некоторых композиций металлорганических соединений позволяет существенно улучшить работу каждой присадки в отдельности, проявляя, в некоторых случаях, синергетический эффект.