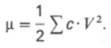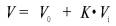В чем заключается практическое применение изоэлектрического осаждения белков
Осаждение белков



Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения безбелкового раствора.
Обратимое осаждение.
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства.
Пример
В изоэлектрической точке белки обладают наименьшей способностью связывать воду, поэтому их легче осаждать. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей – например спиртом и ацетоном. Молекулы этих веществ, являясь более гидрофильными, чем молекулы белка, образуют собственные гидраты с водой, оттягивая воду от белка, лишая их водной оболочки способствуют агрегации белка.
Обезвоживание белков можно проводить путем добавления нейтральных растворов солей высокой концентрации. Этот процесс называютвысаливанием. Осаждающая способность соли зависит от размеров катиона и аниона, а так же от величины их заряда. Высаливающее действие объясняется тем, что при высокой концентрации ионов в растворе белка, они оттягивают на себя от молекул белка поляризованные молекулы воды и тем самым лишают белок гидратной оболочки, которая препятствует осаждению белка. Метод высаливания используется для разделения и получения в очищенном виде белков и ферментов. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором – глобулиновая фракция.
При добавлении растворов нейтральных солей (Na2SO4, (NH4)2SO4, MgSO4 и др.) небольших концентраций, растворимость белков в воде возрастает. Растворению белков, как и других веществ, способствуют те факторы, которые уменьшают взаимодействие между молекулами растворяемого вещества. Нейтральные соли в малых концентрациях увеличивают степень диссоциации ионизированных групп белковых молекул и тем самым уменьшают белок-белковое взаимодействие. Известно, что степень диссоциации электролитов (в том числе белков) прямо пропорциональна диэлектрической постоянной растворителя, которая в свою очередь пропорциональна степени поляризации молекул растворителя, их дипольному моменту. Нейтральные соли в малых концентрациях еще больше увеличивают диэлектрическую постоянную воды. В результате вода усиливает диссоциацию растворенного вещества, в частности белка. Входя между заряженными группами и ориентируясь вокруг них, диполи воды препятствуют их взаимодействию.
Изоэлектрическое осаждение. Заряд белков обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный заряд) и остатками лизина, аргинина и гистидина (положительный заряд). По мере повышения рН различными способами заряд белков проходит от положительных к отрицательным значениям и в изоэлектрической точке оказывается равен нулю. В результате белок лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок, что объясняется отсутствием электростатического отталкивания между молекулами белка и наименьшей способностью связывать воду. Различные белки осаждаются при различных условиях, таким образом их можно фракционировать.
Как удалить белки из раствора?
Денатурация
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
1. Физическая денатурация
Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами.
2. Химическая денатурация
Зависит от природы денатурирующего реагента:
На эффекте химической денатурации основаны устаревшие, но простые и наглядные тимоловая проба и проба Вельтмана, используемые ранее в клиникo-лабораторной диагностике для оценки состава белков крови.
Высаливание
Соли в низких концентрациях способны взаимодействовать с ионными группами белков, отвечающих за внутримолекулярные взаимодействия, приводить к их раскрытию и повышать растворимость.
Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены.
Например, раньше в диагностических целях так определяли соотношение белковых фракций альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8.
Осаждение водоотнимающими средствами
При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, в этом заключается антисептическое действие этанола.
Изменение рН
Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, одновременному уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы.
Химико-токсикологические исследования в работе клинической лаборатории
Экстракция в аналитической биохимии и при выделении ксенобиотиков
1. ЭКСТРАКЦИЯ КАК МЕТОД РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ
Успешное решение проблемы охраны биосферы, снижение отрицательного влияния индустриализации на состояние природной среды и многие другие глобальные проблемы непосредственно связаны с разработкой эффективных методов анализа. Состояние методов избирательного определения металлов не всегда удовлетворяет требованиям к нижним границам определяемых содержаний. Постоянно ощущается необходимость в простых по выполнению, точных, чувствительных методиках, которые позволяли бы определять компонент в сложной по составу смеси. Для решения этой проблемы ученые привлекли методы концентрирования, которые позволили в значительной степени устранить сложные ситуации. Более того, в некоторых случаях концентрирование расширило пределы применимости инструментальных методов (атомно-абсорбционной спектрометрии, хроматографии, спектрофотометрии, вольтамперометрии).
Одним из перспективных методов разделения и концентрирования является экстракция [1]. Давно известно, что многие вещества распределяются между двумя несмешивающимися жидкостями, причем характер разделения в известной степени зависит от растворимости веществ в индивидуальных фазах. Использование этого явления для разделения и очистки веществ стало одним из основных методов в органической химии. Долгое время в области неорганической химии экстракцией интересовались мало. Поэтому экстракцию принято считать относительно молодым методом. Это в значительной мере оправданно, особенно если принять во внимание, что наиболее мощный толчок развитие экстракции получило только в середине нынешнего столетия в связи с работами в области ядерной технологии. Работы в области экстракции микроэлементов проводились, конечно, и ранее. Элементный бром экстрагировали еще в 1825 году. В 60-е годы прошлого века была предложена экстракция роданидов металлов. Этот метод применяется до сих пор. В 20-е годы Фишер исследовал экстракцию комплексов металлов с дитизоном и выявил зависимость распределения элементов от концентрации реагента, металла и ионов водорода.
Начало количественному описанию экстракции (с химических позиций) положили Кольтгоф и Сендел, которые вывели в 1941 году уравнение, характеризующее экстракцию хелатов. Ирвинг и Уильямс развили эту теорию. Последующие интенсивные исследования привели к выяснению химизма большинства экстракционных процессов [2]. Современные экстракционные методы достаточно универсальны. Трудно найти типы соединений, которые нельзя было бы экстрагировать. С помощью экстракции можно разделять многокомпонентные системы, причем эффективнее и быстрее, чем это достигается другими методами. Экстракционные методы пригодны для абсолютного и относительного концентрирования, извлечения в экстракт микроэлементов или матрицы, индивидуального и группового выделения элементов. В статье рассматривается современное состояние экстракции микроэлементов и не затрагиваются вопросы экстракции органических соединений.
Фракционирование и очистка белков
После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет –40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок.
Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении).
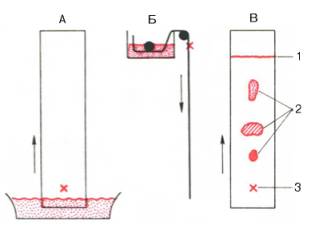
На величину высаливания белков оказывают влияние не только природа и концентрация соли, но и рН среды и температура. Считают, что главную роль при этом играет валентность ионов. Действие разных ионов принято сравнивать не по молярной концентрации соли, а по так называемой ионной силе (μ), которая равна половине суммы произведений концентрации каждого иона (с) на квадрат его валентности (V):
Более тонкое разделение белков плазмы крови человека на фракции достигается при использовании различных концентраций этанола при низкой температуре (от –3 до –5°С) по методу Кона (рис. 1.2). В этих условиях белки сохраняют свои нативные свойства. Указанным методом часто пользуются для получения отдельных фракций крови, используемых в качестве кровезаменителей.
Рис. 1.2. Диаграмма фракционирования белков плазмы крови человека этанолом (по методу Кона).
В последнее время наибольшее распространение получили хроматографические и электрофоретические методы разделения белков.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).
Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) – в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.
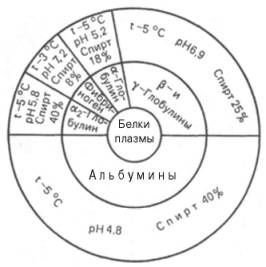
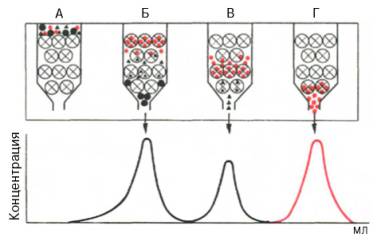
Адсорбционная хроматография. Разделение компонентов смеси (образца) основано на их различной сорбируемости на твердом адсорбенте. В качестве адсорбентов используют активированный древесный уголь, гель фосфата кальция, оксиды алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще всего буферным раствором) вносят в стеклянную вертикальную трубку (колонку) и равномерно в ней упаковывают. Образец в небольшом объеме растворителя наносят на колонку –
Рис. 1.3. Абсорбционнаяхроматография (схема). Разделение двух разных веществ (А и В), перемещающихся по колонке с разной скоростью.
компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии освобождения – десорбции компонентов из колонки, применяя подходящие элюенты (рис. 1.3). Сбор фракций осуществляют при помощи автоматического коллектора фракций.
Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Один из типов распределительной хроматографии, как и адсорбционная, осуществляется на колонках, в которых в качестве стационарной фазы применяют влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку; разделяемые вещества, подвергающиеся многократному распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества в чистом виде.
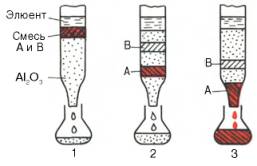
Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических лабораториях, в том числе клинических, для разделения пептидов, аминокислот и других веществ (рис. 1.4). В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол–уксусная кислота–вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
А – восходящая хроматография; Б – нисходящая хроматография (вид сбоку); В – хроматограмма с разделенными и окрашенными веществами: 1 – фронт растворителя, 2 – разделенные вещества, 3 – место нанесения образца.
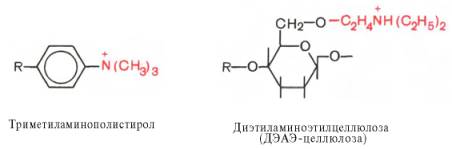
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Различают положительно заряженные анионообменники, представленные органическими основаниями и аминами, и отрицательно заряженные катионообменники, содержащие фенольные, сульфо- или карбоксильные группы. Из сильно- и слабоосновных анионообменников чаще используют производные полистирола и целлюлозы, несущие функциональные группы:
Аналогичные функциональные группы содержат триэтиламиноэтил (ТЭАЭ)- и аминоэтил (АЭ)-целлюлозы.
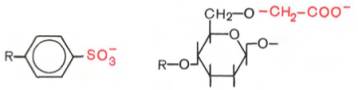
Катионообменники представлены сульфонированными полистиролами (производные винилбензола или дивинилбензола) и карбоксиметилцеллюлозой, имеющими следующие функциональные группы:
В зависимости от заряда разделяемых белков используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белки беспрепятственно элюируются с колонки. «Осажденные» на колонке белки снимают с колонки, применяя более концентрированные солевые растворы или изменяя рН элюента.
Новейшие методы ионообменной хроматографии, в частности высокоэффективная жидкостная хроматография (ВЭЖХ), широко используются в фармакологии (при создании и определении лекарственных веществ), в клинической биохимии (при определении биологически активных веществ в физиологических жидкостях), в биотехнологических процессах и производствах и других областях: они позволяют определять вещества в нано-, пико- и фемтаграммных количествах.
Аффинная хроматография (хроматография по сродству). Основана аффинная хроматография на принципе избирательного взаимодействия белков (или других макромолекул) с закрепленными (иммобилизованными) на носителе специфическими веществами – лигандами, которыми могут быть субстраты или коферменты (когда выделяют какой-либо фермент), антигены (или антитела), гормоны или рецепторы и т. д. Благодаря высокой специфичности белков к иммобилизованному лиганду, связанному с носителем (которым заполняют хроматографическую колонку), присоединяется только один какой-либо белок из смеси. Снятие с колонки этого белка осуществляют элюированием буферными смесями с измененным рН или измененной ионной силой, а также введением в состав элюента детергентов, ослабляющих связи между белками и лигандами. Несомненным достоинством метода является возможность одноэтапно выделить заданный белок или другой биополимер высокой степени чистоты. При помощи аффинной хроматографии, например, удалось сравнительно легко выделить очищенные препараты аминоацил-тРНК-синтетаз на полиакрилгидразидагаровом геле, к которому в качестве лигандов были присоединены определенные тРНК (транспортные РНК).
Гель-хроматография. В препаративных целях, особенно при очистке белков от примесей, широко используют метод молекулярных сит, или гель-хроматографию. При обработке эпихлоргидрином полисахарида дек-страна образуются различной степени выраженности поперечные связи, приводящие к формированию крупных гидрофильных зерен, нерастворимых в воде и называемых сефадексами. Благодаря большому сродству к воде зерна сильно набухают в водной среде с образованием геля, которым заполняют хроматографическую колонку. Разделение веществ этим методом основано на том, что большие молекулы не проникают во внутреннюю водную фазу геля, являющуюся стационарной, и остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки; небольшие молекулы, напротив, свободно диффундируют внутрь зерен, образуя равновесную систему между подвижной и стационарной фазами, и соответственно с меньшей скоростью двигаются вдоль колонки (рис. 1.5). Обычно момент появления веществ в вытекающем из колонки с сефадексом элюенте выражают формулой:
Поскольку молекулы белков, обладающие большими молекулярной массой и размерами, не диффундируют внутрь зерен сефадекса, они первыми вымываются из колонки после выхода свободного объема колонки V0, в то время как все остальные вещества (включая низкомолекулярные примеси) вымываются после выхода объема, равного V0+ К • Vi.
Метод нашел широкое применение в препаративной энзимологии. С помощью сефадекса можно разделить белки с разной молекулярной массой.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка (подробно эти методы и соответствующая аппаратура рассматриваются в практических руководствах по биохимии).
Рис. 1.5. Гель-хроматография на колонке с сефадексом (схема).
Одним из наиболее распространенных методов фракционирования белков (как и методов оценки гомогенности) является диск-электрофорез (от англ. discontinuous – прерывистый, перемежающийся) в полиакриламидном геле, при котором используют пары буферных растворов с различными значениями рН и разной степени пористости гель. Следует отметить высокую разрешающую способность гель-электрофореза. Если при электрофорезе белков сыворотки крови человека на бумаге открываются всего 6 фракций, то при электрофорезе в крахмальном геле – 10, а в полиакрил-амидном геле – до 18 разных белковых фракций.
Для выявления белков при электрофорезе в гелях их обрабатывают одним из следующих красителей: бромфеноловым синим, амидо черным 10В, кислотным синим 83, кумасси бриллиантовым голубым R-250 и др. Интенсивность окраски и соответственно относительное содержание каждой белковой фракции обычно определяют денситометрически путем прямого сканирования на денситометре. В последние годы стали применять методы электрофореза белков с градиентом концентрации геля, что значительно повышает разрешающую способность, особенно при фракционировании белков с высокой молекулярной массой, превышающей 50000– 100000.
Весьма перспективными методами разделения белков (как и определения ряда физико-химических свойств) оказались разные варианты метода изоэлектрического фокусирования – изотахофореза, основанные на проведении электрофореза в поддерживающих средах (на колонке или в тонком слое) с градиентом рН. Точное местоположение на колонке каждого белка из смеси определяется значением его изоэлектрической точки, т.е. состоянием, при котором суммарный электрический заряд белковой частицы при данном значении рН равен нулю. При использовании метода изоэлектрического фокусирования применяют смеси синтетических полиаминополикарбоновых кислот (амфолины) для создания градиента рН в диапазоне от 3,0 до 10,0.
В последние годы широкое распространение для фракционирования белков получили различные сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле – методы двухмерного электрофореза, которые позоляют параллельно анализировать сотни и даже тысячи белковых фракций.
Очистка белков от низкомолекулярных примесей
Применение в определенной последовательности ряда перечисленных методов позволяет получить белок в очищенном состоянии, не лишенный, однако, некоторых примесей солей. Для полного освобождения белков от низкомолекулярных примесей в настоящее время используют методы диализа, гельхроматографии, кристаллизации, ультрафильтрации. При диализе применяют полупроницаемые мембраны (целлофан, коллодийная пленка), диаметр пор которых варьирует в широких пределах. Белки, как правило, не диффундируют через такую мембрану, в то время как низкомолекулярные вещества легко проникают через нее в окружающую среду.
Наилучшие результаты при освобождении белков от низкомолекулярных примесей получают с помощью гельхроматографии и ультрафильтрации. Последняя основана на продавливании растворов белка через специальные мембраны, задерживающие белковые молекулы, что позволяет не только освободить белковые растворы от низкомолекулярных примесей, но и концентрировать их.