В чем заключается структурные особенности аминокислот как мономеров белков
Аминокислоты и биосинтез белка
АМИНОКИСЛОТЫ БЕЛКОВ
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
Известно более 200 природных аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты.
Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.).
В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Общая структура аминокислот. Альфа аминокислоты. Изомеризация аминокислот.
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот.
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
АЛЬФА-АМИНОКИСЛОТЫ
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота» относится именно к ним.
Это 22 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров).
Рис. 2. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ АМИНОКИСЛОТ
Рис. 3. Оптические изомеры аминокислоты аланина
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
СТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(протеиногенные)
Прим.: В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам.
Рис. 5. Рибосома в процессе трансляции (синтеза белка)
Рис. 6 Стадии элонгации полипептида.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода.
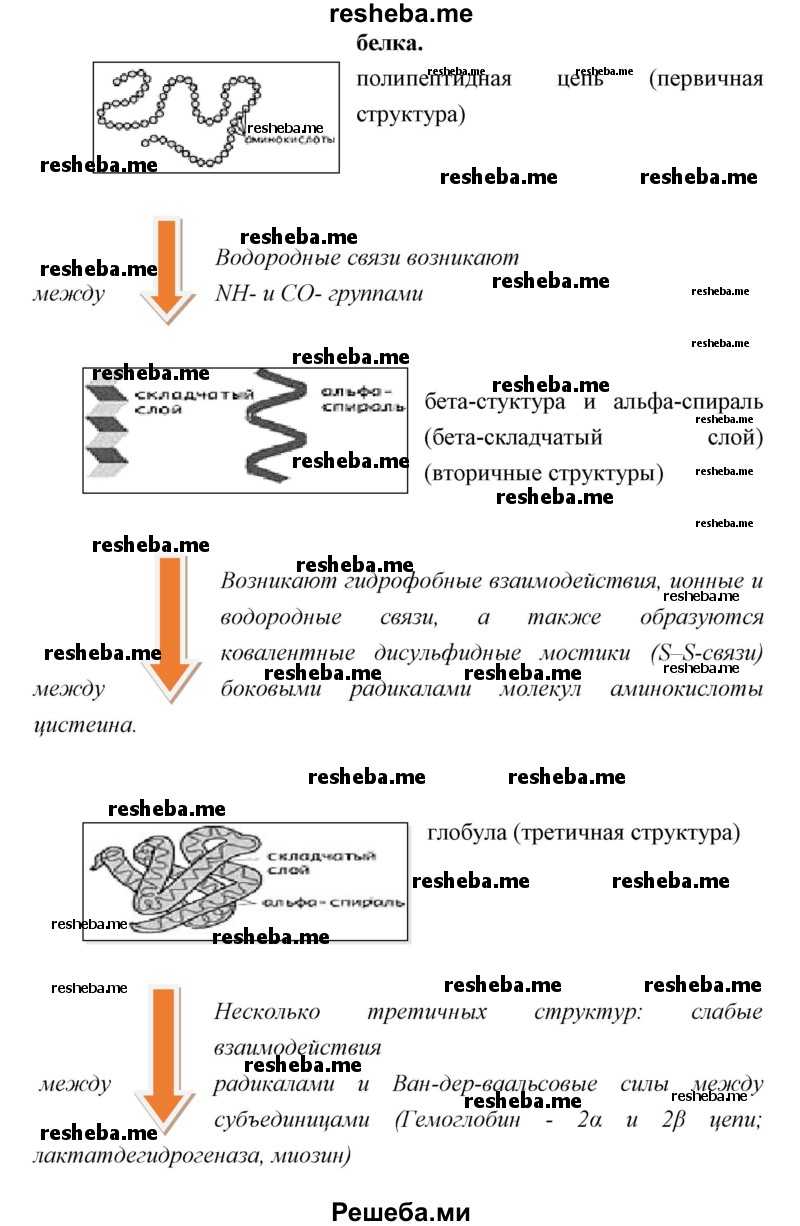
Белки имеют 4 уровня своей структурной организации: первичная, вторичная, третичная и четвертичная. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Рис. 8. Структурная организация белков
НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(Не-протеиногенные)
Функции аминокислот
БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
1. Аминокислоты, белки и питание
О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот.
При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
БЕЛКИ
Рис. 9. Белки не только пища. Типы белковых соединений.
Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей.
ПИТАНИЕ И БЕЛКИ
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
2. Небелковые функции аминокислот
Нейромедиатор аминокислоты

В организме человека многие аминокислоты используются для синтеза других молекул, например:
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей.
Классификация протеиногенных аминокислот
Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
1. По строению бокового радикала выделяют:
Ароматические соединения (арены)
— циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения.
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность;
2. По полярности бокового радикала
Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные).
3. По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
4. По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.
В чем заключается структурные особенности аминокислот как мономеров белков
Подробное решение параграф § 10 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Из каких мономеров состоят белковые молекулы?
Мономерами молекул белков являются аминокислоты.
Вопрос 2. Какую роль играют белки в организме человека?
Роль белков для организма заключается в том, что они служат материалом для построения клеток, тканей и органов, образования ферментов, большинства гормонов, гемоглобина и других веществ, выполняющих в организме важнейшие функции. Также белки участвуют в защите организма от инфекций, а также способствуют усвоению витаминов и минеральных веществ. Наша жизнедеятельность связана с непрерывным расходом и обновлением белка. Чтобы уравновесить эти процессы, потери белка нужно ежедневно восполнять.
Вопрос 3. Какие продукты питания богаты белками?
Творог нежирный, мясо животных и птиц, большая часть сортов рыбы, морепродукты, яичный белок, соя, горох, фасоль, орехи. В этих продуктах содержание белка равно 15 гр на 100 гр продукта.
Вопрос 4. Какие органические вещества называют белками?
Белки — это полимеры, состоящие из ковалентно связанных между собой мономеров–аминокислот, имеющих сходное, но не одинаковое строение.
Вопрос 5. В чём заключаются структурные особенности аминокислот как мономеров белков?
Молекула аминокислоты состоит из двух частей. Одна из них у всех подобных веществ одинакова: она содержит аминогруппу —NH2 и карбоксильную группу —СООН, которые присоединены к одному и тому же атому углерода. Другая часть этой молекулы, присоединённая к этому же атому углерода, называется боковым радикалом. У разных аминокислот он имеет разную структуру.
Вопрос 6. Как образуется пептидная связь?
Пептидная связь образуется в результате взаимодействия α — аминогруппы (—NH2) одной аминокислоты с α — карбоксильной группой (—СООН) другой аминокислоты.
Вопрос 7. Что представляет собой первичная структура белка и от чего она зависит?
Первичная структура белка — это определенная последовательность ковалентно связанных пептидными связями аминокислот, составляющих белок. Эта последовательность, как правило, записывается, начиная с N — конца полипептидной цепочки.
Первичная структура белков, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению структуры синтезируемого белка.
Вопрос 8. Что такое денатурация белка? Что её может вызвать?
Денатурация белка — любые изменения в его биологической активности и/или физико — химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры с сохранением первичной. Её можно вызвать механически (сильное перемешивание или встряхивание), физически (нагревание, охлаждение, облучение, обработка ультразвуком) и химически (кислоты и щёлочи, поверхностно — активные вещества, мочевина).
Вопрос 9. Изучите статью параграфа «Строение белков» и иллюстрации к ней. Обобщите для себя в виде ментальной карты, как образуются вторичная, третичная и четвертичная структуры белка.
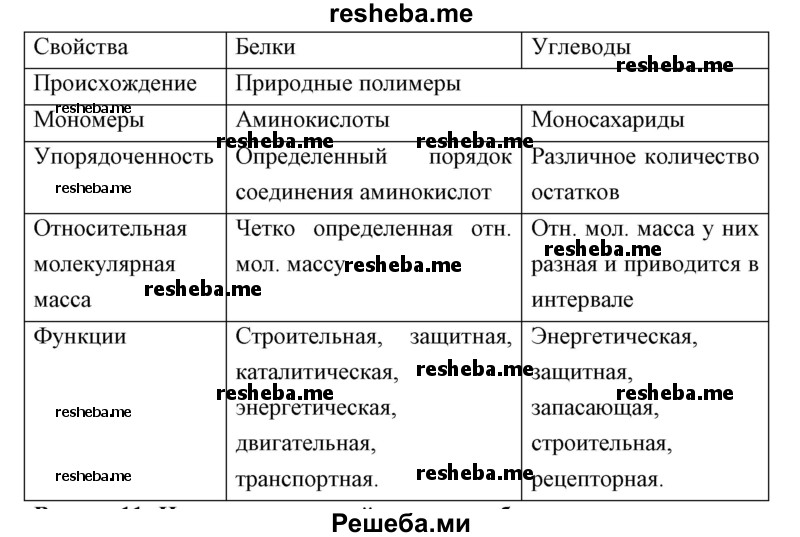
Вопрос 10. Составьте сравнительную таблицу свойств белков и углеводов.
Вопрос 11. Наверняка каждый из нас пробовал незамысловатые, но питательные блюда из куриных яиц. Кто — то любит их в варёном виде, кто — то в виде омлета или глазуньи. Чем можно объяснить изменение внешнего вида белка куриного яйца после его кулинарной обработки? Можно ли вернуть варёному яйцу первоначальную консистенцию, и если нет, то почему?
Изменение внешнего вида яичных белков при кулинарной обработке яиц объясняется свертыванием белка, или денатурацией белка.
Первоначальную консистенцию варёное яйцо принять уже не может — это самый известный случай необратимой денатурации белка в быту. Под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, непрозрачным и нерастворимым.
Биология. 11 класс
§ 3. Органические вещества. Аминокислоты. Олигопептиды
Низкомолекулярные и высокомолекулярные органические вещества. Неотъемлемой составляющей всего живого являются органические вещества, название которых происходит от слова «организм». Эти соединения обеспечивают протекание важнейших процессов жизнедеятельности, и жизнь на Земле без их участия невозможна. Органические вещества составляют в среднем 20—30 % массы живых организмов. Их молекулы состоят, главным образом, из атомов углерода, водорода и кислорода. В состав многих биологически важных органических соединений входят и другие элементы. Например, молекулы белков также содержат азот и серу, нуклеиновые кислоты — азот и фосфор.
Низкомолекулярные органические вещества характеризуются сравнительно небольшой молекулярной массой и относительно простым строением. Это аминокислоты, моносахариды, нуклеотиды, карбоновые кислоты, спирты и т. п. Сложные по структуре соединения, молекулярная масса которых составляет от нескольких тысяч до миллионов, называют высокомолекулярными. К ним относятся белки, полисахариды и нуклеиновые кислоты. Молекулы этих веществ состоят из множества повторяющихся звеньев — мономеров, которые могут быть одинаковыми или различаться по составу. Из курса химии вы знаете, что такие соединения называются полимерами. Мономерами белков являются аминокислоты, мономерами полисахаридов — моносахариды, молекулы нуклеиновых кислот построены из нуклеотидов (рис. 3.1).
Кроме полимеров существуют также олигомеры. Их молекулы образованы сравнительно небольшим числом мономеров — как правило, до 10. К этой группе относятся олигопептиды, олигосахариды и олигонуклеотиды (см. рис. 3.1).*
Из всех групп органических веществ в клетках растений преобладают полисахариды, а в клетках животных — белки. Но несмотря на некоторые различия в количественном соотношении тех или иных органических соединений, вещества, принадлежащие к определенной группе, у всех живых организмов выполняют сходные функции. При этом наибольшее разнообразие биологических функций характерно для белков.
В чем заключается структурные особенности аминокислот как мономеров белков
Подробное решение параграф § 11 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Что такое катализаторы?
Катализаторы — это вещества, изменяющие скорость химической реакции или вызывающие её, но не входящие в состав продуктов реакции.
Вопрос 2. Что такое иммунитет?
Иммунитет — это способ защиты организма от действия различных веществ и организмов, вызывающих деструкцию его клеток и тканей, характеризующийся изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Вопрос 3. Какие белки вам известны? Каковы их функции?
Кератин, коллаген, эластин — строительная, структурная функция;
Гемоглобин — транспортная ф.;
Актин и миозин — сократительная, двигательная ф.;
Гормоны (инсулин, соматотропин и др.) — регуляторная ф.;
Иммуноглобулины, тромбин, фибриноген и др. — защитная ф.;
Пепсин, каталаза, трипсин — каталитическая ф.
Вопрос 4. Какие функции белков вам известны?
Белки выполняют самые разнообразные функции в клетках: определяют их структуру и форму, изменяют скорость протекания химических реакций, обеспечивают передачу химических сигналов, осуществляют разные виды клеточного движения, а также перенос веществ через мембраны и т. п.
Вопрос 5. Чем объясняется многообразие функций белков?
Многообразие функций белков объясняется разнообразием форм и состава самих белков.
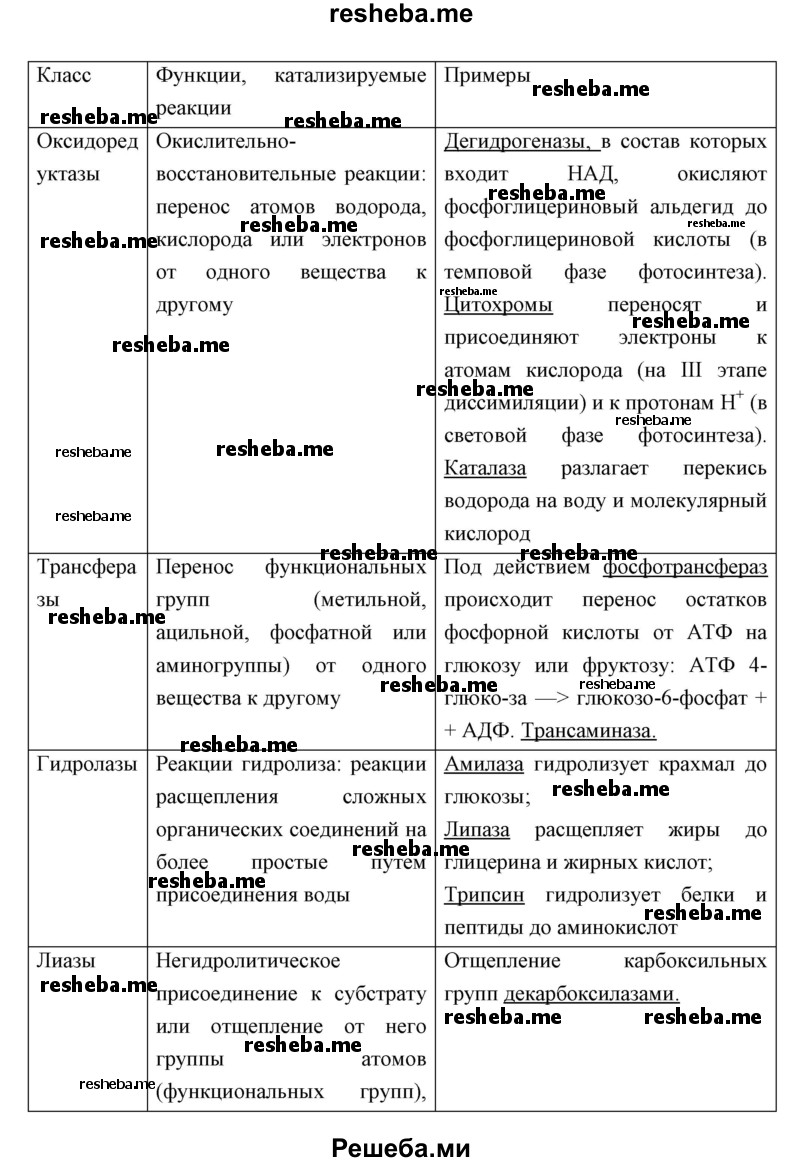
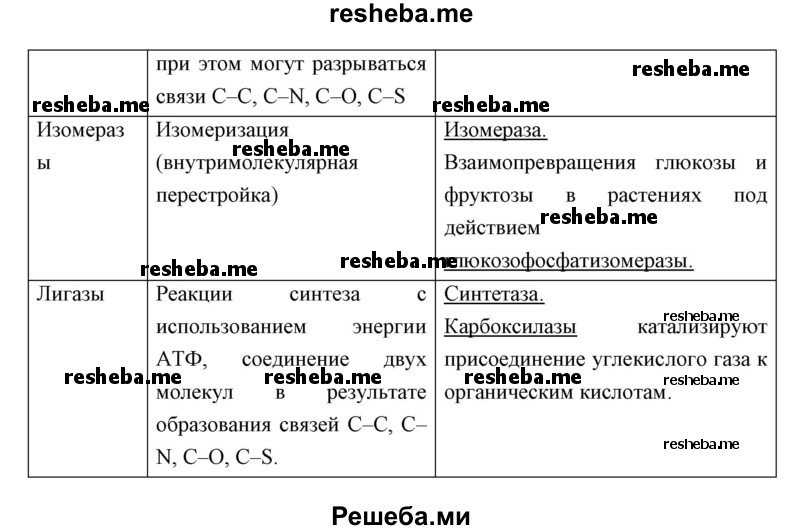
Вопрос 6. Что представляют собой белки — ферменты? Приведите примеры таких белков.
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию.
Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры. Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение. Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Основные свойства ферментов:
специфичность: способность фермента действовать только на специфический субстрат, например, липазы — на жиры;
каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Примеры белков — ферментов: пепсин, каталаза, трипсин, амилаза, протеазы, липазы, глутаматдегидрогеназа, аланинаминотрансфераза (АЛТ), лейцинаминопептидаза (ЛАП), фруктозо — 1,6 — дисфосфат — альдолаза (ФДФ — А) и др.
Вопрос 7. Как реализуется белками защитная функция?
Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами. Связывание их с белками возбудителей подавляет функциональную активность последних и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма.
Кроме того, в ответ на заражение вирусом клетка вырабатывает специальные белки — интерфероны, которые препятствуют размножению носителя инфекции.
Многие организмы используют для защиты или нападения специфические пептиды и белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. Часто эти вещества обладают ферментативной активностью (холерный токсин, коклюшный токсин) или же они могут нарушать структуру клеточных мембран (белки ядов змей и насекомых).
Вопрос 8. Что вам известно о гормонах? Есть ли среди них вещества белковой природы? Приведите примеры.
Гормоны — мельчайшие элементы, вырабатываемые нашим организмом. Это органические биологически активные вещества, которые вырабатываются собственными железами внутренней секреции организма. Поступая в кровь, связываясь с рецепторами определенных клеток, они регулируют физиологические процессы, обмен веществ.
Белкам — гормонам присуща регуляторная функция. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует содержание сахара в крови.
Примеры гормонов белковой природы (белки и полипептиды) — гормоны гипоталамуса, гормоны гипофиза (соматотропин, кортикотропин, пролактин, вазопрессин и окситоцин, гонадотропный гормон, полипептидные низкомолекулярные гормоны, адренокортикотропный гормон, кортикотропин (АКТГ)); щитовидной железы (тироксин, кальцитонин); гормон паращитовидных желез; гормоны поджелудочной железы (глюкагон и инсулин); гормон почек (эритропоэтин) и др.
Вопрос 9. Используя доступные информационные источники, подготовьте сообщение о конкретных видах белков, встречающихся в организмах, и выполняемых ими функциях.
Виды белков их функции в организме.
Структурные белки. Влияют на структуру самой клетки, ее форму. Всеми своими свойствами, качествами и даже функциями каждый вид тканей обязан именно структурным белкам. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
Транспортные белки. Транспортные белки обеспечивают транспортировку питательных и других полезных веществ по всему организму. Например, клеточные мембраны пропускают внутрь клетки не все подряд. И даже некоторые полезные вещества туда не могут проникнуть. Транспортные белки имеют способность проникать сквозь мембраны клеток и проносить с собой эти самые вещества. Гемоглобин — переносчик кислорода и других веществ.
Рецепторные белки. Рецепторные белки наряду с транспортными белками обеспечивают проникновение полезных веществ внутрь клеток. Располагаются рецепторные белки на поверхности мембран, то есть снаружи клеток. Они связываются с поступающими к ним питательными веществами и помогают им проникать внутрь. Важность этого вида белка переоценить невозможно, так как без них внутриутробное развитие может происходить совершенно неправильно или даже полностью прекратиться.
Сократительные белки. Человек двигается благодаря сокращению мышечных тканей. Эту способность им обеспечивают сократительные белки. Как отдельные клетки, так и организм в целом приходит в движение при помощи этого вида белков. Например, миозин, актин и др.
Регуляторные белки. Организм человека ведет свою жизнедеятельность благодаря множеству различных биохимических процессов внутри него. Все эти процессы обеспечивают и регулируют регуляторные белки. Одним из них является инсулин, также половые гормоны.
Защитные белки. Находясь в окружающей среде, организм постоянно контактирует с самыми разными веществами, микроорганизмами и так далее, попадает в самые разные условия. Сохранность здоровья в таких случаях обеспечивают иммунные клетки, которые и являются защитными белками. Также к последним относят прокоагулянты, которые обеспечивают нормальную свертываемость крови. Гаммаглобулин, иммуноглобулин — антитела (защита от инфекций).
Ферменты. Еще один вид белков — ферменты. Они отвечают за правильное протекание биохимических реакций внутри клеток во всем организме. За контроль метаболизма отвечают белки — протеазы.
Вопрос 10. Почему белки называют молекулами жизни?
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка.
Белки — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Белки считаются основным материалом для «строительства» клеток. Учёные выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia соli насчитывается около 3 тыс. различных белков.
Вопрос 11. Используя дополнительные источники информации, найдите сведения о функциях белков ферментов различных классов. Результат оформите в виде таблицы.
Вопрос 12. Найдите в приведённом тексте ошибки. Укажите номера предложений, в которых сделаны ошибки. Исправьте их.
1) Большое значение в строении и жизнедеятельности организмов имеют белки. 2) Это биополимеры, мономерами которых являются азотистые основания. 3) Белки входят в состав плазматической мембраны. 4) Все белки выполняют в клетке ферментативную функцию. 5) Молекулы белка несут наследственную информацию о признаках организма.6) Молекулы белка входят в состав рибосом.
Ответ. Ошибки сделаны в предложениях под номерами: 2, 4, 5.
2)Это биополимеры, мономерами которых являются аминокислоты, соединенные между собой пептидной связью.
4)Не все белки выполняют в клетке ферментативную функцию. ИЛИ…. Все белки выполняют в клетке различные функции.
5) Молекулы белка не несут наследственную информацию о признаках организма. ИЛИ…Наследственная информация о признаках организма зашифрована в нуклеиновых кислотах.
Вопрос 13. Почему в запасных тканях семян растений (эндосперме, семядолях), даже очень богатых углеводами или жирами, обязательно присутствуют белки?
Семена у растений наиболее надежно обеспечивают их размножение и распространение. В семени содержится необходимый для прорастания зародыша запас питательных веществ. Белки при необходимости используются ими для получения аминокислот и энергии. Белки являются основным строительным материалом клеток. Также белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
Вопрос 14. ЛАБОРАТОРНАЯ РАБОТА № 4 «Обнаружение белков с помощью качественной реакции»
Цель: показать наличие белков в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, кристаллизатор со льдом, мерный стакан на 50 мл.
Реактивы: куриное яйцо, концентрированная азотная кислота, раствор аммиака, гидроксид натрия, раствор медного купороса, вода.
1. Приготовьте раствор белка.
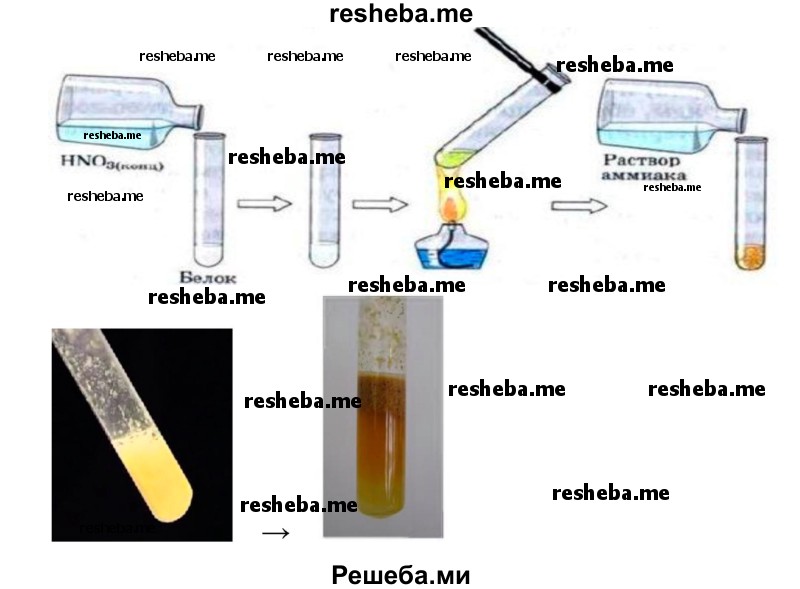
2. Ксантопротеиновая реакция. В пробирку налейте 2—3 мл раствора белка и добавьте несколько капель азотной кислоты. Соблюдайте технику безопасности при работе с химическими реагентами! Нагрейте содержимое пробирки, при этом образуется жёлтый осадок. Охладите смесь и добавьте раствор аммиака до перехода жёлтой окраски в оранжевую.
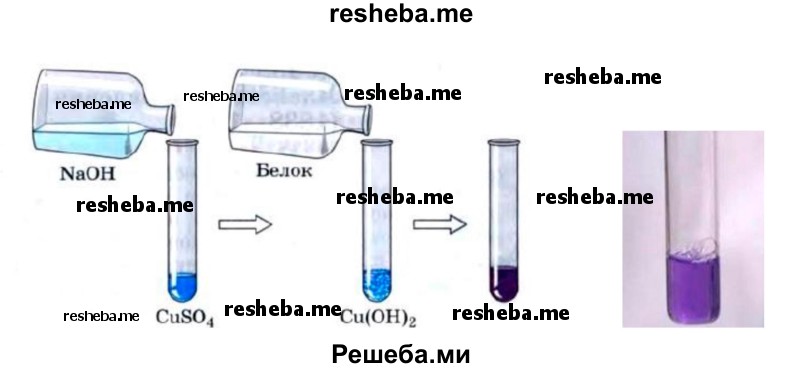
3. Биуретовая реакция. В пробирку налейте 2—3 мл раствора белка и 2—3 мл раствора гидроксида натрия, затем 1—2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
4. Запишите результаты эксперимента и сделайте вывод.
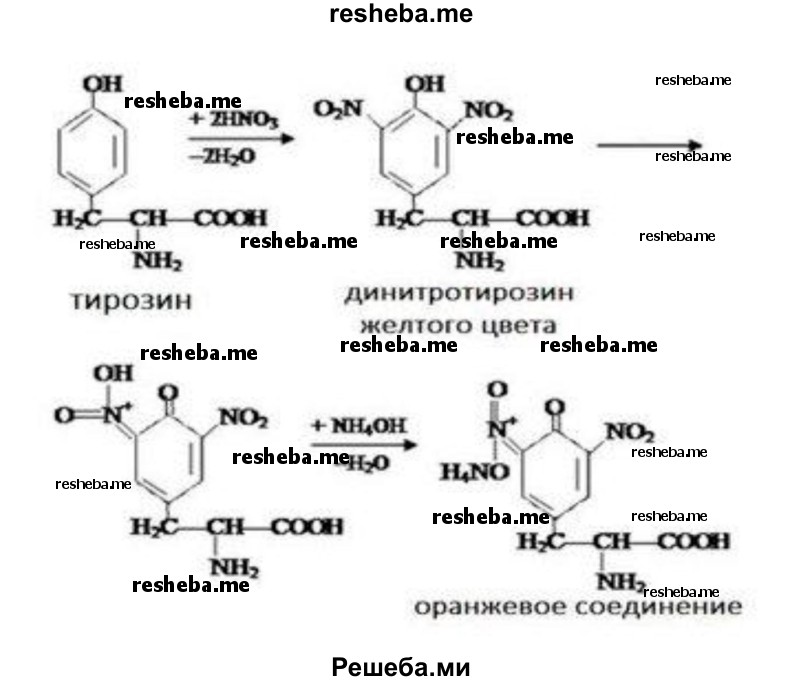
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот — триптофана, фенилаланина, тирозина, содержащих в своем составе ароматическое ядро. Ряд белков при добавлении к ним концентрированной азотной кислоты при нагревании дают желтое окрашивание, которое может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных циклических аминокислот и образованием нитросоединений желтого цвета.
Взаимодействие с концентрированной азотной кислотой — белый осадок, нагревание — появлением желтой окраски, добавление аммиака — появление оранжевой окраски.
Ксантопротеиновую реакцию дают почти все белки. Ксантопротеиновая реакция обуславливает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу, ногти. Эту реакцию могут давать и более простые ароматические соединения (например, фенолы). Исключение составляют клупеин и сальмин (из группы протаминов) и желатина, в молекуле которых почти полностью отсутствуют ароматические аминокислоты.
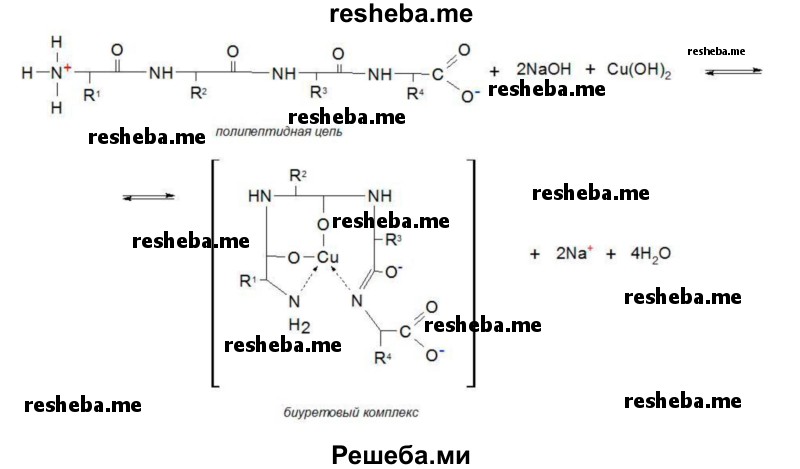
Биуретовая реакция является универсальной на пептидную связь в белках. Вещества, имеющие в своем составе не менее 2 — х пептидных связей дают эту реакцию.
Реакция состоит в том, что в щелочной среде в присутствии сернокислой меди белки и полипептиды дают сине — фиолетовое или красно — фиолетовое окрашивание в зависимости от длины пептида вследствие образования комплексных соединений меди с пептидной группой. Продукты гидролиза белков (пептоны) могут давать розовое, красное окрашивание.
Щелочная среда приводит к появлению отрицательного заряда вследствие диссоциации ОН — группы, благодаря этому кислород взаимодействует с медью с образованием солеобразной связи, а медь в свою очередь с атомами азота связана через дополнительно координационные связи за счет использования их неподеленных электронных пар. Это ведет к образованию стабильного комплекса.
Вывод: Ксантопротеиновая и биуретовая реакции — качественные реакции на белки. С помощью этих реакций можно доказать наличие белков в биологических объектах.