В чем заключается запасающая функция белков
Основные функции белков в клетке
Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом.
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипептид — понятие химическое. Белок — понятие биологическое.
В биологии функции белков можно разделить на следующие виды:
1. Строительная функция
Белки участвуют в образовании клеточных и внеклеточных структур. Например:
2. Транспортная функция
Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например:
Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
3. Регуляторная функция
Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например:
4. Защитная функция
5. Двигательная функция
6. Сигнальная функция
7. Запасающая функция
8. Энергетическая функция
9. Каталитическая (ферментативная) функция
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты можно разделить на две группы:
10. Функция антифириза
11. Питательная (резервная) функция.
Решай задания и варианты по биологии с ответами
В чем заключается запасающая функция белков
Белки (протеины, полипептиды) – сложные высокомолекулярные органические вещества, состоящие изL-аминокислот, соединенных пептидной связью в цепочку. Простые белки – протеины – состоят только из аминокислот. В состав сложных белков – протеидов – помимо аминокислот входят нуклеиновая и фосфорная кислоты, углеводы и другие вещества.
Белок является важным компонентом каждой клетки в организме. Также белок используется организмом для создания и восстановления тканей, производства ферментов, гормонов и других химических веществ, необходимых для нормальной жизнедеятельности организма. Функции белка в организме разнообразны: транспортная, защитная, структурная, двигательная, рецепторная и другие.
Белок является важным компонентом костей, мышц, хрящей, кожи и крови. Волосы и ногти в основном состоят из белка.Как и жир, и углеводы, белок является макроэлементом, то есть организм нуждается в относительно больших его количествах. Но, в отличие от жиров и углеводов, организм не накапливает белок и не имеет его резервов.
Ряд аминокислот, из которых состоят белки, не синтезируются в организме человека (так называемые незаменимые аминокислоты), а поступают только с белковой пищей. В процессе пищеварения ферменты разрушают белки до аминокислот, которые, в свою очередь, используются длясинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Усвояемость белка – это показатель, характеризующий долю абсорбированного в организме азота от общего количества, потребленного с пищей. Биологическая ценность – показатель качества белка, характеризующий степень задержки азота и эффективность его утилизации для растущего организма или для поддержания азотистого равновесия у взрослых. Качество белка определяется наличием в нем полного набора незаменимых аминокислот в определенном соотношении как между собой, так и с заменимыми аминокислотами.
Наибольшей биологической ценностью обладают белки животного происхождения. В белках растительного происхождения обычно отсутствует от одной до нескольких незаменимых кислот. Также усвояемость растительных белков ниже, чем животных (так, например, усвояемость белков мяса/рыбы составляет 93-95 %, а усвояемость бобовых – 70 %).
Потребность в белке зависит от возраста, пола, характера трудовой деятельности. Физиологическая потребность в белке для взрослого населения составляет от 65 до 117г/сутки для мужчин, и от 58 до 87г/сутки для женщин. Физиологические потребности в белке детей до 1года – 2,2—2,9г/кг массы тела, а для детей старше 1года от 36 до 87г/сутки.
Лучшими источниками белка, содержащими все необходимые аминокислоты, в том числе и незаменимые, являются продукты животного происхождения: молоко и молочные продукты, мясо, яйца, рыба и морепродукты. К растительным продуктам, богатым белками, относятся спирулина, соя, фасоль, чечевица, горох, шпинат, киноа.
Биология. 11 класс
§ 4-1. Функции белков
Белки выполняют разнообразные биологические функции — структурную, транспортную, регуляторную и многие другие. При этом одной из самых важных функций белков в живых организмах является каталитическая (ферментативная).
Ферменты. Из курса химии вы знаете, что вещества, повышающие скорость химических реакций, называются катализаторами. Ферменты *(энзимы)* — это белки, которые выполняют функции биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Без их участия биохимические процессы происходили бы слишком медленно или не происходили бы вообще. Ферменты осуществляют расщепление и синтез различных соединений, обеспечивая протекание обмена веществ. Практически все процессы жизнедеятельности обусловлены ферментативными реакциями.

Присоединение субстрата вызывает небольшие изменения конфигурации активного центра — такие, чтобы максимально соответствовать субстрату. Функционально активные группы фермента, за счет которых будет протекать реакция, наиболее благоприятным образом располагаются в пространстве. Образно говоря, активный центр подстраивается под субстрат как перчатка, которую надевают на руку.
В результате присоединения к активному центру молекула субстрата особым образом располагается в пространстве, и в ее структуре ослабляются определенные химические связи. Реакционная способность субстрата возрастает. Поэтому, по сравнению с некатализируемой реакцией, ферментативное превращение субстрата в продукт (или продукты) происходит с меньшими затратами энергии и гораздо большей скоростью. Образовавшиеся продукты отделяются от активного центра. После этого он может принимать новые молекулы субстрата.
Сходство ферментов с обычными химическими катализаторами проявляется в том, что и те и другие увеличивают скорость реакции, но при этом не расходуются и могут использоваться многократно.
В ходе некоторых окислительно-восстановительных процессов, протекающих в живых организмах, образуется токсичное для клеток соединение — пероксид водорода (Н2О2). Без участия катализаторов его расщепление идет очень медленно: 2H2O2 → 2H2O + O2. Вы знаете, что в лаборатории при проведении этой реакции обычно используют неорганический катализатор, например оксид марганца (MnO2). В его присутствии разложение Н2О2 происходит значительно быстрее. В живых организмах под действием фермента каталазы этот процесс протекает с удивительно высокой скоростью: одна молекула каталазы расщепляет за 1 с около 200 000 молекул H2O2!
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне рН, температуры и других факторов. Например, фермент желудочного сока пепсин активен только в кислой среде, а ферменты слюны амилаза и мальтаза — в слабощелочной. В диапазоне 0—40 °С повышение температуры приводит к ускорению ферментативных реакций. Но при дальнейшем увеличении температуры реакции, катализируемые большинством ферментов, замедляются, а затем вовсе прекращаются. Значительное повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
*Существуют ферменты, которые, кроме активного центра, имеют один или несколько регуляторных (аллостерических) центров. С активным или регуляторным центром, либо с другими участками молекулы фермента могут связываться определенные вещества, влияющие на его активность. Вещества, повышающие скорость ферментативной реакции, называются активаторами, снижающие или блокирующие активность фермента — ингибиторами.
Ингибиторы, которые связываются с регуляторным (аллостерическим) центром, вызывают изменения пространственной конфигурации (конформации) фермента, приводящие к уменьшению его активности. Такой тип ингибирования называется аллостерическим (рис. 4-1.2, а).
Некоторые соединения, по структуре сходные с субстратом, могут связываться с активным центром фермента, но не способны подвергаться ферментативному превращению. Такие вещества препятствуют доступу субстрата в активный центр, тем самым снижая скорость ферментативной реакции. Поскольку молекулы субстрата и ингибитора конкурируют за активный центр, данный тип ингибирования назван конкурентным (рис. 4-1.2, б).
Известно также неконкурентное ингибирование, при котором ингибиторы присоединяются к молекуле фермента вне активного и регуляторного центров. Неконкурентные ингибиторы не мешают связыванию ферментов с субстратами, но вызывают такие изменения структуры, которые не позволяют ферменту превращать субстрат в продукт (рис. 4-1.2, в). Примером могут служить цианид-ионы (CN – ). Они подавляют активность ряда ферментов за счет связывания с ионами металлов, выполняющими роль кофакторов.*
*Ферменты широко используются в пищевой промышленности (при производстве сыров и других кисломолочных продуктов, соков, чая, овощных и фруктовых пюре, в хлебопечении, пивоварении, виноделии, для обработки мяса и т. п.). Их также применяют в сельском хозяйстве для получения кормов, в медицине для диагностики и лечения заболеваний, в текстильной и кожевенной промышленности для обработки тканей, кожи и меха, в производстве синтетических моющих средств и др.*
Кроме каталитической, белки выполняют и другие важные функции (таблица 4-1.1 ).
Функция
Пояснение и примеры
Являются биологическими катализаторами — повышают скорость протекания биохимических реакций, обеспечивая расщепление, синтез и внутримолекулярную перестройку различных соединений. Например, пищеварительные ферменты липазы ускоряют расщепление липидов, амилаза и мальтаза — углеводов, пепсин и трипсин — белков. *Рибулозодифосфат-карбоксилаза обеспечивает связывание углекислого газа в процессе фотосинтеза. Удвоение молекул ДНК происходит под действием фермента ДНК-полимеразы, образование РНК — под действием РНК-полимеразы*
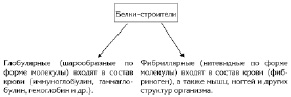
Входят в состав всех компонентов клеток и различных внеклеточных структур. Например, кератин — основной компонент волос, ногтей, когтей, копыт, рогов, перьев. Эластин входит в состав стенок артерий, связок и др., коллаген — в состав кожи, сухожилий, костной, хрящевой и других тканей. *Склеротин является компонентом наружного скелета насекомых и паукообразных. Фиброин составляет основу коконов насекомых*
Переносят различные вещества от одних клеток и тканей к другим, обеспечивают их поступление в клетки, выведение из клеток, а также процессы внутриклеточного транспорта. Например, дыхательный пигмент гемоглобин переносит кислород и углекислый газ в крови позвоночных животных, а у многих моллюсков и ряда членистоногих эту функцию выполняет гемоцианин. *Глобулины плазмы крови транспортируют гормоны и ионы металлов (например, трансферрин — ионы железа, церулоплазмин — ионы меди), альбумины переносят высшие карбоновые кислоты и некоторые другие вещества*
Принимают участие во всех видах движения, к которым способны клетки и организмы. Например, белки актин и миозин обеспечивают сократимость гладкой и поперечнополосатой мышечных тканей. *В основе движения жгутиков и ресничек эукариотических клеток лежит скольжение друг относительно друга микротрубочек, входящих в их состав. Оно обеспечивается взаимодействием белков тубулина и динеина*
Регулируют протекание различных физиологических процессов. Например, гормоны инсулин и глюкагон регулируют уровень глюкозы в крови. Процессы роста и физического развития человека протекают под контролем гормона соматотропина. *Другие тропные гормоны, секретируемые передней и средней долями гипофиза, также представляют собой полипептиды. Например, тиреотропин, стимулирующий деятельность щитовидной железы, гонадотропины, регулирующие работу половых желез, пролактин, контролирующий развитие и функционирование молочных желез и т. п. Гормон щитовидной железы кальцитонин и паратгормон, вырабатываемый паращитовидными железами, регулируют содержание ионов Са 2+ в организме*
Некоторые мембранные белки в ответ на действие определенных химических веществ или раздражителей иной природы изменяют свою конфигурацию. Это приводит к изменению протекания тех или иных внутриклеточных процессов. Таким образом, рецепторные белки обеспечивают прием внешних сигналов и ответные реакции клеток на эти сигналы. Например, зрительные пигменты глаза — родопсин (содержится в палочках) и йодопсины (в колбочках) — обеспечивают восприятие света фоторецепторными клетками, их возбуждение и запуск нервного импульса. *Другими примерами могут служить мембранные рецепторы, которые связывают молекулы гормонов, нейромедиаторов и др. Светочувствительный белок фитохром обеспечивает реакцию растений на изменение длины светового дня (фотопериодизм). Он играет важную роль в регуляции цветения, прорастания семян, формирования листьев и т. д.*
Токсины, выделяемые многими бактериями (дифтерийный, ботулиновый, столбнячный, холерный и др.) по химической природе являются белками. Действующие вещества в составе ядов змей, некоторых пауков, скорпионов и насекомых также представляют собой белки
Запасаются в качестве источника аминокислот, например, резервные белки, которые откладываются в семенах растений *(легумин, запасающийся в семенах бобовых и др.)*, или обеспечивают запасание других веществ. Так, миоглобин играет важную роль в создании кислородного запаса в мышечных волокнах. *Ферритин выполняет роль основного внутриклеточного депо железа у человека и животных*
После гидролиза до аминокислот могут подвергаться дальнейшему расщеплению и окислению с высвобождением энергии. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки используются в качестве источника энергии лишь в крайних случаях, когда истощаются запасы углеводов и жиров
*Натуральный шелк, получаемый из коконов шелкопряда, на 75 % состоит из фиброина и на 25 % из серицина. Фиброин — нерастворимый белок, вторичная структура которого (β-складчатый слой) обусловливает прочность шелка. Волокна шелка образованы фиброиновыми нитями. Снаружи они покрыты клейким водорастворимым серицином, который при производстве тканей удаляется. Шелковая нить имеет треугольное сечение и, как призма, преломляет свет, что вызывает красивое переливание и блеск. Шелк использовался для изготовления тканей еще в 4-ом тысячелетии до н. э. Шелковое волокно применяют в качестве шовного материала в хирургии.*
У пауков основу паутины составляет белок спидроин. Секрет паутинных желез выводится наружу в жидком виде. После этого структура спидроина изменяется, и он затвердевает в виде тонких нитей. В их составе участки β-складчатого слоя чередуются с эластичными полипептидными связками. Благодаря этому паутина обладает одновременно высокой прочностью и эластичностью. Она разрывается лишь при растяжении в 5 раз. По прочности паутина сопоставима со сталью, но при этом ее плотность в 6 раз меньше, чем у стали. Если бы паук создал нить длиной в земной экватор, она имела бы массу менее 500 г.
Научная электронная библиотека
§ 3.1.3. Понятие о цитологии
Цитология – раздел биологии, изучающий жизнедеятельность клетки.
Множество простейших и микроорганизмов представляют собой существующие отдельно друг от друга клетки. Тела многоклеточных организмов построены из огромного числа клеток. Независимо от того, представляет собой клетка целостную живую систему, либо ее часть, она наделена набором признаков и свойств, характерных для всех клеток.
Клетка состоит из простых и сложных молекул белков, нуклеиновых кислот (ДНК и РНК), липидов, углеводов, минеральных веществ и, конечно же, воды. Белкам и нуклеиновым кислотам принадлежит основная роль в синтезе из простых микромолекул сложных макромолекул, в освобождении и превращении энергии из поступающих в клетку веществ.
Клетка – основная структурно-функциональная единица живого. Клетка – биологически автономная система, способная самостоятельно осуществлять все процессы, присущие живой материи (рост, размножение, раздражимость и т. д.)
Впервые клетку наблюдал Р. Гук (1665 г., Англия) на срезах пробки через систему линз. Дальнейшее ведение микроскопических исследований принадлежит члену Королевского общества Неемии Грю (1641–1712 гг.), который собрал первый микроскоп в. Общие результаты своих исследований он изложил в четырехтомном трактате, опубликованном в 1682 г. Трактат этот носил длинное название «Анатомия растений с изложением философской истории растительного мира и несколько других докладов, прочитанных перед Королевским обществом».
Но изучение срезов тканей растительных и животных организмов в 17–18 веках носили описательный характер. Более подробное изучение жизнедеятельности клетки началось с усовершенствованием увеличительной техники в 19 веке. Немецкие ученые М. Шлейден и Т. Шванн (1839 г.) сопоставили ткани растительных и животных организмов, обнаружили общий принцип строения и роста тех и других клеток.
Позднее, благодаря открытию процессов роста и деления, а также ряда биохимических процессов клетки, сформировалась клеточная теория.
Основные положения классической клеточной теории:
1. Клетка – наименьшая структурная единица живого.
2. Все живые организмы состоят из клеток (одной – одноклеточный организм, или множества – многоклеточный организм)[34].
3. Несмотря на огромное разнообразие внешних форм, все клетки сходны между собой по внутреннему строению, химическому составу и принципам жизнедеятельности.
4. «Клетка от клетки». Новые (дочерние) клетки возникают в результате деления исходной (материнской) клетки.
Клетки многоклеточного организма объединяются в ткани, ткани – в органы, органы в системы органов.
Все вещества, входящие в состав клетки (и живого организма в целом) принято делить на две группы – группу неорганических веществ и группу органических веществ (рис. 3.4):
Рис. 3.4. Простейшая классификация веществ живых организмов.
Неорганические вещества в живой клетке представлены, прежде всего, водой, а также микро- и макроэлементами, присутствующими в составе различных солей
Воды в организме содержится, в среднем 83 %. Функции воды:
а) Вода является прекрасным растворителем. Вещества, растворенные в воде, проникают в клетку, обеспечивая ее питание.
б) Продукты обмена выводятся из организма также в виде водных растворов (см. раздел «Цитоплазма»).
в) Вода поддерживает тургор (упругость) клетки.
г) Все биохимические процессы (окисление – восстановление, синтез – разложение, каталитические реакции и т. д.) происходят в водной среде.
д) Кроме того, вода обладает большой теплоемкостью и теплопроводностью, что обеспечивает гармоничное распределение и сохранение тепла в организме.
Примеры микро- и макроэлементов приведены на рис. 3.5.
Рис. 3.5. Микроэлементы и макроэлементы живого организма
Органические вещества живой клетки представляют: липиды, углеводы, белки, нуклеиновые кислоты.
Липиды – производные высших жирных кислот, химический состав которых можно представить формулой СmHnOl. К липидам, в частности, относятся жиры, химический состав которых подробно рассматривается в курсе органической химии. При этом, жидкие жиры (масла) чаще растительного происхождения (исключение – рыбий жир), твёрдые – животного происхождения (исключение – пальмовое масло).
1. Строительная. Липиды входят в состав всех биологических мембран.
2. Энергетическая. Липиды являются источником энергии для организма. При окислении 1 г липидов до СО2 и Н2О выделяется 39 кДж энергии:
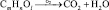
Выделяющаяся при этом вода называется метаболической.
3. Теплоизоляционная. Липиды – отличный теплоизолятор. Эта функция играет большую роль при адаптации организмов к холодной среде обитания, например, моржей и тюленей в холодных водоёмах.
4. Влагообеспечивающая. Как видно из функции 2, жиры служат дополнительным источником воды в организме. Эта функция особенно важна для обитателей засушливых зон.
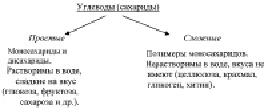
Углеводы, входящие в состав живых клеток, подразделяют на простые и сложные (рис. 3.6)
Рис. 3.6. Простейшая классификация углеводов, входящих в состав живых клеток
1. Энергетическая. Основным источником энергии для организма являются простые сахариды. Важнейшим из них является глюкоза. При окислении 1 г глюкозы освобождается 17,6 кДж энергии. Некоторые сложные углеводы представляют собой дополнительный запас энергии. В частности, организм получает значительное количество энергии для жизнедеятельности при окислении полимерных молекул крахмала (в телах растений) или гликогена (в телах животных).
2. Строительная. Сложные углеводы являются строительным материалом для некоторых живых организмов. Например, целлюлоза входит в состав древесины, а хитин – в наружный скелет насекомых.
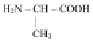
Белки – сложные полимеры. На долю белков приходится 50 % от сухой массы живого организма. Белки – уникальная природная форма, из которой состоят все живые организмы планеты. В организме человека встречаются 5 млн типов белков, отличающихся не только друг от друга, но и от белков других организмов. Белки состоят из аминокислот (мономеры), соединенных друг с другом в определенной последовательности, присущей только определенному организму. Всего известно 20 разновидностей аминокислот. В молекуле белка эти аминокислоты соединены друг с другом прочной пептидной связью[36]. В состав 1 молекулы белка входят от 51 до нескольких сотен аминокислот.
1. Строительная. Белки входят в состав всех вещественных биологических структур: клеток, тканей, органов, крови (рис. 3.7).
Рис. 3.7. Простейшая классификация белков, реализующих строительную функцию
2. Каталитическая. Группа белков, являющихся катализаторами биохимических процессов, называется ферментами. Некоторые ферменты ускоряют протекание реакций в десятки и сотни тысяч раз. Схема работы ферментов с субстратами – веществами, вступающими в биохимический процесс, приведена на рис. 3.8.
3. Транспортная. Существует ряд белков, транспортирующих вещества к различным тканям (например, гемоглобин – белок, переносящий кислород к клеткам) и удаляющих продукты обмена. Многие молекулы (например, сахара) не способны проникнуть в клетку без помощи специфических белков-переносчиков.
Рис. 3.8. Схема работы ферментов:
а – сближение субстратов (С) с ферментом.; б – образование
фермент-субстратного комплекса; в – превращение субстратов
в продукты реакции (ПР); г – разъединение продуктов реакции и фермента
4. Гормональная. Гормоны – биологически активные вещества, вырабатываемые железами внутренней секреции и регулирующие физиологические процессы в организме. При недостатке гормонов возникают патологические изменения, приводящих к заболеваниям и даже гибели организма. Некоторые из гормонов являются белками.
5. Защитно-иммунная. Белки, входящие в состав иммунных клеток (лейкоцитов) обеспечивают защиту от бактерий и вирусов. Эти белки (антитела) связываются с чужеродными организму веществами, образуя комплекс, который затем удаляется из организма
7. Двигательная. Некоторые из белков, входящих в состав мышц способны сокращаться, а, значит, приводить организм в движение.
8. Энергетическая. Иногда, хотя и достаточно редко, белки могут служить дополнительным источником энергии. При окислении 1 г белка освобождается 17,6 кДж.
Нуклеиновые кислоты в живых клетках представлены двумя типами: дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (ДНК).
Современная структурная модель ДНК была впервые предложена американским биологом Дж. Уотсоном совместно с английским физиком Ф. Криком в 1953 году и представляет собой две полинуклеотидные цепи, соединённых водородными связями и закрученные в спираль. В каждой цепочке содержится от пятисот до нескольких сотен тысяч нуклеотидов. Условная схема строения нуклеотида представлена на рис. 3.9.
В нуклеотидах ДНК остаток фосфорной кислоты и дезоксирибоза – неизменные составляющие, в то время как азотистых оснований существует 4 разновидности: аденин, гуанин, цитозин и тимин. Поэтому каждый нуклеотид принято обозначать тем же названием, что и азотистое
основание, входящее в его состав (аденин, гуанин, цитозин, тимин). Поскольку водородные связи в ДНК могут возникать только попарно, по принципу комплементарности: аденин (А) связывается только с тимином (Т), гуанин (Г) – только с цитозином (Ц), то, зная последовательность одной цепи, можно составить последовательность второй цепи.
Рис. 3.9. Схема строения нуклеотида ДНК
При определённых условиях, перед делением клетки, ДНК объединяется с многочисленными белками в единый комплекс, который называется хромосома (рис. 3.10).
Рис. 3.10. Строение реплицированной (удвоенной) хромосомы
Уникальность дезоксирибонуклеиновой кислоты состоит в том, что её молекула является хранилищем сведений о составе всех белков, вырабатываемых организмом, а, значит, содержит в себе информацию обо всех его внешних и внутренних признаках, причём, передаваемую из поколения в поколение от родителей – потомству. Биологическая передача сведений потомству о своих признаках осуществляется благодаря репликации ДНК.
Репликация ДНК – это процесс её удвоения, протекающий с участием специальных ферментов при подготовке клетки к делению. Репликацию можно условно разделить на три стадии (рис. 3.11):
1. Раскручивание двойной спирали ДНК с одного конца под действием фермента.
2. Достраивание по принципу комплементарности новых цепей на разъединившихся прежних цепях.
3. Окончательное формирование двух новых ДНК. В каждой из них одна цепь принадлежала прежней ДНК, а вторая достроена по принципу комплементарности.
Рис. 3.11. Схема репликации ДНК:
а – раскручивание двойной спирали ДНК; б – достраивание новых цепей
на разъединившихся прежних цепях; в – окончательное формирование двух новых ДНК
Таким образом, при делении клетки обе дочерние клетки получают совершено одинаковые ДНК.
Также как и ДНК, молекула рибонуклеиновой кислоты (РНК) представляет собой полинуклеотидную цепь. В отличие от ДНК она одноцепочечная и содержит намного меньше нуклеотидов. Другим существенным отличием РНК от ДНК является химический состав нуклеотидов: нуклеотиды РНК содержат остаток рибозы вместо дезоксирибозы (рис. 3.12) и вместо тимина в составе нуклеотидов РНК находится урацил.
Основная функция РНК – участие в синтезе белковых молекул. В зависимости от характера этого участия РНК подразделяют на матричные или информационные (мРНК), транспортные (тРНК), рибосомальные (рРНК):
– мРНК копирует с ДНК информацию о структуре белка, который нужно синтезировать и доставляет её к месту синтеза;
– (тРНК) – доставляет необходимые аминокислоты и в определенном порядке к месту синтеза белка;
– (рРНК) – входят в состав рибосом – внутриклеточных частиц, на которых и происходит синтез белка. Иногда рибосомы называют главными «рабочими» синтеза белка.
Участок ДНК, содержащий сведения о первичной структуре одного определённого белка, называется геном. Совокупность всей информации обо всех белках, хранящаяся в ДНК иногда называют генетической программой. Последовательность нуклеотидов ДНК определяет аминокислотную последовательность молекулы белка. Эта зависимость между молекулой ДНК и строением белковой молекулы называется генетический код. Генетический код известен для всех 20 аминокислот.
Рис. 3.12. Схема строения нуклеотида РНК
Процесс передачи информации генетического кода в конкретный белок протекает следующим образом:
1. С помощью специальных ферментов на поверхности гена формируется комлементарная цепь матричной РНК. В данном случае ген является матрицей с которой делается слéпок – м-РНК.
2. Образовавшаяся м-РНК перемещается к месту синтеза белка – к рибосомам.
3. Сюда же к месту сборки белковой молекулы «доставляются» посредством тРНК определенные аминокислоты, последовательность построения которых записана на мРНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна аминокислота. Например, возле нуклеотидной последовательности ГГЦ может закрепиться только глицин
а возле кодона ГЦУ – только аланин
Всего в построении белковой молекулы участвует 20 различных аминокислот.
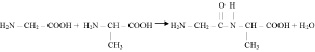
4. Между располагающимися в строго определённой последовательности аминокислотами образуется пептидная связь
и постепенно формируется молекула белка. Следует подчеркнуть, что синтез белковых молекул осуществляется при активном участии огромного количества всевозможных ферментов.
1. Что такое клетка? В чем заключается ее биологическое значение?
2. В чем заключаются основные положения клеточной теории Шлейдена – Шванна?
3. Какие вещества неорганической природы включены в состав клетки? Объясните их значение.
4. Какое значение для клетки имеют органические вещества: липиды, углеводы и белки?
5. Что такое ДНК? Расскажите о ее строении. Каково значение ДНК для клетки?
6. О чем гласит принцип комплементарности в построении молекулы ДНК?
Произвести достройку молекулы ДНК: А-Г-Г-Г-Ц-А-Т-Г-Т-Т-А-Ц-Г-Ц.
7. Задача: в молекуле ДНК 19 % цитозина. Определить количество остальных нуклеотидов.
8. В чем биологический смысл репликации ДНК?
9. В чем особенности строения РНК? Какие виды РНК встречаются в клетке и какую функцию осуществляют?
10. Каким образом происходит реализация генетической программы?
В чем ее биологический смысл?