Аденозинтрифосфорная кислота это что
АТФ в бодибилдинге
Содержание
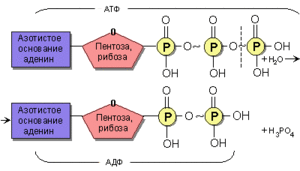
АТФ должна пройти через несколько ступеней, чтобы дать нам энергию. Сначала при помощи специального коэнзима отделяется один из трёх фосфатов (каждый из которых даёт десять калорий), высвобождается энергия и получается аденозин дифосфат (АДФ). Если энергии требуется больше, то отделяется следующий фосфат, формируя аденозин монофосфат (АМФ). Главным источником для производства АТФ служит глюкоза, которая в клетке инициально расщепляется на пируват и цитозол.
Во время отдыха происходит обратная реакция – при помощи АДФ, фосфагена и гликогена фосфатная группа вновь присоединяется к молекуле, формируя АТФ. Для этих целей из запасов гликогена берётся глюкоза. Вновь созданный АТФ готов к следующему использованию. В сущности АТФ работает как молекулярная батарея, сохраняя энергию, когда она не нужна, и высвобождая в случае необходимости.
Структура АТФ [ править | править код ]
Молекула АТФ состоит из трёх компонентов:
1. Рибоза (тот же самый пятиуглеродный сахар, что формирует основу ДНК)
2. Аденин (соединённые атомы углерода и азота)
3. Трифосфат
Молекула рибозы располагается в центре молекулы АТФ, край которой служит базой для аденозина. Цепочка из трёх фосфатов располагается с другой стороны молекулы рибозы. АТФ насыщает длинные, тонкие волокна, содержащие протеин, называемый миозином, который формирует основу наших мышечных клеток.
Системы АТФ [ править | править код ]
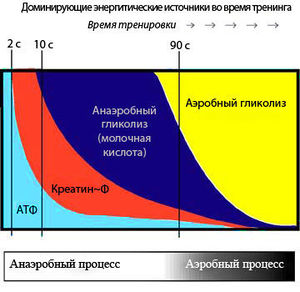
Запасов АТФ достаточно только на первые 2-3 секунды двигательной активности, однако мышцы могут работать только при наличии АТФ. Для этого существуют специальные системы, которые постоянно синтезируют новые молекулы АТФ, они включаются в зависимости от продолжительности нагрузки (см. рисунок). Это три основные биохимические системы:
1. Фосфагенная система (Креатин-фосфат)
2. Система гликогена и молочной кислоты
3. Аэробное дыхание
Фосфагенная система [ править | править код ]
Когда мышцам предстоит короткая, но интенсивная активность (приблизительно 8-10 секунд), используется фосфагенная система – АДФ соединяется с креатина фосфатом. Фосфагенная система обеспечивает постоянную циркуляцию небольшого количества АТФ в наших мышечных клетках. Мышечные клетки также содержат высокоэнергетический фосфат – фосфат креатина, который используется для восстановления уровня АТФ после кратковременной, высокоинтенсивной работы. Энзим креатин киназа отнимает фосфатную группу у креатина фосфата и быстро передаёт её АДФ для формирования АТФ. Итак, мышечная клетка превращает АТФ в АДФ, а фосфаген быстро восстанавливает АДФ до АТФ. Уровень креатина фосфата начинает снижаться уже через 10 секунд высокоинтенсивной активности. Пример использования фосфагенной системы энергоснабжения – это спринт на 100 метров.
Система гликогена и молочной кислоты [ править | править код ]
Система гликогена и молочной кислоты снабжает организм энергией медленнее, чем фосфагенная система, и предоставляет достаточно АТФ примерно для 90 секунд высокоинтенсивной активности. В ходе процесса из глюкозы мышечных клеток в результате анаэробного метаболизма происходит формирование молочной кислоты.
Учитывая тот факт, что в анаэробном состоянии организм не использует кислород, эта система даёт кратковременную энергию без активации кардио-респираторной системы точно так же, как и аэробная система, но с экономией времени. Более того, когда в анаэробном режиме мышцы работают быстро, они очень мощно сокращаются, перекрывая поступление кислорода, так как сосуды оказываются сжатыми. Эту систему ещё можно назвать анаэробно-респираторной, и хорошим примером работы организма в этом режиме послужит 400-метровый спринт. Обычно продолжать работать таким образом атлетам не даёт мышечная болезненность, возникающая в результате накопления молочной кислоты в тканях.
Аэробное дыхание [ править | править код ]
Если упражнения длятся более двух минут, в работу включается аэробная система, и мышцы получают АТФ вначале из углеводов, потом из жиров и наконец из аминокислот (протеинов). Протеин используется для получения энергии в основном в условиях голода (диеты в некоторых случаях). При аэробном дыхании производство АТФ проходит наиболее медленно, но энергии получается достаточно, чтобы поддерживать физическую активность на протяжении нескольких часов. Это происходит, потому что глюкоза распадается на диоксид углерода и воду беспрепятственно, не испытывая противодействия со стороны, например, молочной кислоты, как в случае анаэробной работы.
Аденозинтрифосфорная кислота это что
Натрия аденозинтрифосфат / АТФ /
Латинское название
Регистрационный номер
Фармакологическая группа
C.01.E.B Прочие препараты для лечения заболеваний сердца
Действующее вещество (МНН)
Лекарственная форма
Раствор для внутривенного введения.
Описание
Прозрачный, бесцветный или слегка желтоватый раствор.
Состав
Форма выпуска и упаковка
Раствор для внутривенного введения, 10 мг/мл.
По 1 мл в ампулы.
5 ампул помещают в контурную ячейковую упаковку из пленки поливинилхлоридной (ПВХ) либо из пленки полиэтилентерефталатной (ПЭТФ). 1 или 2 контурные ячейковые упаковки вместе с инструкцией по применению и скарификатором ампульным помещают в пачку из картона для потребительской тары. Или 5 или 10 ампул вместе с инструкцией по применению и скарификатором ампульным помещают в пачку из картона для потребительской тары с гофрированным вкладышем. При упаковке ампул с точкой или кольцом излома скарификатор ампульный не вкладывают.
Упаковка для стационаров: 4, 5 или 10 контурных ячейковых упаковок вместе с инструкциями по применению в количестве, равном количеству контурных ячейковых упаковок, помещают в пачку из картона для потребительской тары. 50 или 100 контурных ячейковых упаковок вместе с инструкциями по применению в количестве, равном количеству контурных ячейковых упаковок, помещают в коробку из гофрированного картона.
Условия хранения
Хранить в защищенном от света, недоступном для детей месте, при температуре от 2 до 8 °С.
Срок годности
2 года. Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Владелец РУ
Производитель
Фармакологические свойства
Фармакокинетика
Отследить кинетику парентерально введенного препарата Натрия аденозинтрифосфат не представляется возможным из-за высокого напряжения разнообразных реакций, происходящих с участием собственного аденозинтрифосфата (АТФ). Вместе с тем известно, что натрия аденозинотрифосфат быстро распадается в месте введения на аденозин и фосфатные остатки, которые в дальнейшем используются для синтеза новых молекул АТФ.
Показания
Препарат Натрия аденозинтрифосфат применяется для купирования пароксизмов наджелудочковых тахикардий (исключая фибрилляцию и/или трепетание предсердий).
Противопоказания
С осторожностью
Препарат Натрия аденозинтрифосфат применяют с осторожностью:
— брадикардия в межприступный период;
— атриовентрикулярная блокада I степени;
— блокада ножек пучка Гиса;
— фибрилляция и трепетание предсердий;
— артериальная гипотензия;
— ишемическая болезнь сердца;
— гиповолемия;
— перикардит;
— стеноз клапанов сердца;
— артериовенозный шунт слева-направо;
— недостаточность мозгового кровообращения;
— состояния после пересадки сердца (менее 1 года).
Беременность и грудное вскармливание
В связи с отсутствием результатов контролируемых клинических исследований, применение препарата Натрия аденозинтрифосфат при беременности допускается только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода.
В связи с отсутствием данных о выделении трифосаденина в грудное молоко, грудное вскармливание на время лечения препаратом Натрия аденозинтрифосфат следует прекратить.
Способ применения и дозы
Передозировка
Симптомы
Передозировка препарата Натрия аденозинтрифосфат может проявляться головокружением, артериальной гипотензией, кратковременной потерей сознания, аритмией.
Лечения
Введение препарата немедленно прекращают (из-за короткого периода полувыведения побочные эффекты быстро проходят). При необходимости возможно введение ксантинов (теофиллин, аминофиллин), которые являются конкурентными антагонистами трифосаденина и снижают его действие.
Побочное действие
Особые указания и меры предосторожности
Введение препарата Натрия аденозинтрифосфат, как правило, необходимо проводить только внутривенно под медицинским наблюдением, при контроле функции сердца и артериального давления.
Из-за риска развития артериальной гипотензии препарат Натрия аденозинтрифосфат необходимо применять с осторожностью у пациентов с ишемической болезнью сердца, гиповолемией, перикардитом, стенозом клапанов сердца, артериовенозным шунтом слева-направо, недостаточностью мозгового кровообращения.
Натрия аденозинтрифосфат следует с осторожностью применять у пациентов, недавно перенесших инфаркт миокарда, с тяжелой хронической сердечной недостаточностью, нарушением проводящей системы сердца (атриовентрикулярная блокада I степени, блокада ножек пучка Гиса) из-за возможности их усугубления при введении препарата.
При развитии стенокардии, тяжелой брадикардии, артериальной гипотензии, дыхательной недостаточности или асистолии/остановки сердца, введение препарата Натрия аденозинтрифосфат необходимо прекратить.
Препарат может вызывать судороги у предрасположенных пациентов (судороги в анамнезе различного происхождения).
Опыт применения препарата Натрия аденозинтрифосфат у пациентов после трансплантации сердца отсутствует.
Лицам, находящимся на диете с низким содержанием натрия, необходимо учитывать, что препарат содержит натрий.
Влияние на способность управлять механизмами
Влияние препарата Натрия аденозинтрифосфат на способность к управлению автотранспорта и другими механизмами не изучалось.
Взаимодействие
Дипиридамол усиливает действие трифосаденина, в некоторых случаях вплоть до асистолии, поэтому не рекомендуется одновременное введение препаратов. При необходимости введения трифосаденина, необходимо прекратить лечение дипиридамолом за 24 часа до введения трифосаденина или снизить его дозу.
Производные пурина (кофеин, теофиллин, аминофиллин), ксантинола никотинат и другие ксантины являются конкурентными антагонистами трифосаденина, их применение следует избегать в течение 24 часов перед введением трифосаденина. Ксантиносодержащие продукты (в т.ч. чай, кофе, шоколад) не следует употреблять за 12 часов до введения препарата Натрия аденозинтрифосфат.
Карбамазепин может усиливать угнетающее действие трифосаденина на атриовентрикулярное проведение, что может привести к полной атриовентрикулярной блокаде.
Натрия аденозинтрифосфат нельзя вводить одновременно с сердечными гликозидами в больших дозах, поскольку усиливается риск со стороны сердечно-сосудистой системы.
Вторая жизнь АТФ: от главной батарейки до нейромедиатора
Микроглия, которая поддерживает работоспособность нервной системы, да и сами нейроны, вовсю экспонируют некие рецепторы. Активатором для них служит АТФ.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все знают АТФ. Но чем занимается АТФ вне клетки? Во что вылилась «пуримагическая гипотеза»? Каким образом клеточное «топливо», синтезируемое в организме буквально килограммами, становится тонким нейромедиатором? Какие клеточные рецепторы могут разрушать наш организм? Обо всём этом вы узнаете из данной статьи.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Вездесущий АТФ
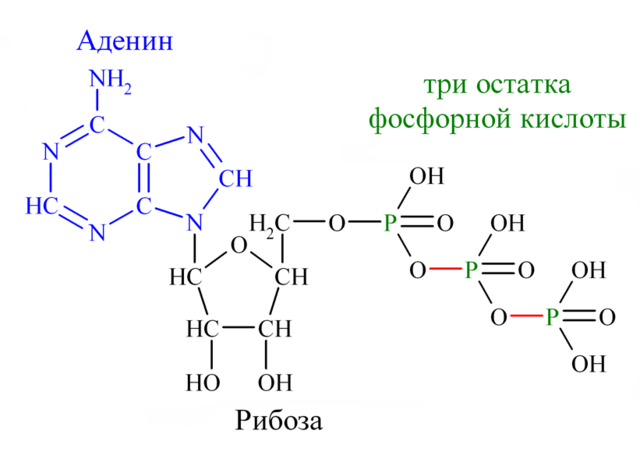
Аденозинтрифосфат (АТФ; рис. 1) — это одна из самых важных молекул в нашем организме. Чаще всего АТФ рассматривается как универсальное топливо для многочисленных «молекулярных машин» и реакций в наших клетках. АТФ одна из самых реакционноспособных молекул на планете. Без него сама жизнь в том виде, в котором она есть сейчас, была бы невозможна.
Рисунок 1. Аденозинтрифосфат (АТФ) — «батарейка» всех клеточных процессов, состоящая из пуринового основания аденина, сахара рибозы и трех остатков фосфорной кислоты, которые хранят в своих связях внушительное количество потенциальной энергии.
Изначально его источником служил лишь бескислородный процесс гликолиза в цитоплазме. Такой способ оказался довольно неэффективным и мог снабжать энергией лишь доядерных прокариот. Появление в клетках верных вассалов-митохондрий позволило вывести производство АТФ на качественно новый уровень и получать его в недостижимых ранее количествах. В митохондриях это происходит при помощи цикла Кребса. Благодаря окислительному фосфорилированию, протекающему в этих органеллах, и клеточному дыханию возникло всё наблюдаемое нами многоклеточное биоразнообразие. Поэтому АТФ в клетках стало много, а за сутки общее количество расходуемого и вновь синтезируемого вещества в нашем теле исчисляется килограммами. Подробнее про синтез АТФ и появление митохондрий можно прочитать на «Биомолекуле» [1].
Более удивительным оказалось то, что и молекула АТФ, и «топливные отходы», получающиеся в результате разрыва фосфатных связей (энергия которых и используется клетками живых организмов для поддержания своей жизнедеятельности), являются частью обширного сигнального аппарата. Эта древняя система сигнализации охватывает весь организм и запускает сложные, порой необратимые, клеточные процессы. Она сообщает нам, когда идти спать, и она же заставляет нас кричать от боли. Находясь на службе клеточного иммунитета, она может как спасти организм от инфекции, так и привести к гибели клеток, став причиной множества воспалительных заболеваний. Более того, АТФ напрямую участвует в регуляции нашей нервной деятельности и служит эффективным нейромедиатором. Однако далеко не сразу эта функция стала очевидной. Для этого потребовались годы усердной работы и исключительное упрямство одного исследователя.
История одного открытия
Люди всегда будут критиковать. Прислушивайся к каждому возражению и проверяй его на практике. И если вдруг окажешься неправ, то ты должен быть первым, кто об этом объявит!
Ульф фон Эйлер,
лауреат Нобелевской премии по физиологии или медицине 1970 г.
Началось всё с того, что в начале 1960-х годов британский ученый-нейробиолог Джеффри Бёрнсток (рис. 2) совершил открытие [2].
Рисунок 2. Джеффри Бёрнсток (1929–2020 гг.). Человек, который своими исследованиями подарил АТФ новую жизнь.
Пребывая в Австралии, Бёрнсток исследовал возбуждение гладкой мускулатуры кишечника морской свинки при помощи электрического тока. Можете не волноваться, он работал на срезе ткани, а не на живой свинке. В то время появились новые электрохимические методы, освоив которые, ученому не терпелось перейти к практике. Ему стало интересно проверить, как гладкая мускулатура будет реагировать на ток в условиях полной блокировки всех известных нервных рецепторов в конкретном срезе ткани. Частая практика у нейробиологов — заблокируй лишние рецепторы нейротоксинами, которыми нас снабдила сама эволюция в лице ядовитых растений и животных (ну и заодно химиков-синтетиков), а потом спокойно изучай то, что осталось рабочим.
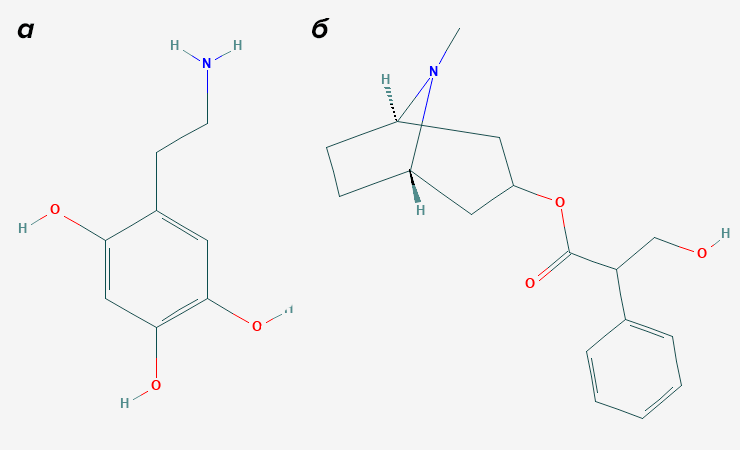
Для начала он обработал ткань 6-гидроксидофамином (рис. 3а). Это синтетический нейротоксин, который нарушает работу дофаминовых и адренергических рецепторов. Затем нужно было заблокировать второй известный тип рецепторов — ацетилхолиновые. Для этого он накачал ткани атропином (рис. 3б), чтобы наверняка отключить все холинорецепторы.
Рисунок 3. Блокаторы Бёрнстока. а — 6-гидроксидофамин (он же 6-OHDA). б — Атропин — растительный алкалоид, известный блокатор ацетилхолиновых рецепторов.
Далее он ввел электрод и простимулировал ткани коротким электрическим импульсом. Ожидалось, что гладкая мускулатура неотвратимо сократится под действием электричества, однако ничего подобного не произошло. Какая-то неведомая сила противодействовала импульсам тока и запускала процессы, мешающие сокращению. На записях электрических сигналов наблюдалась выраженная гиперполяризация, а мышцы расслаблялись даже при серии таких импульсов.
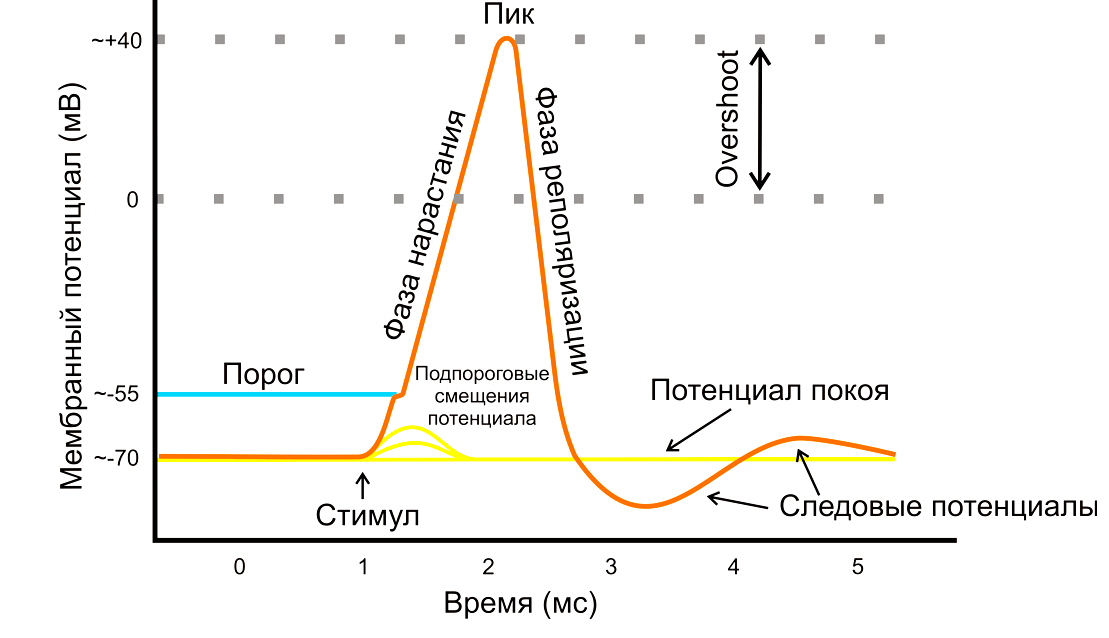
Про потенциал действия
Дело в том, что при потенциале покоя [72] поверхность клеточной мембраны нейрона внутри и снаружи заряжена по-разному: внутри отрицательно, а снаружи положительно. При закачке положительных ионов в клетку, таких как кальций и натрий, потенциал внутренней поверхности мембраны начинает смещаться в положительную сторону и стимулирует нервное возбуждение (рис. 4). «Полюса» начинают двигаться навстречу друг другу, приводя к так называемой деполяризации, пока не достигнут порогового положительного значения. Надо сказать, что существуют тормозящие ионные каналы, которые впускают в клетку отрицательные ионы (хлора, например), либо выпускают наружу положительные (калий). Также есть рецепторы, которые не дают выделяться нейромедиаторам возбуждения. Проще говоря, всячески препятствуют деполяризации мембраны.
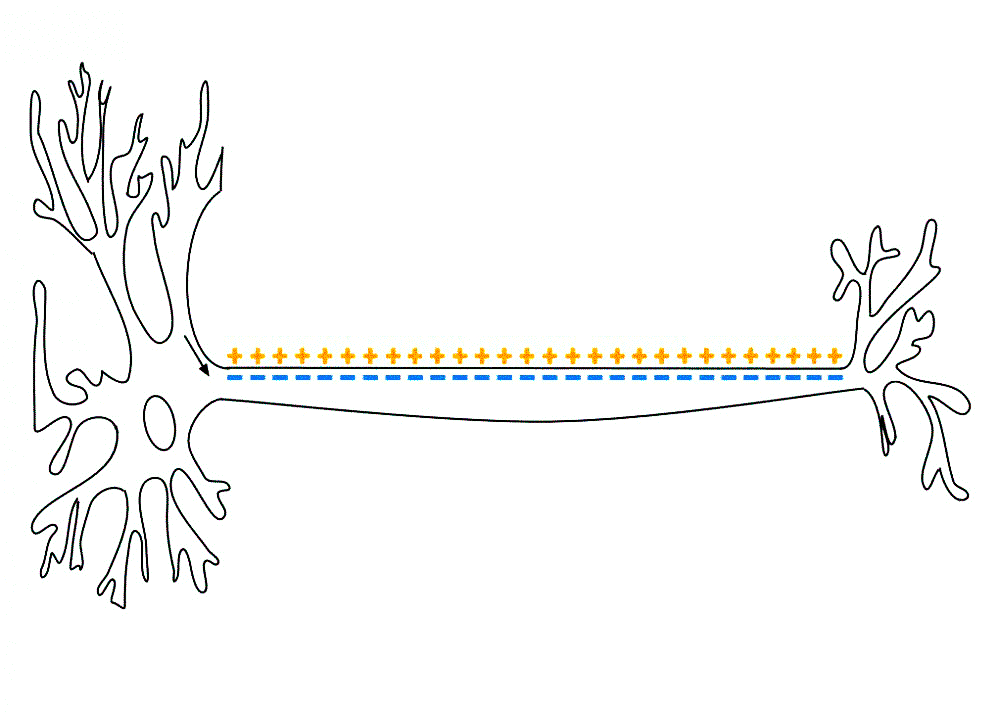
Рисунок 4а. Потенциал действия. Нервная клетка, проводящая потенциал действия по аксону.
Рисунок 4б. Потенциал действия. Схема активации потенциала действия. Подробнее о потенциале действия и методах изучения нервной системы можно прочесть в статье «12 методов в картинках: нейробиология» [3].
Такое перетягивание каната позволяет сформировать адекватный ответ на стимул и определяет конечную «положительность» заряда внутренней поверхности мембраны. Потенциал действия работает по принципу «всё или ничего». Только достигнув некоего внутреннего положительного порога, мембрана нейрона волнообразно передает потенциал действия к месту назначения и снова становится отрицательной (фаза реполяризации). Однако то, чем смещать разницу потенциалов на мембране и передавать по нервам потенциал действия, — электрическим током или входом заряженных ионов, — не имеет значения. Именно поэтому мышцы сокращаются и под действием электрического разряда, прямо как в фантастическом романе о монстре Франкенштейна. Процессом, обратным деполяризации, является гиперполяризация, при которой потенциал действия невозможен. Именно ее и наблюдал Бёрнсток в своем эксперименте.
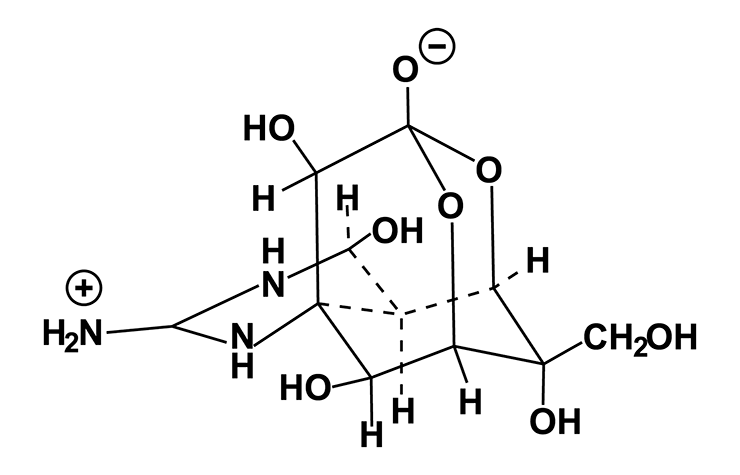
На его счастье, в тот момент Бёрнсток работал с аспирантом из Японии, который использовал свои связи на родине и достал для исследователя знаменитый тетродотоксин (рис. 5а) из рыбы фугу (рис. 5б). Более подробно про тетродотоксин и с чем его едят, можно узнать, прочитав статью, опубликованную на «Биомолекуле» моим однокурсником: «Тетродотоксин — история элегантного убийцы» [4]. Вкратце, этот токсин известен тем, что может блокировать нервную проводимость и как пробка затыкать натриевые каналы. Однако он не лишает гладкую мускулатуру способности сокращаться. Смертоносное вещество было также принято Бёрнстоком в работу.
Рисунок 5а. Остолбеней! Структура тетродотоксина довольно уникальна по своей природе. Благодаря положительному заряду гуанидиновая группа ловко маскируется под гидратированные ионы натрия и проникает в пору натриевого канала. Однако за ней идет объемная клетка, сшитая из атомов углерода и кислорода, и утыканная гидроксильными группами. Она накрепко застревает в лоне ионного канала, препятствуя ходу ионов.
Рисунок 5б. Остолбеней! Рыба фугу — самый известный источник тетродотоксина. Однако виной всему не сама рыба, а обитающие в ней бактерии-симбионты. Именно они служат поставщиками яда в ее органах. Фугу считается экстремальным деликатесом в Японии, а для права ее приготовления повару требуется специальная лицензия. Остаточные дозы тетродотоксина в мясе все еще способны вызвать онемение губ и языка у отъявленных гурманов.
После его применения реакция на электрический разряд наконец стала такой, какой ожидалось — гиперполяризация пропала, а мышцы сократились. Вывод был очевиден: в нервах гладкой мускулатуры кишечника присутствовали неизвестные рецепторы (не холинергические и не адренергические), которые противодействовали сокращению и выполняли функции, тормозящие нервный импульс [5]. Начался усиленный поиск вещества, которое могло бы служить активатором этих новых загадочных рецепторов. К поиску применялся ряд стандартных критериев, таких как:
Однако испробованные нейропептиды, моноамины и аминокислоты не удовлетворяли заданным критериям. Как это часто бывает, подсказки лежали под ногами — следовало лишь немного покопать. Дело в том, что задолго до работы Джеффри Бёрнстока множество ученых уже натыкались на странное воздействие внеклеточных пуринов (гетероцикл пурина служит основой для аденозина в молекуле АТФ) на сердечную мышцу и кровеносные сосуды, но не придали этому большого значения. Например, знаменитый биохимик Альберт Сент-Дьердьи (рис. 6а) — тот самый, что впервые выделил витамин С (одновременно с Чарльзом Кингом), — также провел ряд фундаментальных исследований мышечного сокращения. В своей работе 1929 года Сент-Дьерди отметил, что введение пуриновых соединений в кровь животным влияло на их сердечный ритм [6]. Позже Памела Холтон (рис. 6б) в 1959 году замечала, что АТФ выделяется при стимуляции нервов в ушных артериях кролика и ведет к расслаблению стенок сосудов [7]. Однако никто из них не пошел в своих рассуждениях дальше и не узнал, насколько глубока эта кроличья нора.
Рисунок 6. Исследователи, работы которых помогли Джеффри Бёрнстоку отыскать новый нейромедиатор. Альберт Сент-Дьёрдьи (а) и Памела Холтон (б).
Вооружившись этими знаниями и проведя ряд опытов, Бёрнсток со своим коллегой Дэвидом Сэтчеллом доказали, что АТФ действительно активирует как стимулирующие, так и тормозящие эффекты в разных типах тканей организма. Статья об этом вышла в 1970 году [8]. Тем более, тогда уже стало известно о внеклеточных ферментах, способных расщеплять АТФ. Ничего не оставалось, кроме как признать, что аденозинтрифосфат является тем самым нейромедиатором и выдвинуть гипотезу о пуринергической передаче сигнала. Слово «пуринергическая» придумал сам Бёрнсток. Рецепторы, связанные с этим типом передачи сигнала, позже стали называть «пуринергическими», или «пуринорецепторами». Вернувшись в Англию, ученый столкнулся с недоверием со стороны коллег. В то время также был популярен так называемый принцип Дейла. Этот принцип Бёрнсток и многие другие нейробиологи того времени трактовали как утверждение, что один нейрон может осуществлять передачу сигнала при помощи только одного нейротрансмиттера (например ацетилхолина) и уж никак не при помощи нескольких разных. Тем более, при помощи АТФ. К слову, сам Генри Дейл имел в виду немного другое, но кто его слушал. Всем казалось маловероятным, что вездесущая молекула, источник энергии клеток, может участвовать в тонких процессах регуляции нервной деятельности.
Рисунок 7. Джеффри Бёрнсток. Фотография сделана в 1970 году в Мельбурне — как раз в тот год, когда была опубликована его первая статья о роли АТФ в качестве нейромедиатора.
В 1972 году вышла большая обзорная статья с выдвинутой ученым гипотезой о пуринергических нейротрансмиттерах и их возможной совместной трансмиссии с другими рецепторами нейронов (долой принцип Дейла!) [9]. Эта статья вызвала большой резонанс и стала причиной множества дебатов. Ее можно смело назвать кульминацией сделанных Бёрнстоком открытий в рамках его концепции о пуринергической передачи сигнала. В ней Бёрнсток также сетовал, что результаты его работ списывают на артефакты и ошибки эксперимента. Гипотеза Джеффри продолжала получать сопротивление в научных кругах на протяжении почти двух десятков лет. Некоторые оппоненты заявляли, что посвятят жизнь разрушению «пуринергической теории». Уважаемые ученые спорили до хрипоты, а один и вовсе назвал Бёрнстока «изобретателем пуримагической гипотезы» [2].
Но исследователь не сдавался и упрямо продолжал работу. Следующим шагом предстояло выяснить, что же собой представляют рецепторы, которые могут активироваться сигнальными молекулами АТФ, либо продуктами его распада (АТФ → АДФ → АМФ → аденозин → аденин).
Когда я говорю «семейство рецепторов», имеется в виду то, что раньше (в эволюционно древние времена) они кодировались одним геном, но в результате генетической дупликации возникли его видоизмененные копии, благодаря которым появилось разнообразие родственных рецепторов. Такие белки обычно объединяются в одно семейство и сохраняют высокое сходство последовательности и структурной укладки, но могут выполнять разные функции. Это разнообразие особенно велико, если ген белка — ключевой в выживании и эволюции вида при естественном отборе. Например, яды актиний, змей и пауков накопили целые комбинаторные библиотеки из многочисленных видоизмененных копий одного гена какого-нибудь пептидного токсина (который ранее вообще мог исполнять роль протеазного ингибитора, а не молекулярного оружия). Происходило это в результате эволюционного поиска и адаптации яда к своим жертвам, устойчивость которых тоже не стояла на месте в процессе эволюции. Подробнее про это читайте в статьях «Великому комбинатору и не снилось: комбинаторика токсинов пауков» [11] и «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [12]. Разнообразие же родственных пуринорецепторов у млекопитающих обусловливается усложнением организма и нервной системы в целом.
Это деление на семейства было условным и сделано исключительно по фармакологическим показателям. Рецепторы семейства P1 блокировались метилксантинами и активировались аденозином, в то время как члены семейства P2 в основном реагировали на АТФ, а метилксантины были над ними не властны.
В 1985 году Бёрнсток установил, что и P2-рецепторы можно поделить на два подсемейства — P2X и P2Y [13]. Было это сделано, опять же основываясь на их фармакологии и разной чувствительности к АТФ и его метиленовым производным.
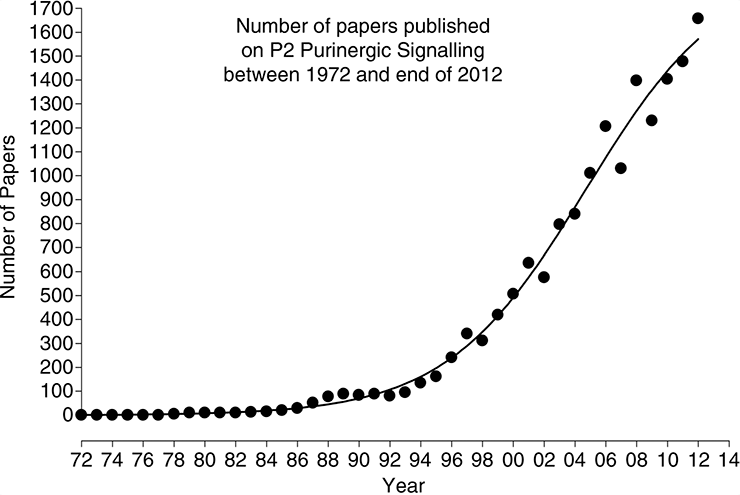
Однако развитие методик молекулярного клонирования [14], [15] в начале 90-х наконец приоткрыло завесу тайны над загадочными пуринорецепторами. Вначале были клонированы и охарактеризованы рецепторы P1, а потом дошла очередь и до P2. А дальше завертелось. Бёрнстоку окончательно поверили. «Пуримагическая гипотеза» потеряла свою магию и перестала быть гипотезой. Исследователи со всего мира бросились изучать новые рецепторы, а количество публикаций на тему «пуринергическая передача сигнала» начало расти буквально в геометрической прогрессии (рис. 8).
Рисунок 8. Количество работ, посвященных пуринергической передаче сигнала, в период с 1972 по 2012 год. Как видно из графика, начало 90-х стало переломным моментом в этой сфере исследований.
Также пуринергическую передачу сигнала стали называть «вторая жизнь», или «вторая профессия АТФ». Таким образом, Джеффри Бёрнсток оказался на коне и моментально попал в топ самых цитируемых ученых в мире. Благодаря развитию рентгеновской кристаллографии и электронной микроскопии, с конца нулевых и на протяжении 2010-х были получены трехмерные структуры рецепторов, позволившие нам разглядеть их строение. Еще одно фундаментальное знание о функционировании нашего (да и не только нашего) организма легло в копилку современной биомедицины.
Пуринергическая передача сигнала: что мы знаем теперь?
А знаем мы довольно много. Пуринергическая передача сигнала отвечает не только за нейромедиацию. Это комплексная система, затрагивающая все уровни организма. Пуринорецепторы отвечают за осязание, боль, регуляцию сердечного ритма, сокращение гладкой мускулатуры, а также выделение желчи и эндокринных гормонов. Что немаловажно, они вовлечены в клеточный иммунитет, а нарушение их работы служит причиной разных патологических состояний в организме. «Принцип Дейла» к нашему дню окончательно потерял актуальность. Теперь всем известно, что один нейрон может экспонировать на своих нервных окончаниях сразу несколько разных рецепторов и использовать для передачи сигналов разные молекулы-нейромедиаторы.
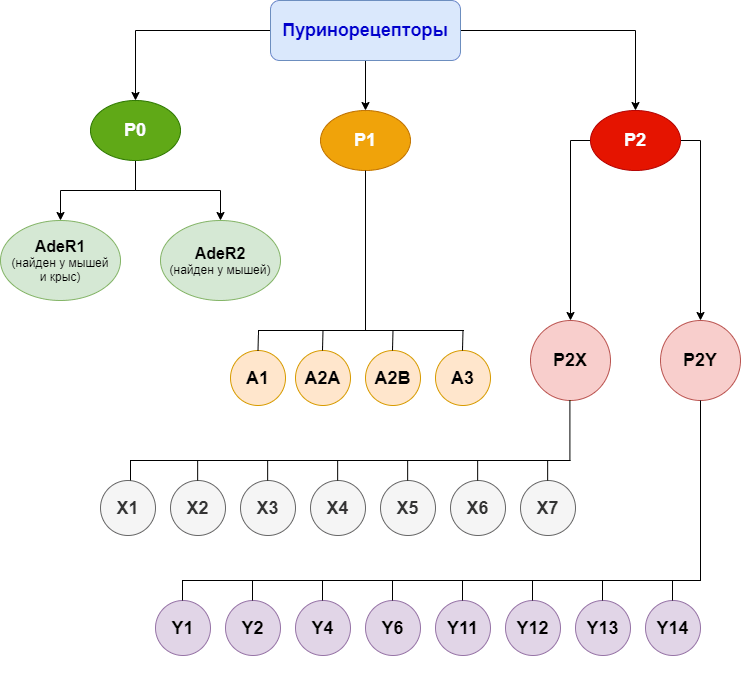
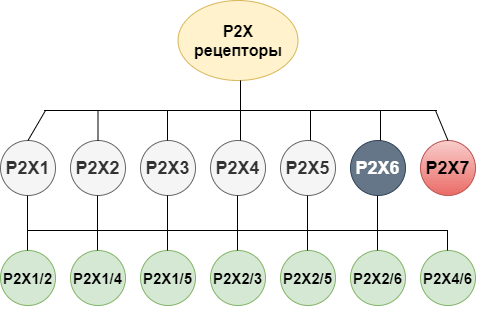
Пуринергические рецепторы работают в совокупности с другими нейронными рецепторами и регулируют нашу нервную деятельность. Классификация Джеффри Бёрнстока верна и работает до сих пор, за тем исключением, что в 2002 году у грызунов смогли найти и клонировать пуринорецепторы третьего семейства, которое реагирует на аденин — последнюю ступень деградации АТФ внеклеточными ферментами (казалось бы, ну сколько уже можно резать несчастную молекулу?) [16]. Новое семейство назвали P0. Оно насчитывает всего два представителя — AdeR1 и AdeR2 (то есть «адениновые рецепторы 1 и 2»), которые были обнаружены в центральной нервной системе лабораторных мышей, крыс и хомяков. Чтобы не запутаться в моем рассказе, лучше поглядывать на классификацию всех этих товарищей, представленную на рисунке 9.
Рисунок 9. Классификация пуринорецепторов
схема создана автором статьи при помощи Flowchart Maker & Online Diagram Software
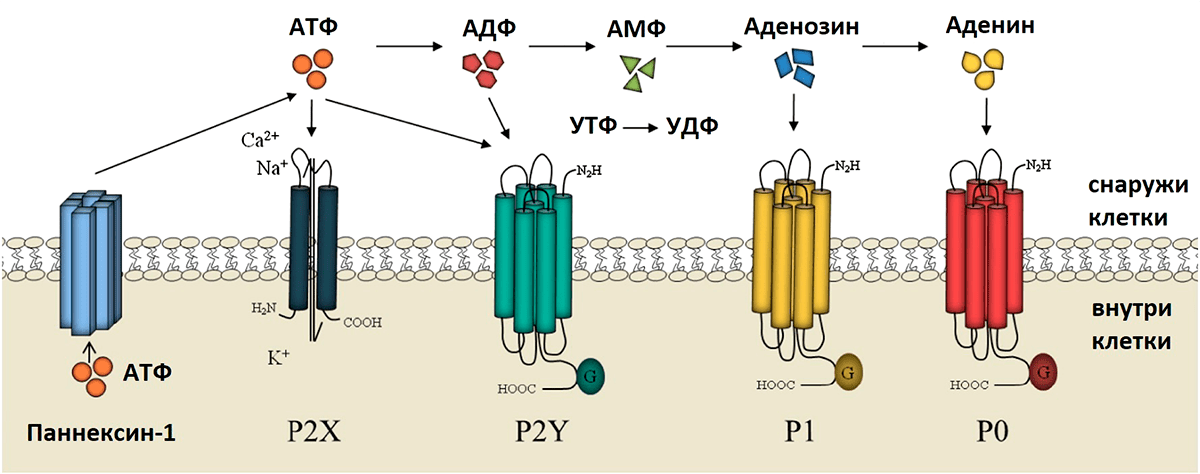
Эта надежная, как швейцарские часы, система работает по цепочке (рис. 10). Сперва из клетки выделяется АТФ. Это происходит разными путями. Оказалось, что существуют специальные каналы и полуканалы (такие как паннексин-1) для высвобождения нуклеотидов, а также особые белки-переносчики для их переноса во внеклеточную среду. (Эволюция системы по переносу пуринов во внеклеточное пространство, пожалуй, заслуживает отдельной статьи.) Однако чрезвычайно много АТФ может выделиться, если содержащие его клетки будут повреждены или полностью разрушены в результате полученных ранений или некроза тканей. Это так называемый литический путь — то есть связанный с лизисом клеточной мембраны. На заре открытия пуринорецепторов такое выделение АТФ во внеклеточную среду казалось единственно возможным путем их активации. Сюда мы также запишем всевозможные травмы и переломы, в том числе хирургическое вмешательство. Всё это неизбежно приводит к чрезмерной активации пуринорецепторов и ко всяким нехорошим стрессовым состояниям. В целом, массовое выделение АТФ во внеклеточное пространство — это один из главных сигналов опасности для организма.
Рисунок 10. Упрощенная схема пуринергической передачи сигнала. Через специальные полуканалы, такие как паннексин-1, во внеклеточное пространство выходит АТФ, который, вкупе со своими продуктами распада, активирует разные пуринорецепторы.
Естественно, АТФ может высвобождаться из везикул в синапсах, как и положено всем порядочным нейромедиаторам. Аденозинтрифосфат, будучи первичным передатчиком сигнала и нейромедиатором, в первую очередь воздействует на трансмембранные ионные каналы семейства P2X. Эти рецепторы мгновенно запускают потенциал действия по нейронам, а также способны активировать различные биохимические пути, благодаря току входящих в клетку ионов.
Далее вступают в дело различные семейства рецепторов, сопряженных с G-белком, или GPCR (от англ. G-protein coupled receptors). Первым подхватывает эстафету семейство P2Y — некоторые члены которого также активируются АТФ (рис. 11а). Затем внеклеточные ферменты, которые называются 5′-эктонуклеотидазами, по очереди отрезают от АТФ остатки фосфорной кислоты. Все продукты такого распада находят свое применение.
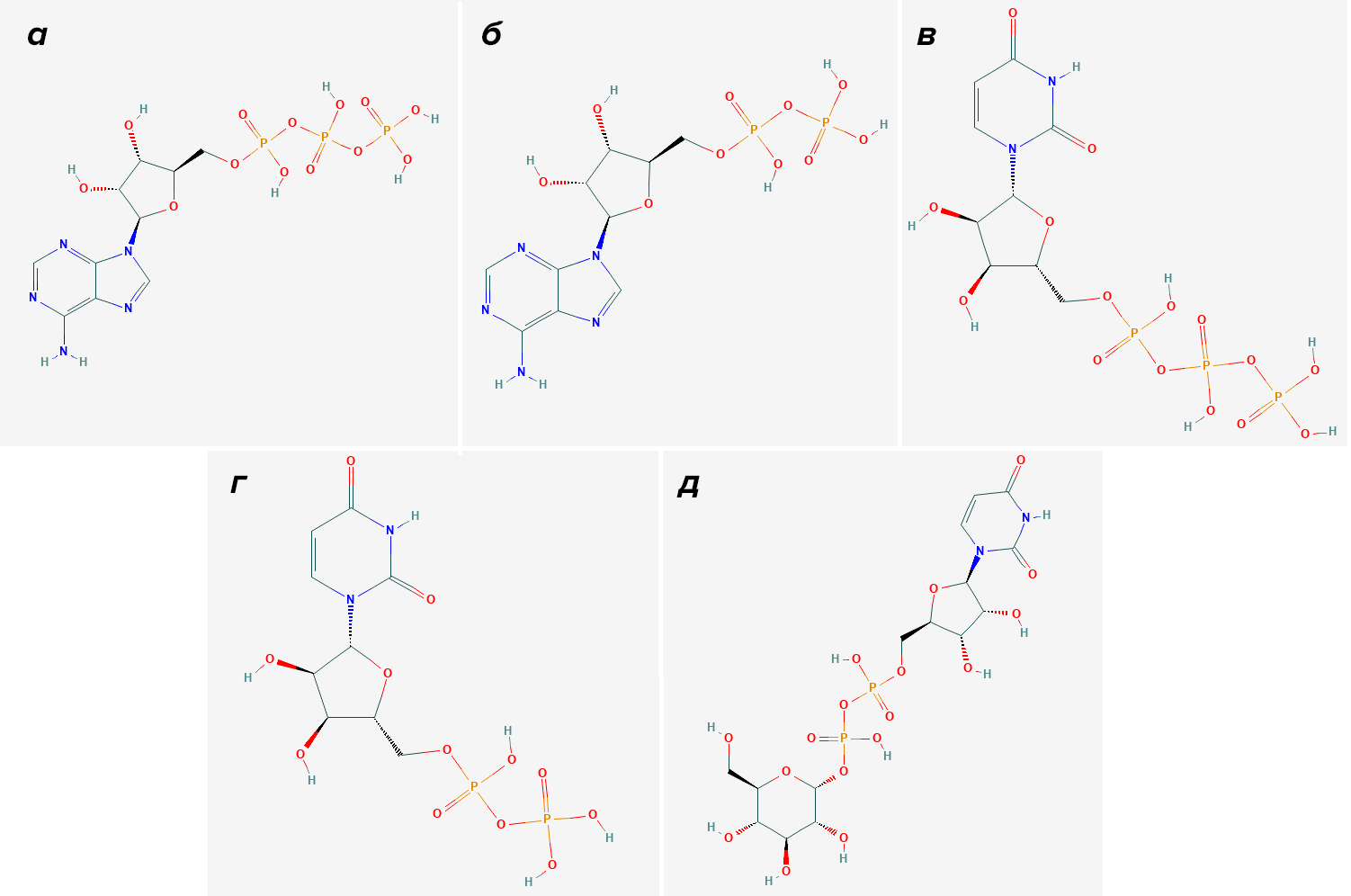
Первой ступенью деградации нуклеотида окажется аденозиндифосфат (АДФ) (рис. 11б). Он пойдет на активацию других членов подсемейства P2Y. Также некоторые «игреки» реагируют на целый пул различных пиримидинов с остатками фосфорной кислоты: УТФ (рис. 11в), УДФ (рис. 11г) и УДФ-глюкозу (рис. 11д).
Рисунок 11. Лиганды-активаторы пуриновых рецепторов P2Y. а — Аденозинтрифосфат (АТФ). б — Аденозиндифосфат (АДФ). в — Уридинтрифосфат (УТФ). г — Уридиндифосфат (УДФ). д — Уридиндифосфат-глюкоза (УДФ-глюкоза).
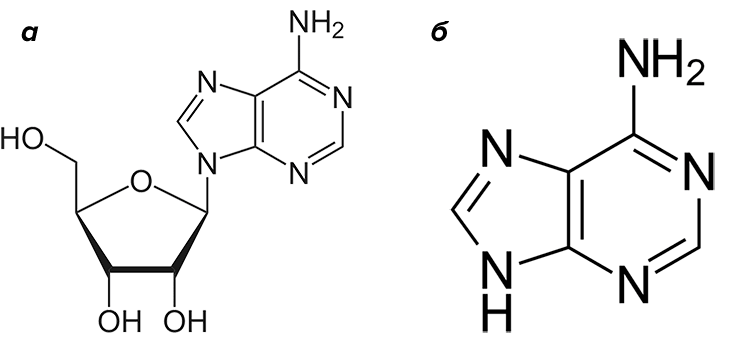
Затем АДФ распадется до аденозинмонофосфата (АМФ), а тот, в свою очередь, до аденозина (рис. 12а) — каркаса АТФ, лишенного остатков фосфорной кислоты. Аденозин окажет влияние на сопряженные с G-белком рецепторы семейства P1. К слову, аденозин может получаться при разрушении цАМФ («посыльного» G-белков), а также производиться в клетке de novo.
Однако на аденозине дело не заканчивается. У грызунов есть свои уникальные GPCR — вышеупомянутые рецепторы P0. В качестве лиганда они выбрали продукт распада аденозина — молекулу аденина (рис. 12б). P0-рецепторы изучены пока недостаточно хорошо, а существование их у людей до сих пор спорно.
P2X: хороший, плохой, трансмембранный
Мы знаем множество историй, как дельфины помогали утопающим доплыть до берега. Просто некому было рассказать, как они толкают людей в противоположную сторону.
Цитата из интернета
Рисунок 13. Ричард Алан Норт. Ученый, который работал во главе исследовательской группы, выделявшей и клонировавшей ДНК P2X-рецепторов с 1993 по 1998 годы.
P2X-рецепторы — это самые настоящие мембранные ионные каналы (ионотропные рецепторы), которые активируются АТФ и только АТФ. Исходя из названия статьи, на них мы остановимся более подробно. Хоть я и рассматриваю все семейства рецепторов в рамках пуринергической передачи сигнала, стоит оговориться, что P2X не имеет ничего общего с относительно родственными между собой GPCR типа P0, P1 и P2Y.
Семь разновидностей P2X-рецепторов найдены по всему организму млекопитающих, включая клетки нервной системы (рис. 10). Однако распространены они неравномерно, и разные клетки синтезируют разные наборы этих рецепторов. Тип клеток определяет состав набора и функции, которые в них выполняют рецепторы. Их ДНК была клонирована, а последовательности охарактеризованы на протяжении 1990-х. Здесь нужно отдать должное научной группе под руководством Ричарда Алана Норта (рис. 13).
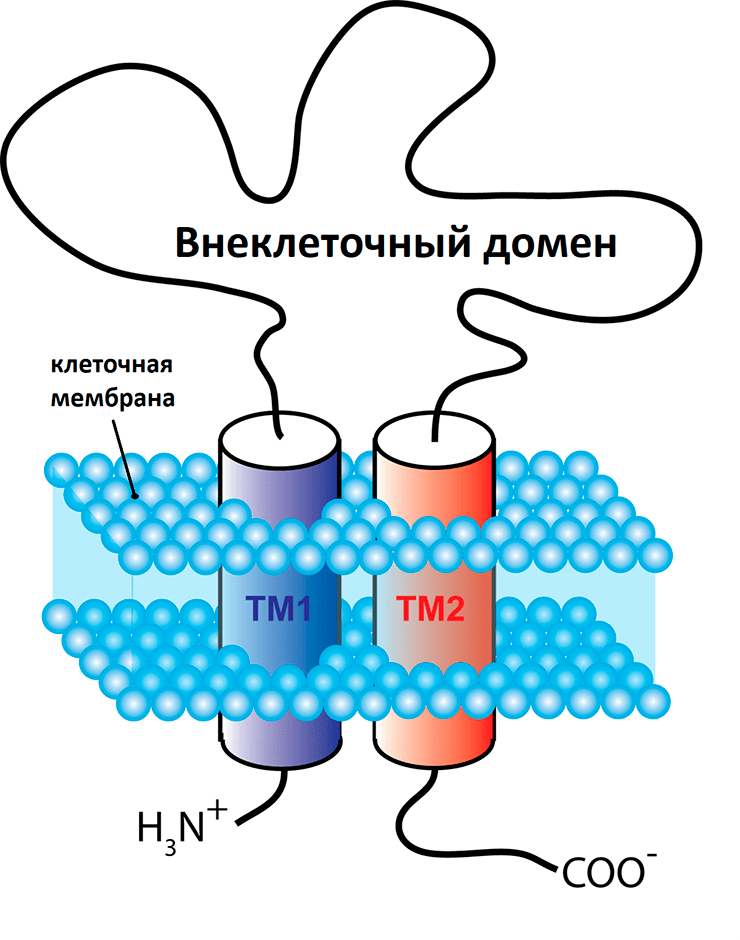
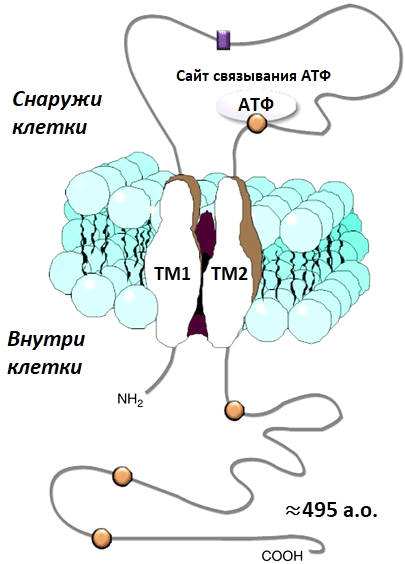
Рисунок 14. Упрощенная схема одной из трех субъединиц P2X-рецептора. Каждая субъединица состоит из двух трансмембранных спиралей (ТМ1 и ТМ2). Концы внутри, а снаружи внеклеточная петля. При открытии канала подвижна TM2, а ТМ1 остается статичной.
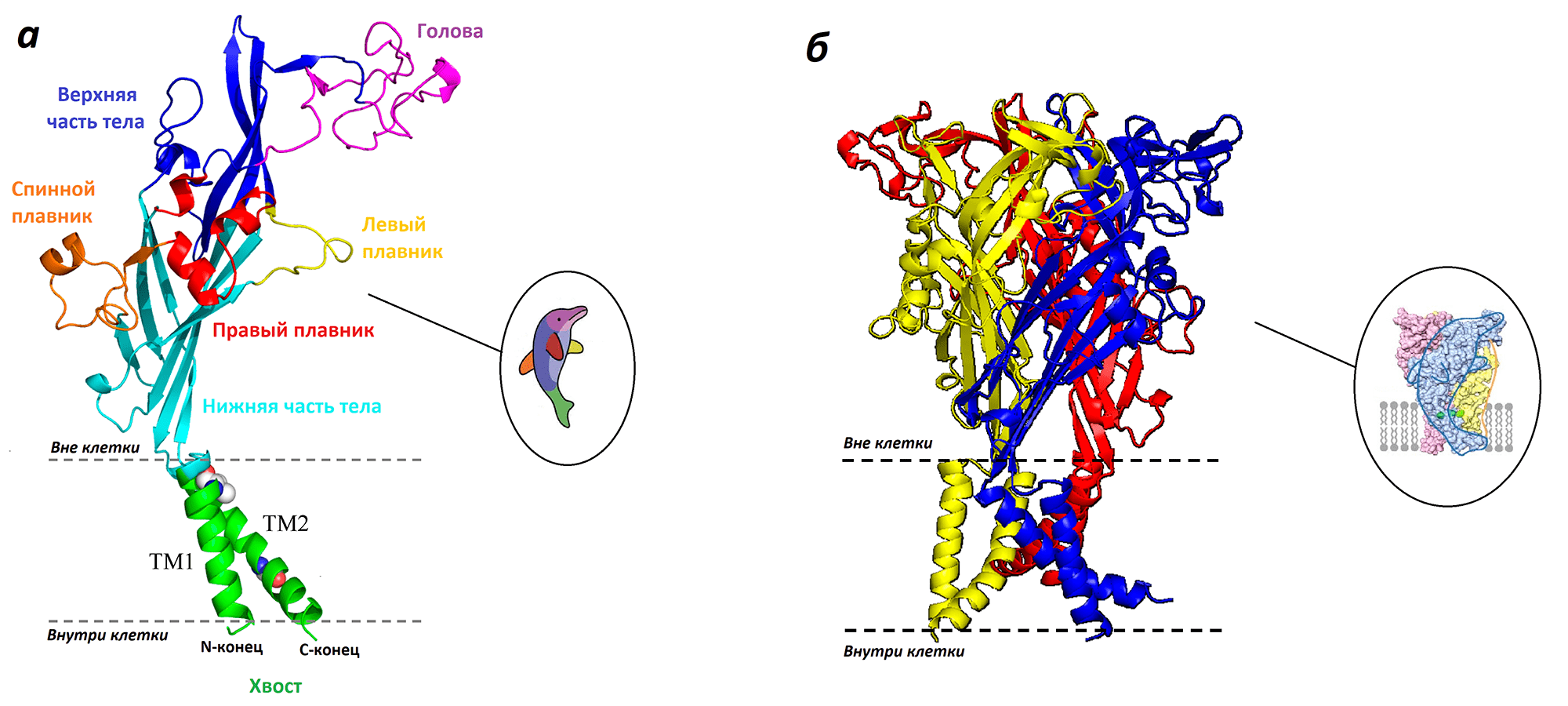
В 2009 году наступил следующий важный этап в изучении P2X-рецепторов. На этот раз группа американских ученых под руководством Тосимицу Каватэ при помощи рентгеноструктурного анализа впервые получила трехмерную структуру рецептора P2X4 из рыбки Danio rerio [18] (спойлер: ученые на этом не остановились и продолжили получать структуры всех остальных «иксов» из разных организмов). Наконец-то мы увидели P2X-рецепторы воочию! Ионный канал оказался тримером, собранным из трех отдельных белковых молекул-субъединиц. Знатоки отметят, что похожей структурой тримера обладают кислоточувствительные ионные каналы (ASICs, от англ. acid-sensing ion channels), однако их аминокислотная последовательность не имеет ничего общего с P2X-рецепторами.
Аминокислотная последовательность субъединиц определяет тип P2X-рецептора. Каждая субъединица пронизывает клеточную мембрану двумя спиралями, ее N- и С-концы находятся внутри клетки, а над мембраной во внешний мир возвышается замысловатый домен (рис. 14).
Все три части, сложенные вместе, могут раскрываться и закрываться, подобно лепесткам на объективе фотоаппарата, формируя ионный канал. Но не это было самым замечательным. Каждая субъединица неуловимо напоминала всем образ дельфина (рис. 15а)! А весь рецептор целиком — это три переплетенных в объятиях млекопитающих (рис. 15б). Ученые до сих пор используют этот метафорический образ для того, чтобы свободнее ориентироваться в строении рецептора и рассуждать об аминокислотных остатках на спинном плавнике или, например, в голове. В целом, такое строение характерно для всех P2X-рецепторов.
Рисунок 15. Мне под кожу бы, под кожу мне / Запустить дельфинов стаю. а — Схематичное строение субъединицы P2X-рецептора в виде дельфина. б — Три таких «дельфина»-субъединицы, объединенные в рецептор-тример.
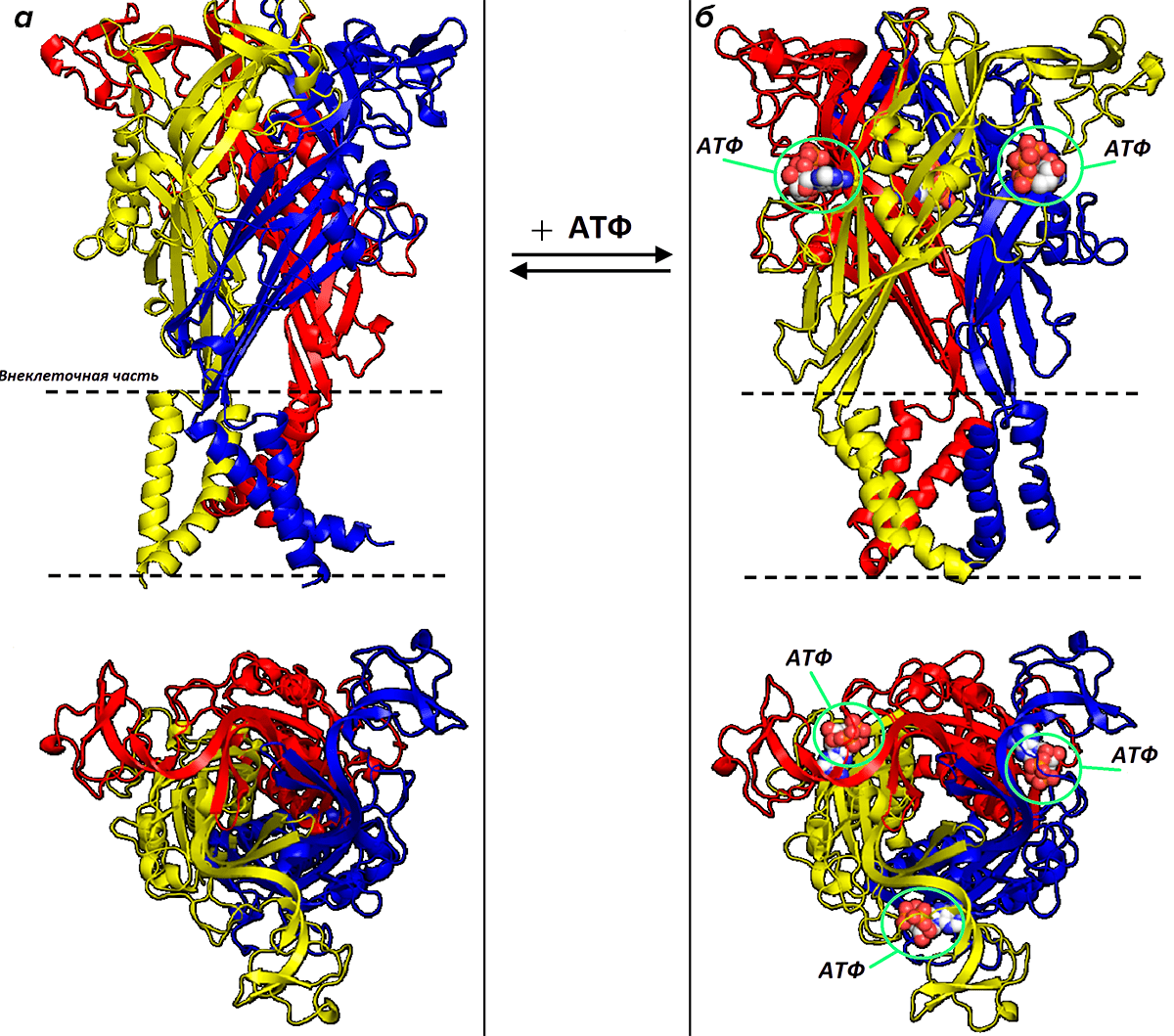
Единственным эндогенным ключом к дельфиньему братству является АТФ. Три молекулы этого нуклеотида встраиваются в карманы между «дельфинами» и производят открытие ионного канала (рис. 16). Все рецепторы, несмотря на одинаковую структурную укладку и тесные родственные связи, по-разному реагируют на АТФ.
Рисунок 16. Механизм работы P2X-рецептора. а — Закрытый P2X-рецептор (вид сбоку и сверху). б — Открытый рецептор. Для активации рецептора и открытия канала необходимо встраивание трех молекул АТФ (выделены зеленым) в консервативные сайты связывания.
Кому-то из P2X хватает маленькой концентрации АТФ, чтобы открыться и быстро схлопнуться обратно, на время потеряв чувствительность. Кто-то продолжает работать без остановки, пока рядом есть АТФ. Уникальный в своем роде P2X7-рецептор имеет несколько режимов работы: один для низких и один — для высоких концентраций агониста. При продолжительном воздействии большого количества АТФ он раскрывается еще шире, образуя гигантскую пору в клеточной мембране. От таких огромных порталов во внешний мир клетка явно будет не в восторге.
Агонист активатор рецептора. В противоположность антагонисту, который мешает его работе.
Рисунок 17. Классификация P2X-рецепторов и их гетеромеров. Выделенный темно-серым P2X6-тип не может формировать рецептор без помощи других типов, а вот у P2X7 (красный), наоборот, отсутствуют гибриды с другими типами рецепторов (пока спорно).
Стоит отдельно сказать о существовании в организме «химер», которые слеплены из субъединиц различных типов и комбинируют их свойства (рис. 17). Например, субъединица P2X6 может существовать только в виде микса с субъединицами других типов. А вот уникальный P2X7 настолько отличается от других, что формирует рецептор исключительно из своих субъединиц [21].
P2X-рецепторы — это неселективные ионные каналы, которые не специализируются на каком-то конкретном типе ионов. Это весьма разносторонние личности. Они пропускают ионы калия, натрия, кальция, а иногда и хлора. А еще через них, как песок сквозь пальцы, калий может вытекать наружу. Однако именно способность пропускать кальций делает их такими многофункциональными. Ведь ионы кальция — это важнейший передатчик внутриклеточных сигналов в организме (один из вторичных мессенджеров), от него зависят многие каскады реакций. Наше сердце бьется в такт благодаря строго выверенным дозам кальция и не без помощи P2X-рецепторов [22]. Не зря кальцию посвящен целый научный журнал под названием Cell Calcium. Никакие другие ионы такой чести не удостаивались. Как тебе такое, натрий?
P2X-рецепторы выполняют самые разнообразные функции в организме, а каждое новое исследование открывает целый пласт процессов, в которые они оказываются вовлечены. Часто, благодаря их схожести, роли «иксов» пересекаются друг с другом, в зависимости от их локализации. Главными из них принято считать регуляцию сердечно-сосудистой деятельности и передачу сигналов в нервной системе. Тем не менее для того, чтобы рассказать про каждый аспект их влияния, придется написать целую книгу, поэтому пробежимся по наиболее важным и интересным функциям.
Например, семявыводящие протоки у мужчин сокращаются во время эякуляции при помощи P2X1-рецептора. Мыши-самцы с нокаутированным геном этого рецептора не могли размножаться. Благодаря чему его даже рассматривали как возможную мишень для создания мужских противозачаточных средств [23], [24]. В кровеносной системе он опосредует сокращение сосудов в ответ на АТФ, который выделяется совместно с норадреналином в качестве нейромедиатора симпатических нервов [25].
P2X2 и его гибриды широко распространены в нейронах, где передают сигналы на синапсах и регулируют нашу нервную деятельность, воздействуя на другие нервные рецепторы, такие как GABA- [26] или NMDA-рецептор [27]. Также известно, что мыши с мутировавшим геном P2X2-рецептора теряли слух [28].
Активация P2X3-рецептора вызывает у нас сокращение мочевого пузыря при мочеиспускании. А еще он крайне необходим в работе вкусовых рецепторов, активации макрофагов, агрегации тромбоцитов и создании болевого сигнала [29].
Что касается последнего, то P2X3-рецептор выступает в роли проводника острой, ноцицептивной боли. К такой можно, например, отнести как боль от пореза пальца листом бумаги, так и боль, вызванную гибелью тканей в результате воспаления. Оказалось, что его эффективные блокаторы можно обнаружить в природе. В Институте биоорганической химии (ИБХ РАН) группа ученых под руководством академика Евгения Васильевича Гришина и при участии Александра Александровича Василевского открыла и выделила пептид из яда пауков рода Alopecosa. Этот пептид показал эффективное ингибирование тока ионов через P2X3-рецептор и был назван «пуротоксин-1» (то есть токсин, блокирующий пуриновые рецепторы) [30]. Новый токсин составил серьезную конкуренцию уже известным синтетическим низкомолекулярным блокаторам P2X-рецепторов. Он показал отличное обезболивающее действие в экспериментах на мышах. При этом его эффективная концентрация оказалась на три порядка меньше, чем у известного низкомолекулярного блокатора A-317491 (для достижения сопоставимого анальгетического эффекта). Пуротоксин-1 прошел все стадии доклинических испытаний и, вполне возможно, через несколько лет окажется на фармацевтическом рынке в качестве ультрасовременного анальгетика. Можно лишь отметить, что яды животных всё еще остаются удивительным источником уникальных биологически активных соединений, которых создали лучшие «биохимики» на этой планете — эволюция и естественный отбор.
P2X4-рецептор экспонируется на клетках эндотелия сосудов и приводит (в отличие от P2X1) к их релаксации. Таким образом он реагирует на АТФ, который высвобождается из эндотелия в условиях стресса при сжатии сосудов (как бы балансирует чаши весов, чтобы мы случайно не померли от гипертонии) [31]. Также он увеличивает сокращение сердечной мышцы [32]. В общем, P2X1 и P2X4 — это те рецепторы, воздействуя на активность которых мы сможем снизить риски сердечно-сосудистых заболеваний. Весьма перспективные мишени для разработки лекарств.
А еще рецепторы P2X4 и P2X7 собаку съели на клеточном иммунитете, воспалении и программируемой гибели клеток [33], [34]. Они активно экспонируются на большинстве иммунных клеток, таких как макрофаги, дендритные или тучные клетки. Без них не обходится ни одно инфекционное заболевание, травмы или вечеринки по поводу внезапных аллергических реакций. У них также самая высокая степень родства и сходства аминокислотных последовательностей [35]. Есть работы, которые говорят о возможности существования гетеромеров между ними на моделях in vitro [36], хотя пока это не было подтверждено в клетках реального организма.
Рисунок 18. Схема субъединицы P2X7-рецептора. Отличительной особенностью этого рецептора является длинная С-концевая цепочка, уходящая вглубь клетки.
Про P2X7-рецептор стоит поговорить отдельно. Ведь это целый кладезь сюрпризов. Попав впервые в центр внимания ученых в 1980 году, он здорово смутил исследователей. Его даже хотели вынести в новое отдельное подсемейство — P2Z [37]. Но, установив аминокислотную последовательность, немного успокоились и оставили в «иксах» [38] (хотя название P2Z нет-нет, да проскальзывает). Отличает его от прочих «дельфинчиков» более длинный С-конец, уходящий вглубь клетки. Это значительно увеличивает размер его субъединицы и существенным образом влияет на сигнальные свойства самого рецептора (рис. 18) [39].
Он обладает гораздо меньшей чувствительностью к АТФ, чем другие его собратья. Но как только агониста станет слишком много, и он начнет поступать непрерывно, — P2X7 уже не остановить. Через него начинает входить кальций и вытекать наружу калий, а это подает сигнал иммунным клеткам о том, что нужно мобилизовать тяжелую артиллерию и вовсю штамповать провоспалительные цитокины [34]. Делают они это при помощи создания больших молекулярных каруселей, которые называются инфламмасомами. Это вспомогательные белковые комплексы, которые участвуют в созревании и высвобождении интерлейкинов. Таким образом, рецептор P2X7 активирует сборку инфламмасомы NLRP3 и, следовательно, служит ключевым звеном в продукции интерлейкина-1β. Полюбоваться этим процессом в подробностях можно на видео:
Видео. Активация и сборка инфламмасомы NLRP3. Ее сборку и последующий синтез интерлейкина-1β напрямую связывают с активацией P2X7-рецепторов и оттоком через них ионов калия. Однако конкретный механизм запуска сборки остается пока под вопросом. На начальном этапе присутствующие в клетке субъединицы инфламмасомы активируют свои связывающие домены в ответ на сигнал стресса (в данном случае на повышенную активность P2X7-рецептора, вызванную всплеском уровня внеклеточного АТФ). Благодаря этому они становятся способны к олигомеризации и образованию сигнальных комплексов в виде колеса. LRR-домены (от англ. leucine-rich repeat), богатые остатками лейцина, располагаются снаружи колеса, в то время как белковые домены пирина (PYD — сокр. от англ. PYRIN domain) формируют круглую платформу в центре. Далее в дело вступает адаптерный белок ASC (сокр. от англ. Apoptosis-associated speck-like protein containing a CARD, где CARD — это caspase-recruitment domain). Этот белок имеет свой пириновый домен (PYD) со стороны N-конца, что позволяет ему соединяться с одноименным доменом инфламмасомы и формировать длинную ось на инфламмасомном кольце. На получившейся оси выступают наружу те самые C-концевые CARD-домены, необходимые для активации каспазы-1. Плавающие в цитозоле молекулы каспазы цепляются за эти домены и образуют активные димеры, в результате чего сами себя активирующие ферменты начинают бодро отрезать от незрелых про-интерлейкинов-1β куски белка, дающие им приставку про-. Каспаза-1 также отрезает куски от про-гасдермина-1, аналогичным образом переводя его в зрелую форму. Активированные молекулы гасдермина-1 формируют поры в клеточной мембране, что приводит к пироптозу — программируемой некротической гибели клетки в результате лизиса мембраны. Сформировавшиеся провоспалительные цитокины, в том числе полученные при помощи NLRP3-инфламмасомы интерлейкины-1β, вырываются наружу, сея хаос и неся воспаление окружающим тканям.
Как я уже говорил, при продолжительном действии большой концентрации агониста, в P2X7-рецепторе открывается большая пора, способная пропускать в клетку крупные растворимые молекулы размером до 900 дальтон. Длительное открытие такой макропоры, в зависимости от типа клеток, инициирует некроз или апоптоз. Причины запуска этих процессов пока непонятны, однако доказано, что открытие макропоры напрямую увеличивает продукцию провоспалительных цитокинов и процент гибнущих клеток. По некоторым версиям, макропора многократно усиливает отток ионов калия, который и так происходит при нормальной работе канала, либо же просто нарушает осмотическое давление клетки. Также продолжительная работа P2X7-рецептора ведет к слиянию мембран активированных макрофагов и образованию гигантских многоядерных клеток с их последующей гибелью. Такое свойство P2X7-рецептора может оказаться полезным, если в иммунные клетки закралась и спряталась болезнетворная бактерия (например, чумная палочка или сальмонелла). Ну или целый внутриклеточный паразит, такой, как риккетсия [41]. Механизм открытия большой поры пока остается загадкой и требует дальнейшего изучения. Ясно лишь, что это как-то связано с удлиненным C-концом и его сайтами связывания [42].
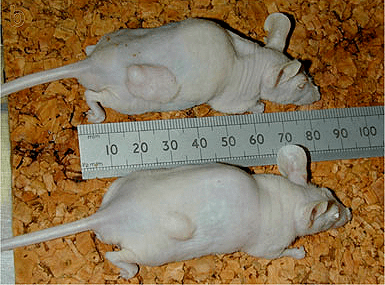
Рисунок 19. Воздействие высоких концентраций АТФ на P2X7-рецептор убивает опухолевые клетки у мышей. На рисунке изображен эксперимент по влиянию АТФ на подсаженные мышам опухоли гормонорезистентного рака простаты DU145. Исходя из свойств P2X7-рецептора, ожидалось, что регулярное воздействие большого количества АТФ станет цитотоксическим для клеток опухоли, либо активирует клеточный иммунитет у окружающих ее тканей. На фото продемонстрирован результат эксперимента спустя 60 дней — мышь снизу получала инъекции АТФ до 25 мМоль напрямую в опухоль. Мышь сверху не получала никакого лечения.
В желании использовать способности P2X7-рецептора в убийстве клеток высокие концентрации АТФ даже кололи лабораторным мышкам напрямую в подсаженные опухоли. В целом, помогало. Размер опухоли существенно уменьшался (рис. 19) [43].
Позже выяснилось, что раковые клетки умеют выкручиваться из любой ситуации и выставляют у себя на мембранах бракованные P2X7 (с точечными мутациями и аминокислотными заменами). Они спокойно пользуются благами ионного канала и кальциевого обмена, вот только мутировавший рецептор уже не может открыть смертоносную пору и уничтожить зловредную опухоль [44]. Да и нарушение работы рецептора в здоровых клетках может превратить их в опухолевые, если рецептор начнет нарушать гомеостаз и баланс ионов кальция [45]. Увы, в вопросах канцерогенеза всегда всё неоднозначно.
Нарушениям в работе этих рецепторов уже приписывают целый медицинский справочник заболеваний. В длинном списке есть всё, что касается боли, воспаления и гибели клеток: ревматоидный артрит, диабет, циррозы и фиброзы, аллергия, болезни Крона, Альцгеймера и Паркинсона, амиотрофический склероз, инфаркты и инсульты, рак. Даже психиатры стали засматриваться на P2X7. Повышенные уровни его синтеза в головном мозге наблюдаются у людей, страдающих депрессией, биполярным расстройством или острым психозом [47].
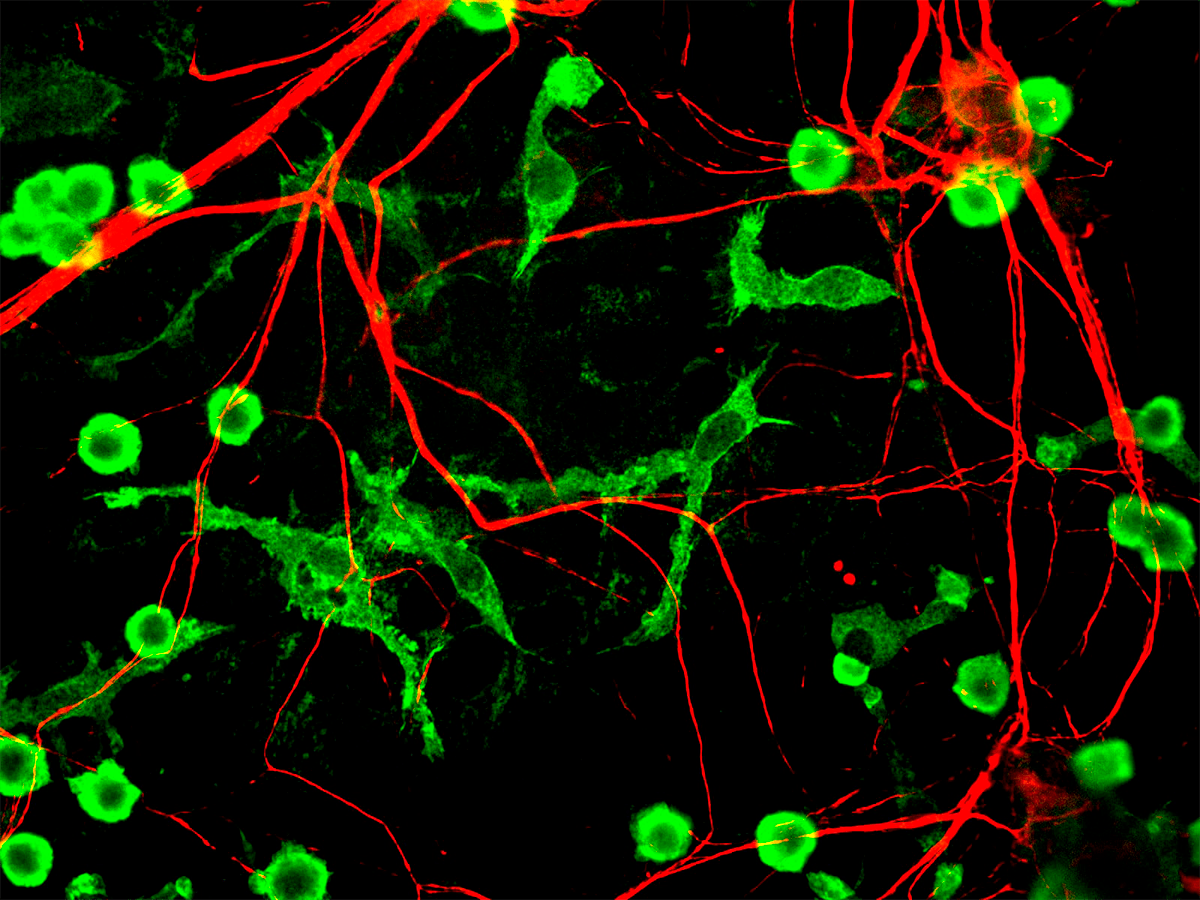
У невропатологов здесь тоже свой интерес. Выяснилось, что чрезмерная активация P2X4- и P2X7-рецепторов в микроглии (рис. 20) может привести к нейронному воспалению [48].
Микроглия это резидентные макрофаги (то есть прикрепленные к «месту жительства» иммунные клетки-поглотители) в центральной нервной системе. Поскольку благодаря гематоэнцефалическому барьеру (ГЭБ) нервная система в норме стерильна, этим иммунным клеткам там особенно не разгуляться. Поэтому микроглия расширила свой функционал и выполняет для нейронов скорее роль техподдержки, регулируя их рост, но и о своей защитной функции при случае не забывает.
Рисунок 20. Микроглия. Клетки микроглии (окрашены зеленым) и нервные волокна (окрашены красным).
Это может обернуться гибелью нейронов и параличом. А еще стать причиной гипервозбудимости в рогах спинного мозга, что приводит к мучительным болевым синдромам. В том числе аллодинии и гипералгезии — неадекватной реакции на болевые и физические стимулы. Непросто жить, когда обычное поглаживание по руке взрывается в мозге болью тысячи кинжалов (рис. 21).
Рисунок 21а. Жизнь — боль. Эти картинки, на мой взгляд, лучше всего подходят для описания того, что испытывают люди со сверхактивацией P2X4- и P2X7-рецепторов в микроглии.
Рисунок 21б. Жизнь — боль. Эти картинки, на мой взгляд, лучше всего подходят для описания того, что испытывают люди со сверхактивацией P2X4- и P2X7-рецепторов в микроглии. На фото — Андраш Арато.
Конечно же, научные лаборатории активно ведут поиск блокаторов таких рецепторов, чтобы все эти неприятные заболевания предотвратить. Крупнейшие фармацевтические компании, такие как Abbot и AstraZeneca, от них не отстают [49]. Некоторые бизнес-проекты создаются исключительно для поиска и разработки лекарственных средств, действующих на P2X-рецепторы. Тут я имею в виду крупный исследовательский проект европейских ученых PurinesDX.
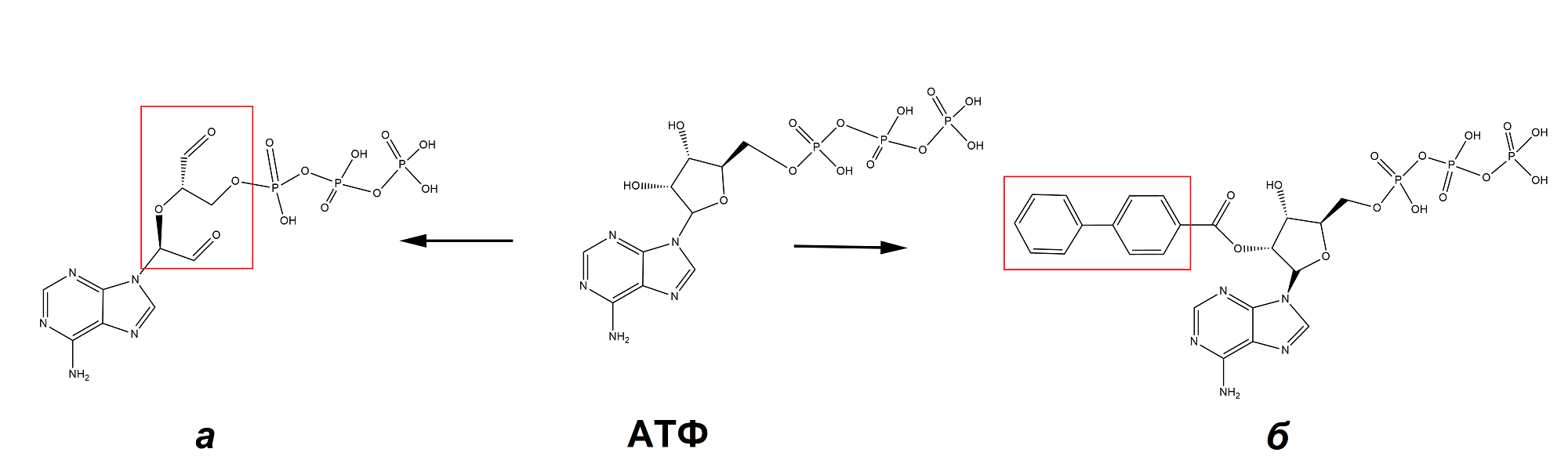
Блокаторы бывают двух видов. Первые конкурируют за место под солнцем с АТФ, по аналогии с кофеином для P1-рецепторов. Обманув P2X-рецептор, они занимают карманы для связывания АТФ, но, в отличие от привычного нуклеотида, не приводят к открытию канала. Карманы для АТФ выстланы положительно заряженными аминокислотными остатками лизина. Для этого хорошо подходят отрицательно заряженные молекулы, часто очень похожие на АТФ структурой. Так, например, блокатором P2X7-рецепторов служит периодатно окисленный АТФ (о-АТФ) (рис. 22а). Однако такие небольшие модификации природного агониста могут давать и обратный эффект: фенил-бензоат-АТФ (рис. 22б), напротив, открывает P2X7-рецептор в сорок раз эффективнее, чем «родной» эндогенный АТФ (то есть для открытия канала его потребуется в сорок раз меньше) [50].
Рисунок 22. Искусственно созданные модуляторы P2X7-рецепторов. а — Периодатно окисленный аденозинтрифосфат — эффективный блокатор P2X7-рецептора. б — Бензоильное производное АТФ — эффективный агонист P2X7-рецептора.
структуры созданы автором статьи при помощи ChemDraw Ultra 12
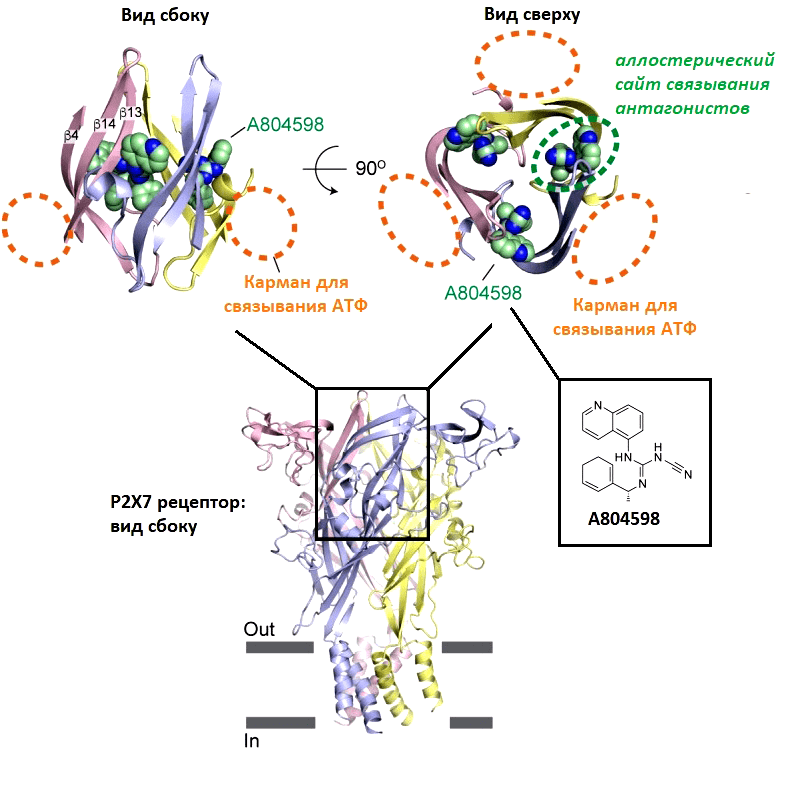
Второй тип блокаторов — это так называемые аллостерические лиганды (то есть соединения, которые находят свое место для связывания с рецептором и не конкурируют за него с АТФ) [62]. Часто такие вещества выполняют роль заглушек, что встают между субъединицами и мешают им раскрываться. В 2016 году тот же Каватэ получил кристаллическую структуру P2X7-рецептора в связке с различными синтетическими блокаторами [51]. Молекулы антагониста заняли полости, образованные ароматическими остатками между двумя субъединицами (рис. 23). Радует, что таких больших кармашков в этом месте нет у других типов рецепторов, а значит, мы можем подобрать очень избирательный блокатор именно для P2X7. Сюда прекрасно подойдут молекулы с плоскими ароматическими циклами, образуя сэндвич-подобную структуру, типичную для таких взаимодействий в белках.
Рисунок 23. Трехмерная модель P2X7-рецептора. В отдельных врезках в верхней части рисунка продемонстрированы виды сбоку и сверху на недавно найденный аллостерический сайт связывания, в который заходит один из современных антагонистов этого рецептора под шифром А804598. Этот аллостерический регулятор обладает двумя парами конденсированных ароматических гетероциклов, которые с любой стороны легко образуют сэндвич-подобные структуры с ароматическими аминокислотными остатками аллостерического сайта. Новые сайты связывания с антагонистом расположены совсем рядом с сайтами связывания АТФ и являются уникальным структурным явлением для данного типа рецепторов.
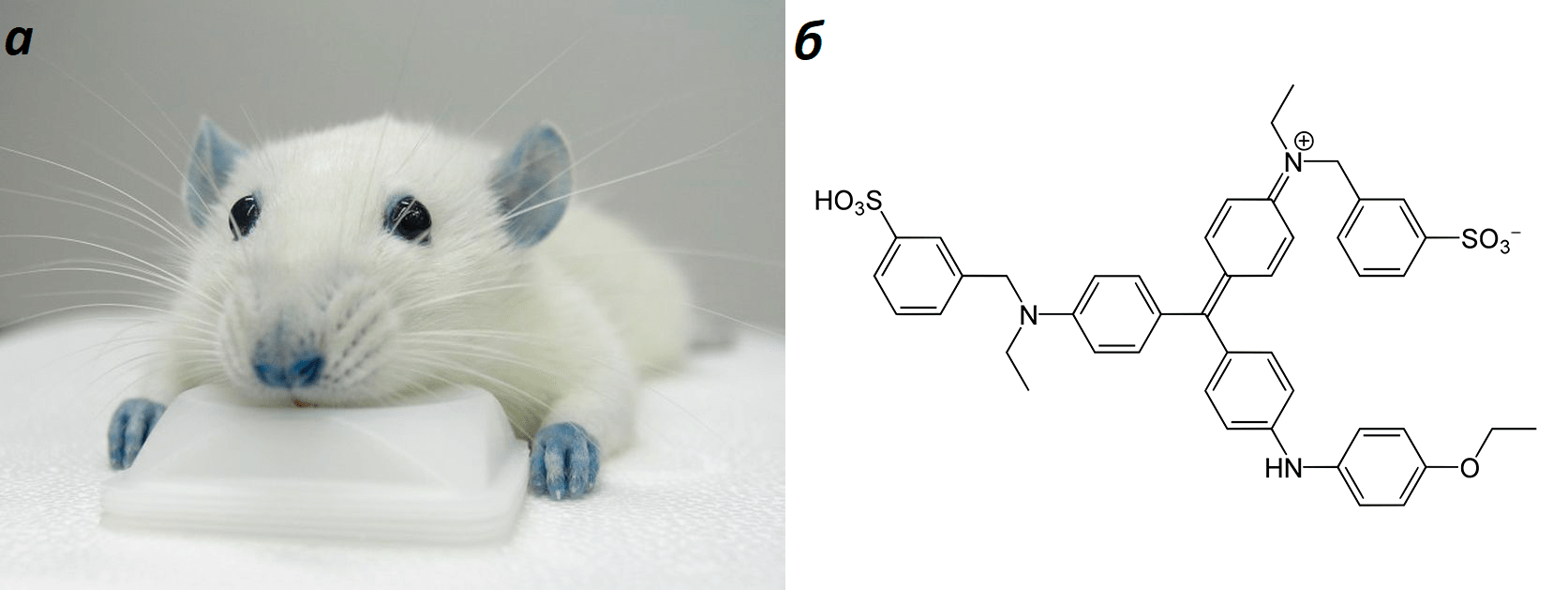
Порой волшебная пилюля принимает неожиданные формы. Например, было показано, что эффективным блокатором P2X7-рецептора является BBG, он же бриллиантовый синий, он же кумасси (рис. 24б). Этот краситель хорошо известен всем, кто занимается молекулярной биологией. В XIX веке им красили шерсть, а сейчас он используется для окрашивания белков на электрофорезе. В далеком уже 2009 году в медицинском центре университета Рочестера, что в штате Нью-Йорк, проводилось одно исследование, в ходе которого несчастным мышкам повредили позвоночник, после чего их лечили инъекциями BBG [52]. Предполагалось, что вещество сумеет остановить вызванный травмой очаг воспаления и предотвратит гибель нервных тканей. Лечение оказалось весьма эффективным, некоторые мыши даже восстановили двигательные функции и смогли ходить, немного прихрамывая. Такой вот Иисус от мира молекулярной фармакологии. Контрольные мыши, которые не получали лечения, так и остались парализованными. Правда, у данного препарата был необычный побочный эффект — он активно окрашивал все кровеносные сосуды в насыщенный синий цвет (рис. 24а). Синими у мышей становились даже глаза. Фанатам «Дюны» должно понравиться.
Рисунок 24. BBG течет во мне, я един с BBG. а — Вполне ожидаемый побочный эффект, если решил лечить парализованных мышей известным красителем. б — Структура BBG.
История с BBG — это лишь один из сотен примеров. Ежегодно патентуется множество соединений, но большая их часть отсеивается на стадии клинических испытаний [49]. Одни оказываются токсичны, другие малоэффективны, третьи недостаточно селективны, а четвертые не могут проходить гематоэнцефалический барьер и достигать нервной системы. Хотя многие и показывают себя весьма эффективными in vitro и продаются коммерческими фирмами как селективные антагонисты для различных исследований. Тем не менее поиск идеальных блокаторов P2X-рецепторов всё еще остается актуальной задачей для современной фармакологии.
P2Y и P1: пурины на службе у GPCR
Скажем еще пару слов о системе, разработанной в ходе эволюции для продуктов распада АТФ. Они представлены в виде GPCR — метаботропных рецепторов, родственных светочувствительному белку родопсину [53]. Иначе говоря, это такие рецепторы, которые, активируясь, воздействуют на универсальные внутриклеточные посредники — G-белки. Таким образом они запускают выделение небольших, но очень активных молекул. Эти молекулы — так называемые вторичные мессенджеры — заметно влияют на клеточные процессы и инициируют в клетках каскады биохимических реакций.
Первыми на очереди стоят P2Y-рецепторы. Выглядят они вполне типично для GPCR: семь спиралей, змейкой пронизывающих насквозь клеточную мембрану (рис. 25). При активации они изменяют свою конформацию и таким образом переключают G-белки. Всего их в пределах семейства Y восемь разновидностей (с непростой нумерацией): Y1, Y2, Y4, Y6, Y11, Y12, Y13, Y14. Словно корпорация Майкрософт, нумерующая свои операционные системы. Это объясняется историей открытия и тем, что при их клонировании некоторые GPCR-рецепторы ошибочно заносились в пуриновые. Позже классификация устаканилась, и лишнее пришлось убрать.
Рисунок 25. P2Y12-рецептор со своим агонистом АДФ (фиолетовый). Типичный GPCR: серпантин из семи соединенных спиралей, пронизывающий клеточную мембрану (серая полоса). N-конец и три петли снаружи клетки, С-конец и три петли внутри.
«Игреки» распространены практически во всех типах тканей и выполняют ряд важных функций [54]. В нервной системе они регулируют нейрогенез, рост и дифференцировку нервных клеток. В поджелудочной железе одни P2Y стимулируют выработку инсулина, а другие, наоборот, ее прекращают [55]. В кровеносной системе запускают агрегацию тромбоцитов и повышают свертываемость крови. Кстати, именно Бёрнстоку удалось открыть и помочь вывести на рынок препарат с благозвучным названием клопидогрел, который как раз блокирует такие рецепторы (а именно P2Y12) и предотвращает образование тромбов [56]. Некоторые P2Y-рецепторы способствуют расслаблению гладкой мускулатуры в стенках кровеносных сосудов (включая сосуды головного мозга), тем самым регулируя наше с вами кровяное давление. Чем не мишень для лечения мигрени и различных сердечно-сосудистых заболеваний [57]?
А еще P2Y (вместе с P2X) вовлечены в процессы воспаления и иммунного ответа [58]. А где иммунный ответ, там, вероятно, и злоупотребление его полномочиями, которое приводит к разрушению «попавших под раздачу» клеток. Разрушенные клетки со временем будут замещены соединительной тканью [59]. Врачи называют этот процесс фиброзом. Пользуясь случаем, передаем горячий привет циррозу печени [60] и синдрому сухого глаза [61] (крайне неприятное заболевание, которое рано или поздно может привести своих обладателей к слепоте). Как вы уже поняли, такая широкая распространенность P2Y-рецепторов и многообразие их свойств — это просто кладезь для разработки лекарственных препаратов. Что, впрочем, справедливо для большинства GPCR — читайте об этом в статье: «Аллостерические регуляторы GPCR: ключи от всех замков» [62].
Рисунок 26. Кофеин неспроста напоминает молекулу аденозина без рибозы. Этого двойника растения шлифовали миллионы лет, чтобы изводить докучающих насекомых, блокируя их аденозиновые рецепторы. А уже потом мы стали делать эспрессо.
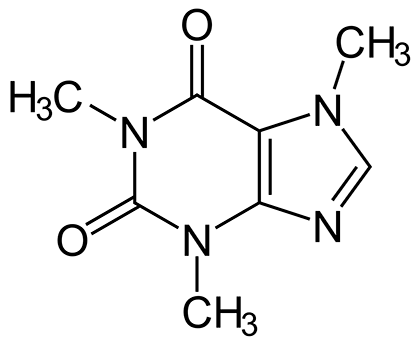
Другими важными GPCR в пуриновой системе сигнализации служит семейство P1-рецепторов. Оно состоит из четырех представителей — P1, P2A, P2B и P3. Эти рецепторы отвечают за самые разнообразные процессы. В нервной системе их работа лежит в сфере пресинаптического торможения. Они также вызывают у нас ощущение усталости, когда аденозина в ЦНС накопится слишком много в результате нервной деятельности и распада АТФ. Благодаря P1-рецепторам мозг понимает, что ему пора отдохнуть и обновить свои системы при помощи сна. Ну а подавляются эти рецепторы, как уже было сказано ранее, метилксантинами. Ведь метилксантины структурно очень похожи на аденозин без рибозы. Настолько похожи, что рецепторы не видят подмены и заглатывают фальшивку, а на деле заглушку. К метилксантинам относится и хорошо знакомый нам кофеин (рис. 26). Именно так кофе помогает нам взбодриться. Если сильно пристраститься к кофеину, нервная система начинает производить больше аденозиновых рецепторов. Однако если прекратить употреблять этот кофейный алкалоид, то аденозин займет освободившиеся места на этой куче рецепторов, и мы будем острее ощущать сонливость без привычной дозы бодрящего напитка. Более подробно о действии кофе читайте в статье «Влияние кофеина» на «Биомолекуле» [63].
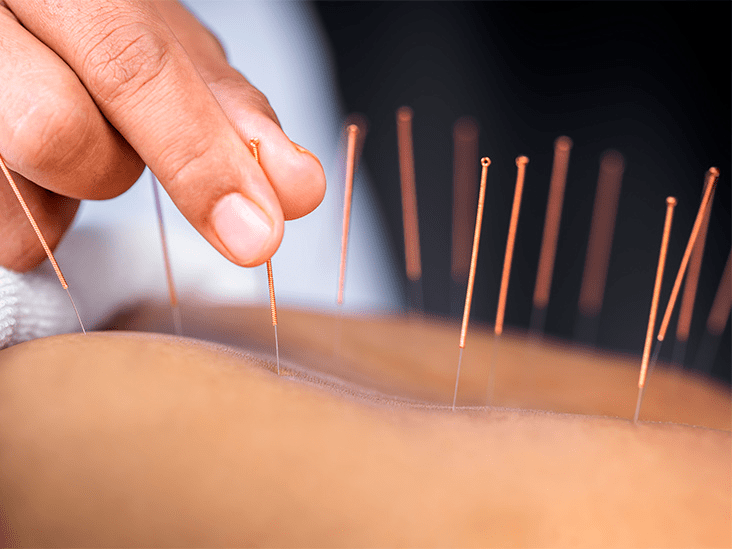
Также интересный вывод сделали ученые при изучении акупунктурных методик лечения (рис. 27). Утверждается, что иглоукалывание стимулирует локальный выброс аденозина, который воздействует на P1А1-рецептор и тем самым помогает снять острую боль и воспаление. Конечно, и тут не обошлось без АТФ. Сомневались в наличии научных доказательств в пользу иглоукалываний? И правильно, в общем-то, делали. Но, кажется, теперь такие доказательства имеют место [64].
Рисунок 27. Процедура иглоукалывания. По одному из предложенных учеными механизмов — игла стимулирует локальный выход АТФ, который разлагается внеклеточными ферментами до аденозина. Аденозин воздействует на пресинаптические P1A1-рецепторы, которые ингибируют работу (то есть препятствуют потенциалу действия) периферических нервных волокон, отвечающих за передачу болевого сигнала в центральную нервную систему.
Помимо этого, у аденозиновых P1-рецепторов в организме множество функций, однако мы не будем останавливаться на них. Подробнее об этих рецепторах и о том, как их обманывают растительные метаболиты, на «Биомолекуле» уже есть интересная статья, с которой я всем советую ознакомиться: «Аденозиновые рецепторы: история великого обмана» [65].
У эволюционных истоков
Пуриновые и пиримидиновые нуклеотиды возникли на Земле еще в пребиотическую эпоху. И они же стали причиной эпохи биотической [66], [67]. Ведь без нуклеотидов не появились бы ДНК и РНК, которые составляют основу жизни в привычном нам понимании. АТФ уже на ранних этапах стал главным источником энергии для всех живых организмов. Это был невероятно важный эволюционный выбор. Благодаря нему сформировались целые ферментативные системы для использования АТФ в качестве главной рабочей лошадки, что, в свою очередь, повлекло за собой создание универсальной сигнальной системы, основанной на ионах кальция (Ca 2+ ).
Почему опять кальций, спросите вы? Из-за чего он стал таким важным? Дело в том, что, по выбранному природой сценарию, этого кальция в цитоплазме должно находиться крайне мало. Ведь при большом количестве могут образоваться нерастворимые фосфаты кальция, а использовать по уши фосфатированный АТФ для энергетики клетки стало бы затруднительно. Соответственно, поступающий кальций должен был задействоваться в физиологических процессах и утилизироваться из клетки. Это и повлияло на его роль в качестве вторичного мессенджера. Сюда также вписывается теория о повышенной щелочной среде первичного океана (а жизнь на Земле начинала развиваться именно в таких условиях), в котором ионов кальция было мало (дело, опять же, в плохой растворимости гидроксидов кальция). В наших клетках большая доля кальция сосредоточена в кальциевых депо эндоплазматического ретикулума, из которых он выделяется для передачи сигнала, а также он может поступать снаружи благодаря ионным каналам вроде P2X.
Примитивным организмам уже на первых порах понадобились рецепторы для оценки окружающей среды, будь то древний океан или вулканические гейзеры (для теплолюбивых архей). По мере появления многоклеточности также встал вопрос о передаче информации от одной клетки к другой. Тут мы можем строить лишь догадки, но накопленные знания по биологии и филогении примитивных организмов позволяют нам сделать кое-какие выводы. По-крайней мере, можно сойтись во мнении, что первыми передатчиками стали ионотропные рецепторы, а методом межклеточной коммуникации — обычная диффузия.
Собственно, нейромедиаторы и сейчас гуляют через синаптическую щель благодаря диффузии [68]. На роль диффундирующих передатчиков выбор был невелик — ионы и мелкие растворимые молекулы, присутствующие в самих клетках. Чего-чего, а ионов первобытный океан содержал в избытке, поэтому их (кроме, вероятно, протонов) можно исключить. В качестве межклеточных посыльных годились растворимые аминокислоты и их производные (одними из самых древних считаются рецепторы глутамата); протоны, которые клетки накапливали в процессе метаболизма; а также некоторые газообразные молекулы, такие как монооксид азота (NO). Ну и, конечно же, пурины, особенно пурины фосфатированные, благодаря их хорошей растворимости. Есть предположение, что первые АТФ-рецепторы использовались только для реакции на сигналы стресса при разрушении клеток, а литический путь попадания этого нуклеотида во внеклеточную среду был единственно возможным. Однако по мере усложнения организмов эта система развилась до выполнения и других функций, а АТФ стал выделяться направленно и дозированно.
У ракообразных, например, пуринергические рецепторы играют важнейшую роль в обонянии и вкусе. Омары (рис. 28) могут учуять в морской воде даже мельчайшие крохи АТФ и АМФ. Вкусно пахнущий аденозинтрифосфат сигнализирует им о раненой добыче, а вот его деградировавшая версия в виде монофосфата будет отталкивать разборчивых членистоногих, сообщая о том, что предполагаемая добыча уже испортилась.
Рисунок 28. Европейский омар (Homarus gammarus). Это ракообразное обладает острым нюхом на пурины. Запах АТФ будет для омаров всё равно что для нас запах выпечки или жареного мяса и будет сообщать им о свежей добыче.
Многие планктонные организмы обзавелись целыми наборами дефосфорилирующих ферментов, чтобы быстро разлагать выделяемые нуклеотиды и маскироваться от хищников. АТФ также важен для восприятия пищи и формирования пищевого поведения у различных членистоногих паразитов, таких как муха цеце, комары или клещи. Активация АТФ-рецепторов в эритроцитах отвечает у них за чувство насыщения и говорит, что крови эти паразиты выпили достаточно.
А вот АТФ-рецепторы растений были клонированы и охарактеризованы сравнительно недавно — в 2014 году [70]. Назвали их DORN-1 и DORN-2. Они выполняют в растениях функции стресса, схожие с аналогичными у P2X-рецепторов животных. Реагируя на повышенные концентрации внеклеточного АТФ, в клетки растений входит кальций, который запускает митоген-активированную протеинкиназу и приводит к повышенной продукции активных форм кислорода. Всё это — ярчайшие маркеры клеточного стресса, поэтому растение начинает активно экспрессировать защитные гены. В общем, теория о первоначальной роли АТФ-рецепторов в очередной раз подтверждается.
Также ученые доказали, что хищное растение венерина мухоловка захлопывает свою пасть, реагируя на молекулы АТФ [71]. Попав в ловушку, насекомое задевает механочувствительные волоски, которые стимулируют выброс АТФ во внеклеточную среду. Под действием этого нейромедиатора срабатывает потенциал действия, благодаря которому растение закрывает створки, чтобы превратить муху в питательное удобрение (рис. 29).
Рисунок 29. Венерина мухоловка ловит муху
Единообразие функций и строения пуринорецепторов среди живых организмов поражает. Те же P2X-рецепторы можно найти и у одноклеточных эукариот, хоть и сходство с таковыми у млекопитающих будет довольно низким. Тем не менее такие рецепторы всё еще сохраняют свою микромолярную чувствительность к АТФ, а появились они более миллиарда лет назад. Считается, что именно ионные каналы по типу P2X-рецепторов стали первыми ласточками пуринергической передачи сигнала, а уже значительно позже за ними последовали метаботропные рецепторы, сопряженные с G-белком, такие как P0, P1 или P2Y. Изучая и сравнивая гены, кодирующие пуринорецепторы в различных организмах, ученые смогут многое почерпнуть о времени эволюционного расхождения различных форм жизни на планете.
Пуринергическая сигнализация, опосредованная АТФ и родственными нуклеотидами, присутствует на всех этапах эволюции живых существ и стоит буквально у истоков жизни.
Благодарности
Автор благодарит своего научного руководителя, д.б.н. Аминина Дмитрия Львовича за наставление на путь исследований в данной тематике и неоценимую помощь в работе. Эта статья посвящается памяти Джеффри Бёрнстока, который ушел из жизни 2 июня 2020 года, прожив долгую и плодотворную научную жизнь.