Аперта диагноз что такое
Аперта диагноз что такое
Синдром Апера (Apert), или акроцефалосиндактилия, является редко встречающейся аномалией, которая характеризуется мальформациями черепа, лица и конечностей и в 50% случаев сопровождается умственной отсталостью различной степени тяжести. Впервые этот синдром был описан Уитоном (Wheaton) в 1894 году и обобщен Апером (Apert) в 1906 году, который представил 9 клинических наблюдений этой патологии.
По некоторым данным частота встречаемости синдрома Апера (Apert) составляет от 0,0625 до 0,1 на 10 000 родов. Вследствие высокого уровня неонатальной смертности ожидаемая распостраненность в общей популяции приблизительно оценивается на уровне от 5 х 10 6 до 1 х 10 5 на 10 000 новорожденных. Соотношение по половому признаку составляет 1:1.
Синдром Апера (Apert) представляет собой аутосомное нарушение с доминантным типом наследования. Большинство случаев возникает спорадически и обусловлено появлением новых мутаций. Описана связь возникновения патологии с увеличением возраста родителей.
При развитии заболевания вследствие новой мутации риск рецидива маловероятен. Если один из родителей является носителем заболевания, риск рецидива составляет 50%.
Наиболее типичными признаками синдрома Апера (Apert) являются краниосиностоз (с вовлечением коронарного шва при данном заболевании), двухсторонняя симметричная синдактилия конечностей (варежкообразные кисти и стопы) и гипоплазия срединных отделов лица. Дополнительные признаки, появляющиеся с переменной частотой, могут быть представлены:
• скелетными аномалиями, такими как уменьшенная по высоте и широкая голова; высокий «башенный» мозговой череп (акроцефалия); выступающий лоб; гипертелоризм и проптоз глазных яблок; глубокая переносица с носом, напоминающим клюв попугая; гипоплазия верхней челюсти; прогнатия;
• пороками сердца, такими как стеноз ствола легочной артерии, «верхом сидящая» аорта и дефекты межжелудочковых перегородок;
• аномалиями центральной нервной системы, такими как гидроцефалия, мальформации мозолистого тела и лимбических структур, аномалии извилин, гипоплазия белого вещества и гетеротопия серого вещества.
Имеются сообщения о пренатальной диагностике с помощью ультразвукового исследования и фетоскопии во всех триместрах беременности. Эхографическим маркером данной патологии в первом триместре также может быть увеличение толщины воротникового пространства.
Наиболее распространенными мутациями, которые вызывают синдром Апера (Apert), являются замены нуклеотидов серина на триптофан S252W и пролина на аргинин P253R, происходящие в гене рецептора 2 фактора роста фибробласта (FGFR2). При подозрении на синдром Апера (Apert) рекомендуется проведение молекулярно-генетических исследований у плода (путем биопсии ворсин хориона или амниоцентеза), а также обследование родителей, особенно в тех семьях, где заболевание регистрируется впервые.
Недавно выполненное исследование выявило, что при мутации P253R отмечаются меньшая выраженность черепно-лицевых аномалий и более значимымые деформации конечностей. Кроме того, с помощью генетических методов была выявлена связь между нарушением экспрессии генов рецепторов фактора роста кератиноцитов (KGFR) и возникновением деформаций конечностей при синдроме Апера (Apert).
В дифференциальный диагноз могут быть включены генетические синдромы, характеризующиеся наличием краниосиностоза, такие как синдромы Крузона (Crouzon), Пфайффера (Pfeiffer), Карпентера (Carpenter) и Сэтре-Чотцена (Saethre-Chotzen). В настоящее время для исключения этих аномалий могут использоваться молекулярно-генетические методы исследования.
До наступления периода жизнеспособности плода может быть предложено прерывание беременности. В более поздние сроки гестации стандартная акушерская такика не изменяется. Рекомендуется родоразрешение в специализированных перинатальных медицинских центрах.

Аперта диагноз что такое
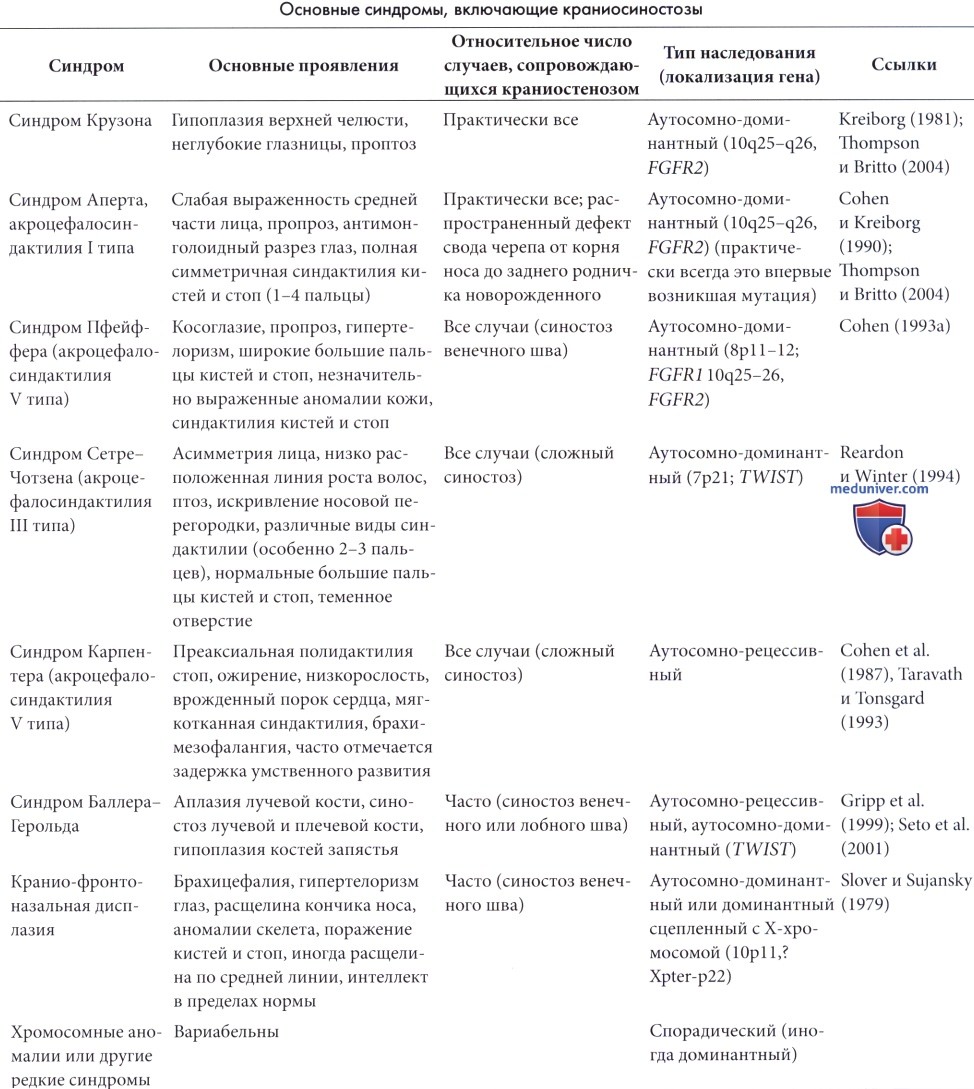
Приблизительно 15-20% краниосиностозов входят в состав различных синдромов, большая часть которых генетически детерминирована. Имеется полный обзор синдромных краниосиностозов (Cohen, 1986, 1988) и подробное описание клинической картины и генетических аспектов (Britto и Reardon, 2004; Thompson и Britto, 2004). Некоторые из наиболее часто встречающихся синдромов представлены в таблице 5.2. Такие синдромы представлены множеством аномалий, одной из которых является краниосиностоз. В рамках одного и того же синдрома тип краниосиностоза может варьировать и не являться определяющим тяжесть заболевания фактором; аномалии органов черепа могут иметь большее значение, так как приводят к нарушениям дыхания, питания и зрения. Диагностика не должна ограничиваться исключительно определением пораженных швов.
На синдромы Крузона и Апера приходится приблизительно по трети случаев синдромных краниосиностозов, а оставшаяся треть встречается при комплексных или редких синдромах, отчасти пока не классифицированных (Le Merrer et al., 1988, Lajeunie et al., 1995).
а) Синдром Крузона. Синдром Крузона характеризуется аутосомно-доминантным типом наследования. Более чем в половине из 61 случая (Kreiborg, 1981) отмечались вновь возникшие мутации; данный синдром объяснял наличие 3% краниосиностозов среди 370 пациентов (Hunter и Rudd, 1977). Установлено, что синдром Крузона и Аперта объясняют 4,8% и 4,5% случаев краниосиностозов при рождении (Cohen и Kreiborg, 1990). Фенотип варьирует даже внутри одной генеалогической линии; часто встречаются слабо выраженные случаи, а внешний вид взрослых может казаться нормальным, но ранние фотографии родителей могут помочь в выявлении минимальных поражений. Ген синдрома Крузона располагается на участке 10q25-q26 (Preston et al., 1994) и кодирует рецептор фактора роста фибробластов-2 (Jabs et al., 1994). Выявлено несколько мутаций данного гена (Reardon et al., 1994; Oldridge et al., 1995).
Существенными проявлениями данного синдрома являются гипоплазия верхней челюсти, неглубокие глазницы и проптоз. Краниосиностоз является постоянным проявлением синдрома, развивается на первом году жизни и чаще всего вначале поражает венечные швы. В итоге происходит поражение всех швов, но форма черепа варьирует от трилистника (Rohatgi, 1991) до скафоцефалии. Часто отмечается выступание черепа в области закрытия переднего родничка. Среди пациентов с синдромом Крузона отмечается выраженная вариабельность проявлений. Часто встречается проводниковая тугоухость поэтому необходимо целенаправленное обследование. Постоянно встречающиеся аномалии внутренних органов и конечностей отсутствуют, но обструкция носовой полости и глотки может приводить к хронической дыхательной недостаточности и формированию легочного сердца (Moore, 1993). Припадки встречаются у 12% пациентов (работы Kreiborg), но задержка умственного развития выявляется редко (3%). Гидроцефалия встречается редко (Marchac и Renier, 1982), но повышение внутричерепного давления было выявлено в 37% случаев, также зарегистрированы случаи хронической грыжи миндалин мозжечка (Cinalli et al., 1995). Аномалии костей запястья и пястных костей встречаются часто и напоминают проявления синдрома Пфейффера.
Учитывая множественные поражения лица, обструкцию дыхательных путей и верхних отделов желудочно-кишечного тракта, хирургическое лечение при раннем проведении дает удовлетворительные результаты.
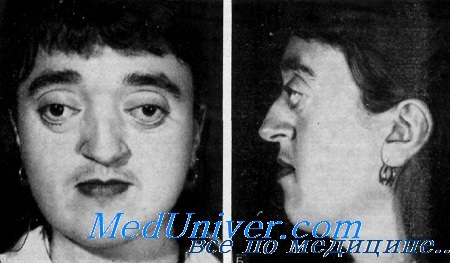
б) Синдром Аперта. Синдром Аперта практически всегда наследуется аутосомно-доминантным путем. Заболевание аллельно синдрому Крузона и вызвано мутацией гена рецептора фактора роста фибробластов-2 (Wilkie et al., 1995). Синдром характеризуется краниосиностозом, мальформациями средней линии лица и симметричной синдактилией кистей и стоп с поражением второго, третьего и четвертого пальцев (Cohen, 1986) (рис. 5.6). Обычно отмечается раннее поражение венечного шва, с формированием высокого брахицефалического черепа, но синостоз имеет вариабельный характер. Распространенный открытый дефект свода черепа начинается от корня носа, продолжается до заднего родничка новорожденных и закрывается до трехлетнего возраста с формированием выпячивания черепа. Передняя черепная ямка короткая, а глазницы неглубокие.
Внутричерепной объем превышает контрольные показатели. Часто встречается расщелина неба. Задержка умственного развития встречается очень часто в очень тяжелой степени. Тем не менее, по результатам одного из исследований задержка умственного развития отмечалась только у половины пациентов (Patton et al., 1988). Достаточно часто встречается гидроцефалия, а аномалии (особенно частичный агенез мозолистого тела) отмечаются у 12% пациентов (Cohen и Kreiborg, 1990). Сращение пятого и шестого шейных позвонков отмечается в 70% случаев; часто встречается глухота и атрофия зрительного нерва. Приблизительно у 10% пациентов выявляются аномалии внутренних органов. Даже при использовании современных реконструктивных методик прогноз неблагоприятный и может быть еще более серьезным при сочетанных аномалиях, таких как аномалии сердца, сколиоз или микроофтальмия.
в) Другие синдромные краниосиностозы. Следующими по распространенности являются синдром Сетре-Чотзена (de Heer et а1., 2005) и синдром Пфайффера (Vanek и Losan, 1982; Zankl et al., 2004). Прогноз для когнитивных функций обычно благоприятный, но синдромы характеризуются заметной вариабельностью неврологических и морфологических проявлений и иногда сопровождаются тяжелыми деформациями.
При синдроме Сетре-Чотзена обычно встречается двусторонний синостоз венечного шва, часто асимметричный (Reardon и Winter, 1994). Аномалии лица, глаз (птоз), внешнего уха и пальцев рук имеют легкую степень выраженности. Синдром имеет преимущественно семейный характер с часто встречающимися малыми формами (Chun et al., 2002).
Синдром Пфайффера также является аутосомным доминантным заболеванием и представлен сочетанием краниосиностоза (преимущественно венечного шва) и характерных аномалий конечностей. Синдром включает широкие и короткие большие пальцы стоп и кистей, симфалангию кистей, частичную мягкотканную синдактилию кистей и стоп. Часто встречается проводниковая тугоухость от легкой до умеренной степени выраженности. Интеллект обычно в пределах нормы. Описано три подтипа заболевания различной степени выраженности (Cohen, 1993b).
Описано большое количество минимально выраженных синдромных краниосиностозов (Thompson и Britto 2004); в настоящее время выделено не менее 67 синдромов (Cohen, 1986), включающих краниосиностозы, и ожидается продолжение. Генетическое консультирование в таких случаях обычно носит неточный характер, но в 7 из 11 случаев недиагностированных синдромных краниосиностозов была выявлена семейная история заболевания (Le Merrer et al. 1988), таким образом, вероятность рождения больных детей достаточно высока.
г) Молекулярные аспекты и аспекты развития синдромных краниосиностозов. Последние несколько лет существенное внимание уделяется генетическим аспектам синдромных краниосиностозов (Superti-Furga et al., 2001). Синдромы Аперта, Крузона и Пфейффера связаны с мутациями гена рецептора фактора роста фибробластов-2. Синдром Пфейффера также может быть связан с мутацией гена рецептора фактора роста фибробластов-1. В целом 30 синдромных краниосиностозов расцениваются как моногеные заболевания (Britto и Reardon, 2004). Несиндромные краниосиностозы, особенно венечный синостоз, также могут быть связаны с мутациями гена рецептора фактора роста фибробластов-1 (Lajeunie et al, 1995).
Причины формирования различных фенотипов при мутации в одном и том же гене неясны. Известно большое количество различных мутаций генов рецептора фактора роста фибробластов (Kannu и Aftimos, 2007); существует некоторая корреляция между генотипом и фенотипом, но определенное воздействие дают также эпигенетические факторы и факторы внешней среды. Мутации, являющиеся причиной заболевания, в основном представляют собой миссенс-мутации, а их воздействие основано на «усилении функции»; исключение составляет связанный с синдромом Сетре-Чотзена ген TWIST на 7-й хромосоме, гаплонедостаточность которого служит причинной развития синдрома.
д) Лечение краниосиностозов. В течение последнего десятилетия наметился явный прогресс в лечении краниосионостозов. Многие аспекты лечения невозможно обсудить в рамках данной статьи; для получения исчерпывающей информации следует обратиться к монографии по данной проблеме, вышедшей под редакцией Hayward et al. (2004). В случае сагиттального и одностороннего венечного синостоза и во многих случаях двустороннего венечного и сложного синостоза достигаются удовлетворительные косметические результаты лечения. Наилучшие результаты были достигнуты при раннем оперативном лечении в возрасте до 6 месяцев, но значимая коррекция достигалась позже. Описаны различные комплексные методы лечения (Marchac и Renier, 1982; Marsh и Schwartz, 1983), заключающиеся в обширных хирургических вмешательствах. Общепризнанно, что хирургическое лечение показано в случае повышения внутричерепного давления и/или при начальной стадии атрофии зрительного нерва. В некоторых случаях, таких как сагиттальный синостоз или плагиоцефалия, риск неврологических осложнений невысок, а целью вмешательства является только коррекция формы черепа.
При использовании современных методик лечения изолированных синостозов риск осложнений не столь высок, поэтому хирургическое лечение показано даже при таких относительно доброкачественных формах как сагиттальный синостоз, так как косметические дефекты могут приводить к значимому смущению и затруднению общения в школьном возрасте или позднее. Тем не менее, в ходе недавнего исследования с участием 30 пациентов было продемонстрировано, что у неоперированных пациентов к концу первого десятилетия (9,25 лет) отмечалось нормальное интеллектуальное и психологическое развитие, таким образом, вопрос о необходимости систематического вмешательства остается нерешенным (Boltshauser et al., 2004). Цель лечения должна быть разъяснена родителям. Синдромные синостозы могут быть причиной серьезных отклонений в связи с поражением органов черепа и множеством дефектов скелета и нервной системы. Проблема решается лишь при участии специалистов, знакомых с такими специфическими задачами. Особое внимание уделяется слуху, речи и языку, питанию и психологическим проблемам (Hayward et al., 2004). Необходимо осознать, что лечение не ограничивается хирургическими методами. Важными являются офтальмологические аспекты.
Частота атрофии зрительного нерва снизилась в результате раннего и эффективного хирургического лечения; данное осложнение в 35,5% случаев имело двусторонний и в 9,1% случаев — односторонний характер и было вызвано косоглазием, астигматизмом, гиперметропией или анизометропией; необходима коррекция и наблюдение специалиста (Тау et al., 2006). Часто встречающаяся обструкция дыхательных путей требует консультации ЛОР-специалиста.
Редактор: Искандер Милевски. Дата публикации: 6.12.2018
Синдром Апера
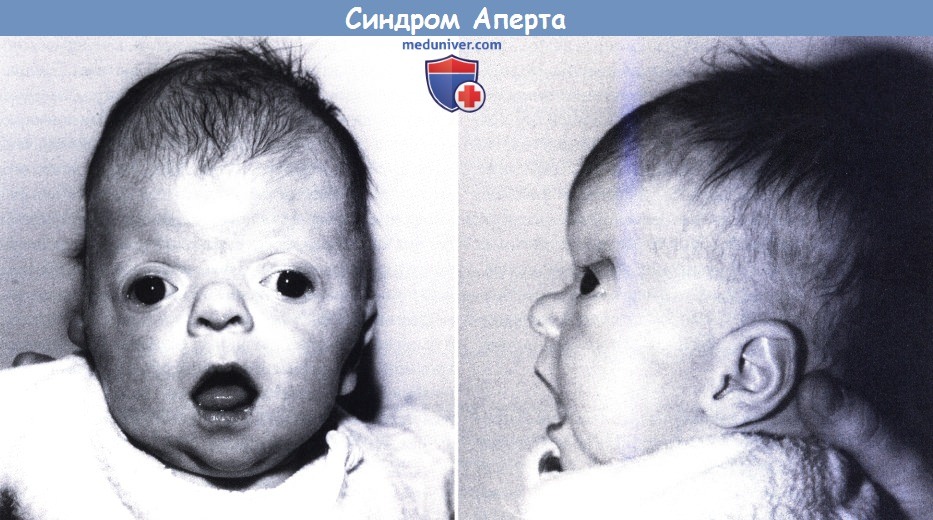
Синдром Апера – генетическое заболевание, характеризующееся нарушениями процессов окостенения черепа и связанными с этим вторичными расстройствами, а также многочисленными пороками развития скелета и конечностей. Симптомами этого состояния являются карликовый рост, башенная форма черепа, расширенная переносица, незаращение твердого нёба, синдактилии на руках и ногах. Диагностика синдрома Апера производится по характерной клинической картине патологии, на основании рентгенологических данных и молекулярно-генетических исследований. Специфического лечения заболевания не существует, применяют поддерживающую терапию, проводят хирургические вмешательства паллиативного характера.
Общие сведения
Синдром Апера (акроцефалосиндактилия 1 типа) – генетическая патология, обусловленная нарушением образования некоторых видов соединительной ткани, главным образом костной. Впервые данное состояние было описано в 1906 году французским педиатром Э. Апером, дальнейшие исследования подтвердили генетическую природу этого заболевания. Этиология и молекулярно-генетические механизмы развития синдрома Апера были определены значительно позднее – лишь в 1995 году. Данная патология может наследоваться по аутосомно-доминантному механизму, однако в подавляющем большинстве случаев ее причиной являются спонтанные мутации в половых клетках родителей (так называемые герминативные мутации).
Синдром Апера с одинаковой частотой поражает как мальчиков, так и девочек, его встречаемость составляет в среднем 1 случай на 160 000-200 000 новорожденных. Врачи-генетики в настоящее время относят синдром Апера к особой группе наследственных заболеваний – акроцефалосиндактилиям, характеризующиеся одновременным поражением костей черепа и конечностей. Особенностью этой патологии является важность ее как ранней диагностики, поскольку паллиативные мероприятия в раннем возрасте могут в значительной степени влиять на дальнейшее интеллектуальное развитие больного.
Причины синдрома Апера
Синдром Апера, согласно последним научным данным, обусловлен мутациями гена FGFR2, расположенного на 10 хромосоме. Он кодирует белок-рецептор фактора роста фибробластов-2, который оказывает значительное влияние на развитие клеток соединительных тканей, в том числе и костной. Значительный размер (20 экзонов) и специфическое расположение гена делают его уязвимым к различного рода повреждениям, которые затем фенотипически проявляются наследственными заболеваниями. Помимо синдрома Апера дефекты гена FGFR2 приводят к развитию таких патологий, как синдром Бира-Стивенсона, синдром Пфайффера, синдром Сетре-Чотзена, краниофациально-скелетно-дерматологическая дисплазия и ряду других. Поэтому исследования данного гена довольно распространены в современной генетике.
Как показали исследования 1995-2000 годов, наиболее часто (в 96% случаев) к развитию синдрома Апера приводят мутации в области 7 экзона гена FGFR2. При этом на долю мутации S252W приходится порядка 74-76% от всех случаев заболевания, а примерно 21-23% вызываются дефектом P253R. Таким образом, причиной подавляющего большинства случаев синдрома Апера являются всего лишь два типа мутации, что упрощает молекулярно-генетическую диагностику этого состояния. Так как эти дефекты относятся к миссенс-мутациям, полученный в результате трансляции такого гена рецептор к фактору роста фибробластов имеет нарушенную структуру и неспособен выполнять свои функции. Это приводит к нарушению процессов окостенения черепа, в частности – к преждевременному зарастанию швов и остановке нормального роста черепной коробки. Дефект рецепторов при синдроме Апера также становится причиной пороков развития иных структур, где участвуют фибробласты (стенки сосудов крупного калибра, сердце, кости лицевого черепа, трахея). Наследуется это состояние по аутосомно-доминантному механизму, но чаще всего имеют место спонтанные мутации.
Кроме того, при синдроме Апера возникает аномальная экспрессия гена KGFR, тоже расположенного на 10 хромосоме. Он кодирует последовательность белка, являющегося рецептором к фактору роста кератоцитов. Никаких мутаций или других нарушений в структуре KGFR при синдроме Апера выявлено не было, лишь его чрезмерная активность, приводящая к увеличению количества кодируемых им рецепторов. Возможно, это явление объясняется сложными взаимоотношениями генов или же рецептор к фактору роста фибробластов 2 обладает супрессирующим действием на ген KGFR. Результатом аномальной экспрессии этого гена становятся фенотипические нарушения формирования конечностей – различные формы синдактилии, всегда встречающиеся при синдроме Апера, иногда полидактилия.
Симптомы синдрома Апера
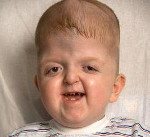
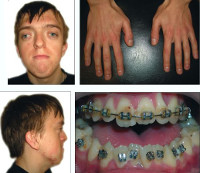
Некоторые проявления синдрома Апера заметны с самого рождения – например, синдактилия, которая может быть полной или в виде перепонок. Как правило, срастаются 2, 3 и 4 пальцы на кистях, иногда аналогичный порок возникает и на пальцах ног. Среди неонатологов симптом иногда носит название «среднего пальца» – в тяжелых случаях эти три пальца прочно срастаются между собой и имеют один общий ноготь. Другим постоянным симптомом синдрома Апера, обнаруживающимся сразу после рождения или в первые месяцы жизни, является раннее развитие синостоза костей черепа. Чаще всего происходит срастание венечного или стреловидного шва, что по мере роста головного мозга приводит к деформации черепа по типу «башенной». Из-за черепного синостоза у больных синдромом Апера наблюдается хроническое повышение внутричерепного давления, становящееся причиной задержки умственного развития, головных болей, тошноты и рвоты.
Помимо деформации черепа о наличии синдрома Апера свидетельствует характерный внешний вид больных. У них обычно обнаруживается плоский или выпуклый лоб, гипертелоризм и экзофтальм, может развиваться косоглазие. Деформации затрагивают и кости лицевого черепа – переносица расширена, челюсти нередко недоразвиты, наблюдается нарушение прикуса. Из других симптомов синдрома Апера иногда регистрируются нарушения дыхания (из-за недоразвития верхней челюсти, сужения хоан или трахеи), незаращение твердого нёба, врожденные пороки сердца, аномалии развития позвонков, почек, прямой кишки.
У взрослых лиц, страдающих синдромом Апера, может возникать атрофия зрительных нервов вплоть до полной слепоты. Интеллектуальное развитие больных часто отстает от возрастной нормы, однако достоверно неизвестно, обусловлено это генетическими нарушениями или вторичными факторами (хронической внутричерепной гипертензией). Практически всегда при синдроме Апера наблюдается карликовый рост. При соответствующем паллиативном лечении и уходе больные могут доживать до преклонного возраста, но риск внезапной смерти из-за поражений дыхательной, нервной и сердечно-сосудистой систем у них намного выше, чем в популяции.
Диагностика
Диагностика синдрома Апера производится на основании осмотра и изучения настоящего статуса пациента, рентгенологических исследований, молекулярно-генетических анализов. При осмотре у больного выявляется синдактилия (у лиц старшего возраста могут обнаруживаться следы ее хирургической коррекции), деформация черепа – башенный череп или брахикефалия, характерный внешний вид лица.
С возрастом у больных синдромом Апера могут нарастать признаки нарушения дыхания, при ЭхоКГ нередко определяются пороки сердца и сосудов – стеноз легочного ствола или аорты, дефекты межжелудочковой перегородки. Иногда на этом фоне выявляются признаки сердечной недостаточности. Также возможно наличие иных пороков развития – аномалий позвонков, глухоты, слепоты (из-за катаракты, пигментного ретинита, атрофии зрительных нервов), патологий почек и поджелудочной железы. Из-за столь широкого спектра возможных нарушений больные синдромом Апера нуждаются в тщательном и всестороннем медицинском обследовании.
Рентгенологическими методиками уже у маленьких детей можно обнаружить синостоз костей черепа в области венечного или стреловидного шва. В дальнейшем при помощи рентгенографии можно определить характерную для синдрома Апера деформацию черепной коробки, пороки развития костей лицевого черепа, аномалии позвонков и другие нарушения.
Наиболее достоверным диагностическим методом при этом состоянии является молекулярно-генетический анализ. Как правило, для выявления синдрома Апера производят секвенирование 7 экзона гена FGFR2, иногда используют менее затратные техники, ориентированные только на поиск наиболее распространенных мутаций (S252W и P253R), приводящих к этому заболеванию. Подобные методики более дешевые и быстрые в выполнении, обладают точностью на уровне 95%, возможно их использование в качестве пренатальной диагностики этого состояния. Подобный анализ особенно актуален, если посредством профилактических УЗИ у плода выявляются нарушения, предположительно связанные с синдромом Апера – пороки развития черепа, сердца, верхних или нижних конечностей.
Лечение синдрома Апера
Специфического лечения синдрома Апера на сегодняшний день не существует, однако паллиативные и симптоматические мероприятия могут значительно облегчить состояние больного и улучшить качество его жизни. Особенно важно как можно раньше диагностировать это заболевание по той причине, что своевременная хирургическая коррекция черепного синостоза позволит избежать значительного роста внутричерепного давления. По многочисленным данным, после таких операций, произведенных в раннем детстве, признаки умственной неполноценности у больных синдромом Апера были выражены значительно слабее, иногда сохранялся нормальный интеллект. Поэтому борьба с внутричерепной гипертензией играет центральную роль в паллиативном лечении этого состояния. Если же у пациентов имеется умственная отсталость, то ее выраженность снижается путем психокоррекционной работы.
Другой часто выполняемой паллиативной хирургической операцией при синдроме Апера является вмешательство для разделения сросшихся пальцев на руках и ногах. Это относительно несложная процедура при перепончатом типе сращения, однако при более тяжелых формах порока операция значительно усложняется. При синдроме Апера также может потребоваться помощь хирургов в случае пороков сердца, сужения хоан или трахеи, нарушения формирования прямой кишки и других проявлений этого генетического заболевания. Больные нуждаются в регулярных медицинских обследованиях у специалистов различного профиля.
Прогноз и профилактика
Прогноз синдрома Апера неопределенный по причине очень широкого спектра проявлений и значительного диапазона их выраженности. На прогноз также оказывают влияние такие факторы, как своевременность диагностики заболевания, объем паллиативного и симптоматического лечения. При относительно легких случаях синдрома Апера или правильной терапии этого состояния больные могут доживать до преклонного возраста. При этом возможно снижение интеллекта и появляющиеся с возрастом нарушения все новых органов и систем, что негативно сказывается на качестве жизни пациентов. В тяжелых случаях наблюдается летальный исход в раннем детстве из-за врожденных пороков сердца или полиорганной недостаточности.
Профилактика синдрома Апера возможна только в качестве пренатальной диагностики, которая может производиться как ультразвуковыми методиками, так и путем молекулярно-генетического анализа. Обычно проявления патологии сначала обнаруживаются на профилактических УЗИ, а затем диагноз подтверждается врачом-генетиком. Если данное состояние удается выявить на ранних сроках беременности, то ставится вопрос о ее прерывании.