Как называется правильное наименование химических веществ
Названия химических соединений
Химическое соединение — это молекула, в составе которой находится более одного элемента. Оно образуется в том случае, когда элементы соединяются друг с другом при помощи особой прочной связи. Такое соединение является новым веществом.
По какому принципу химические соединения получают свои названия? Происходит это в соответствии с определенными правилами, принятыми и понятными во всем мире. Название вещества состоит из наименований всех элементов этого соединения и указания на строение молекулы.
Основной принцип присвоения названий
Если в состав вещества входит только один элемент, то наименование в большинстве случаев совпадает с названием соответствующего элемента. Например: Fe — железо, Na — натрий, Si — кремний.
А сейчас давай разберемся, как называют молекулы, в состав которых входят два элемента. Название такого вещества состоит из двух слов.
Одно из них — это название того элемента, который стоит в формуле первым. Для того чтобы получить второе слово, мы используем название второго элемента, но добавляем к нему суффикс «-ид».
Например: CI — хлор — хлорид, Br — бром — бромид.
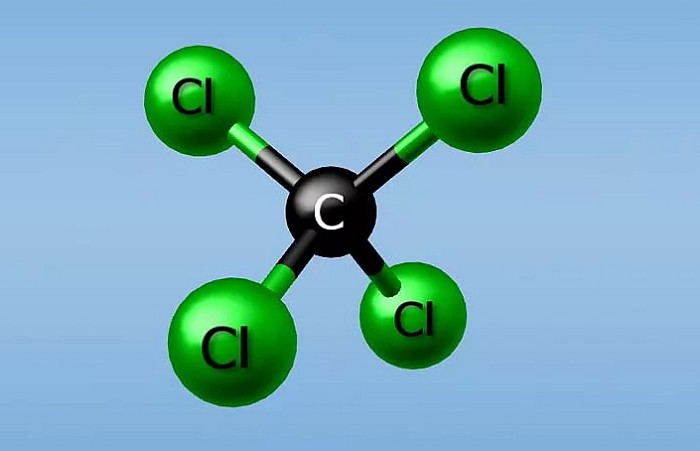
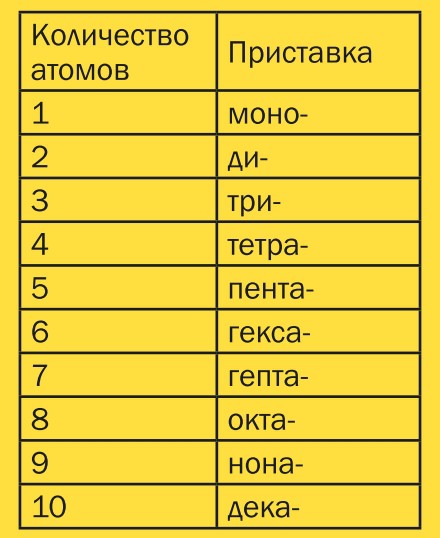
Если в молекуле больше одного атома какого-либо элемента, то химики используют так называемые числовые приставки, которые указывают количество атомов в молекуле.
Например: ССI4 — тетрахлорид углерода, РСI3 — трихлорид фосфора, СO2 — диоксид углерода.
Как определяется порядок элементов в формуле?
Если в вещество входят два элемента, какой из них должен стоять на первом месте?
Когда в состав химического соединения входят металл и неметалл, то металл ставится на первое место.
Если же соединение состоит из двух неметаллов, то первым в формуле становится элемент, который находится в таблице периодических элементов Менделеева левее. Например:
Запомни: как правило, при составлении наименований химических соединений используются названия элементов на русском языке, но для некоторых элементов применяются их латинские наименования, например О — кислород (оке, оксиген) — оксид, S — сера (сульф) — сульфид и др.
Например: NaCI — хлорид натрия, MgS — сульфид магния.
Номенклатура химическая
Номенклат у ра хим и ческая, система рациональных названий химически индивидуальных веществ. Первая такая система была выработана в 1787 Комиссией французских химиков под председательством А. Л. Лавуазье. До этого названия веществ давались произвольно: по случайным признакам, по способам получения, по имени первооткрывателя и т. п. Каждое вещество имело по нескольку названий-синонимов. Комиссия Лавуазье постановила, что каждое вещество может иметь только одно название; наименование сложного вещества состоит из двух слов, указывающих на род и вид соединения, должно быть удобопроизносимым и не противоречить нормам языка. Номенклатура химическая, предложенная французскими учёными и основанная на кислородной теории (см. Кислород), явилась образцом для создания в начале 19 в. национальных номенклатур, в том числе русской. Современная номенклатура неорганических соединений и номенклатура органических соединений разработаны международными комиссиями, стремившимися выразить словами всю информацию, содержащуюся в формулах химических. Задача эта чрезвычайно сложная. При пользовании т. н. международной номенклатурой химической следует помнить высказывание А. М. Бутлерова (1859) о русской номенклатуре химической: «большею частью своей массы она сольется с общею химической номенклатурой, а русские названия, выработавшиеся в обыденном языке, как были, так и останутся в употреблении у русских химиков» (Соч., т. 3, 1958, с. 143). По мнению Д. И. Менделеева (1869), «. в деле номенклатуры нельзя быть совершенно последовательным: есть известного рода обычаи. от которых отступить невозможно, иначе рискуешь быть непонятым даже теми, кто привык уже к химическому изложению. Из разных названий, более или менее рационально составленных, нужно избрать. не только такое, которое более ясно выражает особенность или состав данного вещества, но также и такое, которое не поражает ухо своим неудобством» (Соч., т. 13, 1949, с. 283).
Номенклатура неорганических соединений. Главные положения русской номенклатуры неорганических соединений создали химики 1-й половины 19 в., в частности В. М. Севергин и главным образом Г. И. Гесс с сотрудниками (1831, 1835). Эта номенклатура неорганических соединений, переработанная Менделеевым (1861, 1869), была общеупотребительна (с некоторыми поправками) вплоть до 1930-х гг., когда советские химики стали предпочитать т. н. международные названия, заимствованные из западно-европейских языков. Приводимые ниже основные положения номенклатуры неорганических соединений составлены с учётом названий, применяемых в научной и учебной химической литературе. Эти положения отражают переходное состояние номенклатуры неорганических соединений, существующее в 60 — начале 70-х гг.
Основой номенклатуры неорганических соединений служат названия химических элементов (см. Знаки химические). Как правило, название соединения состоит из двух слов. Одно из них означает принадлежность данного соединения к определённому роду (или классу), другое — к определённому виду. Например, в названии « серная кислота» существительное показывает, что данное вещество относится к кислотам, а прилагательное поясняет, что это кислота, образованная серой в высшей степени окисления. Название « сульфат натрия» говорит, что вещество принадлежит к сульфатам ( солям серной кислоты) и представляет собой соль натрия.
В номенклатуре неорганических соединений применяют корни главным образом латинских названий элементов, отличающиеся от русских (таблица 1).
Соединения элементов с кислородом, в которых он связан только с более электроположительными атомами, называется по МН оксидами, по PH — окислами. В порядке возрастания степени окисления электроположительного элемента окислам либо дают названия закись, окись, двуокись, трёхокись, либо указывают римской цифрой степень окисления. Окислы, которые можно получить отнятием воды от кислот, называются ангидридами (МН отменяет этот термин). В табл. 2 сопоставлены названия окислов хрома по МН и PH.
Соединения, в которых атомы кислорода связаны и друг с другом, и с атомами более электроположительного элемента, называются пероксидами или перекисями (см. Перекисные соединения). Примеры: пероксид ( перекись) водорода Н — О — О — Н,
Закись хрома, окись хрома (ll), одноокись хрома
Оксид хрома (lll), дихром триоксид, гемитриоксид хрома, сесквиоксид* хрома
Окись хрома, окись хрома (lll), полутораокись хрома
*От лат. sesqui — полтора.
Основания называются по МН гидроксидами, по PH — гидроокисями. Если металл образует свыше одного основания, степень окисления металла указывают либо римской цифрой в скобках, либо приставкой — русской или греческой. Примеры: Fe (OH)2 — гидроксид железа (II), дигидроксид железа, двугидроокись железа; Fe(OH)3 — гидроксид железа (III), тригидроксид железа; трёхгидроокись железа. Название « гидрат закиси», « гидрат окиси» выходят из употребления.
Лит.: Лучинский Г. П., Номенклатура неорганических соединений, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964; Материалы к проекту номенклатуры неорганических соединений, М., 1968; Некрасов Б. В., Основы общей химии, 2 изд., т. 1, М., 1969; Лабораторный практикум по общей химии, под ред. С. Л. Погодина, 2 изд., М., 1972, с. 27—33; Бусев А. И., Ефимов И. П., Словарь химических терминов. Пособие для учащихся, М., 1971; Nomenclature of inorganic chemistry. Definitive rules for nomenclature of inorganic chemistry, L., 1959; Crosland М. P., Historical studies in the language of chemistry, L., 1962.
Номенклатура органических соединений. В начальный период развития органич. химии вещества получали случайные, тривиальные назв., основой которых служили природные источники, характерные свойства веществ, имена учёных. Такие назв. в ряде случаев сохранились и до сих пор.
Научное название органического вещества должно отражать его химическое строение. Для этого употребляют сложные слова-названия, построенные по определённым правилам из обозначений более простых составных частей соединения и цифр или букв, указывающих расположение этих частей. Первой была постепенно сложившаяся во 2-й половине 19 в. рациональная номенклатура. Основу рационального названия составляет простой (но не обязательно первый) член данного гомологического ряда; названия «достраивают», указывая дополнительно (в приставке) имеющиеся радикалы и др. структурные части; их положение обозначают греческими буквами. Примерами могут служить следующие названия (принятая за основу названия часть молекулы выделена в формулах пунктиром):
В зависимости от выбранной основы названия одно вещество может иметь и несколько рациональных названий, как в примере V.
В названии соединений с несколькими разными функциями в суффиксе оставляют обозначение только главные функции, а остальные, как и боковые цепи (радикалы), перечисляют в приставке (префиксе). При этом одна и та же функция в суффиксе (как старшая) и в префиксе (как младшая) имеет разные обозначения (см. таблицу 3).
Табл. 3. — Обозначение наиболее часто встречающихся функций
Номенклатура химических соединений: совокупность названий, виды и классификация
Изучение такого интересного предмета, как химия нужно начинать с основы основ, а именно с классификации и номенклатуры химических соединений. Это поможет не заблудиться в такой сложной науке и расставить все новые знания по своим местам.
Коротко о главном
Номенклатура химических соединений – это система, включающая в себя все названия химических веществ, их групп, классов и правил, при помощи которых происходит словообразование их названий. Когда она была разработана?

Первая номенклатура хим. соединений была разработана в 1787 году Комиссией французских химиков под руководством А. Л. Лавуазье. До этого времени названия давались веществам произвольно: по каким-то признакам, по способам получения, по имени первооткрывателя и так далее. Каждое вещество могло иметь несколько названий, то есть синонимов. Комиссия постановила, что любое вещество должно иметь лишь одно единственное название; наименование вещества сложного может состоять из двух слов, указывающих на вид и род соединения, и не должно противоречить языковым нормам. Данная номенклатура химических соединений стала образцом для создания в начале XIX века номенклатур различных национальностей, в том числе русской. Речь об этом пойдет далее.
Виды номенклатуры химических соединений

Кажется, что разобраться в химии просто невозможно. Но если ознакомиться с двумя видами номенклатуры хим. соединений, то можно убедиться в том, что все не так уж сложно. Что это за классификация? Вот два вида номенклатуры химических соединений:
Что они из себя представляют?
Простые вещества
Химическая номенклатура неорганических соединений представляет собой формулы и названия веществ. Химической формулой называется изображение символов и букв, отражающее состав вещества с помощью Периодической системы Дмитрия Ивановича Менделеева. Названием является изображение состава вещества при помощи определенного слова или группы слов. Построение формул производится по правилам номенклатуры химических соединений, и, используя их же, дается обозначение.
Название некоторых элементов образуется от корня этих наименований на латинском языке. Например:

Для того чтобы описать число атомов в соединении, используют приставки. В таблице для примеров взяты вещества как органической, так и неорганической химии.
Органические вещества
С соединениями органической химии все не так просто, как с неорганикой. Дело в том, что принципы химической номенклатуры органических соединений основаны сразу на трех типах номенклатур. На первый взгляд, это кажется удивительно и запутанно. Однако они довольно просты. Вот типы номенклатуры химических соединений:
В настоящее время именно они применяются для того, чтобы дать название тому или иному органическому соединению. Рассмотрим каждую из них и убедимся в том, что номенклатура основных классов химических соединений не так уж и сложна, как кажется.
Тривиальная
Это самая первая номенклатура, появившаяся в начале развития органической химии, когда еще не было ни классификации веществ, ни теории строения их соединений. Органическим соединениям присваивались случайные названия по источнику получения. Например, яблочная кислота, щавелевая кислота. Также отличительными критериями, по которым давались названия, были цвет, запах и химические свойства. Однако последнее служило поводом редко, потому что в этот период времени было известно сравнительно мало информации о возможностях органического мира. Однако многие названия данной довольно старой и узкой номенклатуры часто применяются до сих пор. Например: уксусная кислота, мочевина, индиго (фиолетовые кристаллы), толуол, аланин, масляная кислота и многие другие.
Рациональная
Эта номенклатура возникла с момента появления классификации и единой теории строения органических соединений. Она несет национальный характер. Органические соединения получают свои названия по типу, или классу, к которому они относятся, согласно своим химическим и физическим признакам (ацетилены, кетоны, спирты, этилены, альдегиды и так далее). В настоящее время такая номенклатура используется исключительно в тех случаях, когда дает наглядное и более детальное представление о рассматриваемом соединении. Например: метилацетилен, диметилкетон, метиловый спирт, метиламин, хлоруксусная кислота и тому подобное. Таким образом, из названия сразу становится понятно то, из чего состоит органическое соединение, но более точное расположение групп-заместителей еще невозможно определить.

Международная
Стремление создать унитарную химическую номенклатуру для органических соединений зародилось в 80-е годы XIX века. Это произошло после создания Александром Михайловичем Бутлеровым теории химического строения, в которой было четыре основных положения, рассказывающих о порядке атомов в молекуле, явлении изомерии, взаимосвязи строения и свойств вещества, а также о влиянии атомов друг на друга. Данное событие произошло в 1892 году на съезде ученых-химиков в Женеве, который утвердил правила номенклатуры органических соединений. Эти правила вошли в органику под названием Женевская номенклатура. На ее основе был создан популярный справочник Бейльштейна.
Естественно то, что со временем количество органических соединений росло. По этой причине и номенклатура все время усложнялась, и возникали новые дополнения, которые были озвучены и приняты на очередном съезде, состоявшемся в 1930 году в городе Льеже. Нововведения основывались на удобстве и лаконичности. И теперь систематическая международная номенклатура вобрала в себя некоторые положения как женевской, так и льежской.
Таким образом, в этих трех типах систематизации и заключаются основные принципы химической номенклатуры органических соединений.
Классификация простых соединений
Теперь пришло время ознакомиться с самым интересным: классификацией как органических, так и неорганических веществ.
Сейчас миру известны тысячи различных неорганических соединений. Знать все их названия, формулы и свойства практически невозможно. Поэтому все вещества неорганической химии разделены на классы, группирующие все соединения по сходному строению и свойствам. Такая классификация представлена в таблице ниже.
| Неорганические вещества | |
| Простые | Металлические (металлы) |
| Неметаллические (неметаллы) | |
| Амфотерные (амфигены) | |
| Благородные газы (аэрогены) | |
| Сложные | Оксиды |
| Гидроксиды (основания) | |
| Соли | |
| Бинарные соединения | |
| Кислоты | |
Рассмотрим каждый класс простых веществ:
Так как все простые вещества состоят из атомов одного и того же элемента Периодической системы, то их названия обычно совпадают с названиями этих химических элементов таблицы.
Теперь рассмотрим каждый класс сложных веществ:
Классификация органических соединений

Как известно, любая классификация основана на определенных признаках. В основу современной классификации органических соединений положены два важнейших признака:
Функциональная группа — это те атомы или группа атомов, от которых зависят свойства веществ. По ним определяется, к какому классу относится то или иное соединение.
Для понятия первого разделения углеводородов на циклические и ациклические классы необходимо познакомиться с видами углеродных цепей:
Как образуются названия химических реактивов (химическая номенклатура)
Свод правил, как надо называть то или иное химическое соединение, называется 
Какая номенклатура лучше
С тех пор как химия стала наукой, предпринимались неоднократные попытки систематизировать химические названия. На данный момент существует множество химических номенклатур, популярных в большей или меньшей степени. Наиболее распространенной являются «Рациональная номенклатура» для неорганических соединений и «Правила номенклатуры органических соединений IUPAC 1957». Тем не менее, абсолютно универсальной системы названий нет, разные организации, научные издания и даже страны отдают предпочтение той или иной номенклатуре, поэтому практически любая номенклатура содержит таблицы синонимов. Например, воду можно называть дигидрогена монооксид или H2O, а серную кислоту — тетраоксосульфат диводорода или H2SO4. В таблице Менделеева у каждого элемента есть два названия, к примеру, русское и международное обозначение: олово и Sn (Stannum), серебро и Ag (Argentum).
В России употребляются разные номенклатуры. Роспатент рекомендует использовать Chemical Abstracts, в ГОСТе используются правила ИЮПАК (Международный союз теоретической и прикладной химии). При этом считается разумным для давно известных веществ использовать устоявшиеся тривиальные названия: сода, вода, лимонная кислота, а вот для новых веществ, особенно органических, сложного состава, лучше использовать систематические названия, в которых отражено строение соединения.
Систематика для неорганических веществ

Названия химического вещества отражает его химическую формулу, состоящую из реальных или условных ионов. Названия читаются справа налево. Число ионов указывается с помощью приставки либо степенью окисления римской цифрой в скобках:
SnO2 — диоксид олова, оксид олова (IV);
SnO — монооксид олова, оксид олова (II).
Для известных веществ используются устоявшиеся названия: вода, аммиак, сероводород, озон, кислород, фтороводород и т. д.
Названия кислот и щелочей
Названия кислот состоят из названия образующего вещества и слова «кислота»: угольная кислота, азотная кислота, соляная кислота. Для менее известных кислот используются правила построения названия для комплексных соединений. Например, борофтористоводородная кислота HBF4 еще называется тетрафтороборная кислота.
Названия щелочей состоят из названия металла и слова «гидроксид (гидроокись)»: гидроксид натрия, гидроокись кальция.
Названия солей
Составляются из названия кислотного остатка и металла. Главным является кислотный остаток. Для кислородосодержащих солей используется суффикс «-ат/-ит», для не содержащих кислород — «-ид». Например, NaBr — бромид натрия, K2CO3 — карбонат калия.
Для кислородосодержащих солей используются различные суффиксы и приставки, показывающие степень окисления кислотного остатка.
За основу взят суффикс «-ат»,
при понижении степени окисления, используется сначала суффикс «-ит», потом, в дополнение к суффиксу «-ит», приставка «гипо-».
Для более высокой степени окисления суффикс «-ат» дополняется приставкой «пер-». Например,
NaClO4 — перхлорат натрия,
NaClO3 — хлорат натрия,
NaClO2 — хлорит натрия,
NaClO — гипохлорит натрия.
Для кислых, оснóвных солей, кристаллогидратов и некоторых других групп существуют свои групповые названия и правила образования. Например, для кристаллогидратов используют слово «гидрат» перед названием соли. Квасцы — это общее название класса двойных сульфатов, например, KAl(SO4)2*12H2O — алюмокалиевые квасцы.
Для органических веществ используются номенклатурные правила, отражающие строение этих соединений. Мы рассмотрим их в наших следующих статьях.
Как называется правильное наименование химических веществ
это совокупность названий индивидуальных веществ, их групп и классов, а также правила составления этих названий. Номенклатурные правила, разрабатываемые международным союзом чистой и прикладной химии (IUPAC), приняты в большинстве стран мира.
Согласно правилам IUPAC существуют следующие названия органических соединений:
Систематические названия полностью составляются из слов и частиц, которые отражают определенные элементы строения молекулы и опиcывают структурные особенности соединения, например:
Систематическая номенклатура используется во всем мире, употребляет международную терминологию и отражает состав, а также химическое и пространственное строение соединения.
Тривиальные названия не зависят от структуры и часто связаны с источником выделения или способом получения данного соединения. Например, яблочная кислота:
Тривиальные названия представляют собой исторически сложившиеся названий, которые отражают природный источник вещества (молочная кислота, мочевина, кофеин), характерные свойства (глицерин, гремучая кислота) или имя первооткрывателя (кетон Михлера, углеводород Чичибабина). Тривиальные названия не отражают точный состав и строение вещества, но позволяют увидеть, к какому классу соединений относится соединение. Многие тривиальные названия достаточно лаконичны, общеупотребимы и эквивалентны во всем мире, например валериановая кислота (англ. valeric acid), ксилол (англ. xylol), пропионовый альдегид (англ. propionaldehyde). Поэтому употребление некоторых из них разрешено правилами IUPAC
В полусистематических-полутривиальных названиях лишь некоторые части применяются в систематическом смысле, например названия первых членов ряда алканов (метан, бутан) содержат тривиальные основы и систематический суффикс:
Правила IUPAC допускают использование разных типов номенклатуры:
— соединительной и некоторых других
Наиболее общее значение имеют два типа: заместительная и радикально-функциональная номенклатуры:
Чтобы правильно составлять названия по заместительной номенклатуре и правильно рисовать структурные формулы по названиям, необходимо познакомиться с основными понятиями и определениями:
Алгоритм составления названий органических соединений по заместительной номенклатуре приведен ниже:
Таблица, которая поможет правильно определить старшую группу, а также правильно назвать все функциональные группы в молекуле приведена ниже. Функциональные группы в таблице расположены в порядке падения старшинства сверху вниз:
I. Нужно определить все имеющиеся характеристические группы и выбрать главную, которая указывается в ˄ (группа может отсутствовать). Все другие заместители обозначаются в алфавитном порядке.
С помощью локантов указывают положение всех функциональных групп и положение двойной связи. При этом нумерацию начинают с того конца молекулы, где номер старшей функциональной группы будет наименьшим.
Таким образом, название соединения: 3-бромбутен-3-он-2
Назовите соединение, зная его структурную формулу:
1. Находим самую длинную цепь: она состоит из 6 атомов.
2. Нумеруем атомы углерода, начиная справа, потому что радикал метил – C H 3 CH3 расположен ближе к правому концу выбранной цепи (при втором атоме углерода). Если бы нумерация углеродного скелета начиналась слева, то заместитель этил- стоял бы при третьем атоме углерода.
3. Называем выбранную цепь: цепь из шести атомов обозначается корнем «гекса»; в цепи все связи одинарные, следовательно, используем суффикс «ан». Получаем «гексан».
4. Находим заместители, называем их и определяем их местоположение:
Метил – C H 3 CH3 стоит у второго атома углерода, а этил – C 2 H 5 C2H5 — у четвертого атома. Добавляем названия радикалов к названию углеводородной цепи и цифрами указываем их местоположение. Заместители указываем в алфавитном порядке! Первым пишем метил, потому что его название начинается на «м», а название этил — на «э».
Напишите структурную формулу соединения 2,4-диметил-4-этилоктен-6.
1. Находим в названии соединения корень, обозначающий количество атомов углерода в главной цепи. Это корень «окт», он означает, что в цепи 8 атомов. Рисуем углеродный скелет главной цепи и нумеруем атомы.
2. В названии соединения мы видим суффикс «ен», это означает, что есть одна кратная связь, а именно двойная, и начинается она около шестого атома углерода. Следовательно, между шестым и седьмым атомами нужно нарисовать двойную связь.
4. Дописываем недостающие атомы водорода у каждого атома углерода в цепи. Помним, что углерод всегда четырехвалентен. Полученная формула соответствует названию 2,4-диметил-4-этилоктен-6.