Как называются атомы одного вида
Автор текста Анисимова Е.С. Из курса лекций по химии.
Типы атомов. Химические элементы.
Что такое химический элемент.
Теперь обсудим вопрос о количестве протонов в атомах.
В природе есть атомы с одним протоном, с двумя, с тремя и т.д. – примерно до ста протонов. (114).
Атомы с одним протоном в каждом – это одна группа атомов, один тип атомов.
Атомы с двумя протонами в каждом – другая группа атомов, другой тип атомов.
Атомы с одинаковым числом протонов в каждом считаются атомами одного ТИПА.
Атомы с разным числом протонов в каждом считаются атомами разных типов.
Разные типы атомов (атомы разных типов) отличаются числом протонов.
Химический элемент
Ещё раз. Элемент водород – это не один атом водорода,
а все атомы с одним протоном в каждом,
то есть весь элемент, вся группа атомов с одним протоном.
Правильное название атома из группы атомов с одним протоном –
«атом химического элемента «водород»».
Или короче – «атом водорода».
Хотя часто атом водорода называют просто водородом, имея в виду «атом элемента водород».
Но вообще-то это неточное название, а самое главное –
оно может запутать тех, кто не знает разницы между атомом и элементом.
Более того, атомы водорода могут соединяться между собой по два:
такие соединения из двух атомов водорода называют молекулами водорода.
Но часто молекулы водорода называют просто водородом, то есть так же, как элемент. Что может запутывать ещё больше.
Читая про элемент водород, люди могут думать, что речь про молекулу водорода или наоборот.
Поэтому очень важно не путать названия элементов
с точно такими же названиями молекул (подробнее далее) или атомов.
Нужно понимать разницу между атомами и элементами и всегда сообщать слушателям (чтобы не запутать их),
какой водород имеется в виду – элемент, атом или молекула.
Говоря не просто «водород», а «элемент водород», «атом водорода» или «молекула водорода».
Даже если это как бы понятно из контекста.
«Просто водородом» допустимо называть разве что элемент водород –
например, во фразах типа «водород относится к неметаллам».
Но называть атом водорода просто водородом – всё равно что яблоко называть фруктами. Именно – не фруктом, а фруктами.
Также, встречая слово «водород», нужно самим задаться вопросом –
о каком водороде идёт речь – о молекуле, атоме или элементе.
Иначе понимание текста может быть ошибочным.
Теперь увеличим таблицу, добавив элементы и примеры веществ из их атомов.
А ещё – заряд ядра, который всегда равен числу протонов, так как ими и создаётся, а заряд одного протона равен единице.
Таблица «Первые 10 элементов»:
Число протонов
в атоме этого типа Заряд
ядра
атома Номер
элемента Число электронов
в атомах элемента Названия
элементов Символ
элемента
или его атома Вещества
из
атомов
элемента
Один +1 №1 (первый) 1 Элемент
Водород Н Молекула из двух атомов водорода
Н2
Два +2 №2 (второй) 2 Элемент
Гелий Не Атом гелия Не
Три +3 №3 (третий) 3 Элемент
Литий Li Атом лития
Li
Четыре +4 №4 (четвёртый) 4 Элемент
Бериллий Ве Атом
бериллия
Пять +5 №5 (пятый) 5 Элемент
Бор В Атом
бора
Шесть +6 №6 6 Элемент
Углерод С Атом углерода
С
Семь +7 №7 7 Элемент
Азот N Молекула из двух атомов азота
N2
Восемь +8 №8 8 Элемент
кислород O Молекула из двух атомов кислорода
О2
Девять +9 №9 9 Элемент
Фтор F Молекула из двух атомов фтора
F2
Десять +10 №10 10 Элемент
Неон Ne Атомы неона
11 +11 №11 11 Элемент
Натрий Na Атомы
натрия
Сотня химических элементов расставлены в специальной таблице,
которую называют периодической системой химических элементов Менделеева
или просто таблицей Менделеева (ТМ).
О ней см. отдельный файл.
Тест по биологии Химический состав клетки. Неорганические вещества для 5 класса
Тест по биологии Химический состав клетки. Неорганические вещества для 5 класса. Тест включает 7 заданий с выбором ответа.
Выберите один правильный ответ из предложенных.
1. Атомы одного вида называют
1) молекулами
2) ионами
3) растворами
4) элементами
2. Молекулы — это частицы, состоящие из
1) клеток
2) органоидов
3) атомов
4) кристаллов
3. Вещества, состоящие из частиц, образованных атомами одного вида, называются
1) чистыми
2) простыми
3) элементарными
4) сложными
4. Вещества без примесей называются
1) прозрачными
2) твердыми
3) чистыми
4) жидкими
5. Вещества, состоящие из частиц, образованных атомами разных видов, называются
1) чистыми
2) простыми
3) элементарными
4) сложными
6. Неорганическими веществами клетки являются
1) белки
2) жиры
3) нуклеиновые кислоты
4) минеральные соли
7. Самым распространенным неорганическим веществом в живом организме являются
1) вода
2) белки
3) жиры
4) минеральные соли
Ответы на тест по биологии Химический состав клетки. Неорганические вещества для 5 класса
1-4
2-3
3-2
4-3
5-4
6-4
7-1
Изотопы: что это такое и какие они бывают
Изотопы – это атомы, которые имеют одинаковое количество протонов и электронов, но разное количество нейтронов. На уроках химии школьникам рассказывают, что каждый элемент имеет свой уникальный атом, состоящий из определенного количества протонов. Количество протонов определяет атомное число элемента. Каждый атом имеет такое же количество электронов, как протоны.
Также существуют изотоны и изобары. Изотопами называют ядра элементов, которые содержат разное количество протонов и одинаковое количество нейтронов. Изобары – атомы, в ядрах которых разное количество протонов и нейтронов, но их сумма одинакова.
Поскольку нейтроны не имеют электрического заряда, изменение количества нейтронов не влияет на химию элемента. Однако это меняет массу элемента. Изотопы идентифицируются по их массе, составляющей общее количество протонов и нейтронов.
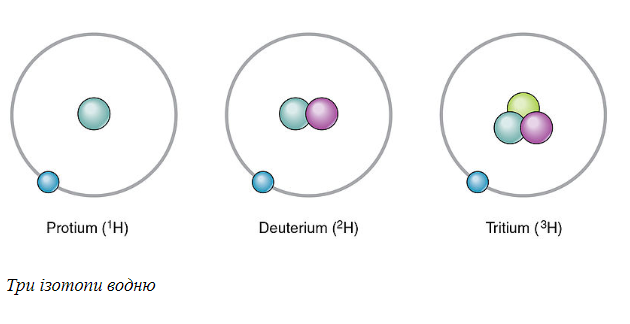
Все элементы имеют ряд изотопов. Водород имеет наименьшее количество изотопов – только три. Цезий и Ксенон имеют наибольшее количество изотопов – 36. Более о количестве изотопов в каждом элементов, читайте в учебнике по химии за 8 класс А.М. Бутенко.
Как записывают изотопы
Вид атомов с определенным числом протонов и нейтронов в ядре называется нуклидом. Существуют два способа написания изотопов. Они оба используют массу атома, где масса = (количество протонов) + (количество нейтронов). Первый способ – поставить массу перед символом элемента: 4He, 14С, 235U. Другой способ – выписать элемент и записать массу после дефиса рядом с названием элемента: Гелий-4, Карбон-14, Уран-238.
Водород является единственным элементом, где изотопам даны конкретные названия. Водород, который имеет нулевые нейтроны, называется протиумом. Водород с одним нейтроном называется дейтерием, с двумя – тритием. Дейтерий может образовывать воду с кислородом. Это называется «тяжелой водой», поскольку дейтерий имеет вдвое больше нормы водорода.
Изотопы бывают стабильные и нестабильные, природные и искусственные.
Когда изотоп нестабилен, он со временем приходит в упадок и превращается в другой изотоп или элемент. Нестабильные изотопы считаются радиоактивными – это все неестественные или техногенные элементы. Многие элементы существуют лишь в такой форме.
Большинство элементов, которые встречаются в природе, состоят из стабильных изотопов. Элементом с самыми стабильными изотопами есть олово, которое имеет десять различных устойчивых изотопов.
Природные изотопы распространены в природе. Искусственные в природе не встречаются, а образуются в результате ядерных реакций.
Интересные факты об изотопах:
Тяжелые изотопы, как правило, реагируют медленнее, чем более легкие того же элемента.
Известно 254 стабильных изотопов и 80 элементов, которые имеют по крайней мере один стабильный изотоп.
Двадцать шесть элементов имеют только один стабильный изотоп. Эти элементы называются моноизотопными.
Если в вашем учебнике не было такой информации, вы можете поискать ее в других учебных пособиях в разделе Учебники по химии за 8 класс.
Простые и сложные вещества
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества
Урок№9. Простые и сложные вещества.
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ
1. Твёрдое агрегатное состояние (исключение – ртуть)
2. Металлический блеск
3. Хорошие проводники тепла и электричества.
4. Пластичные и ковкие.
2. Металлическим блеском не обладают (исключение йод)
3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ.
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
На 2019 год в периодической таблице – 118 химических элементов, которые образуют около 500 простых веществ.
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
4. Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная характеристика смесей и химических