сульфид лития какая среда
Сульфид лития
| Сульфид лития | |
|---|---|
 | |
| Систематическое наименование | Сульфид лития |
| Хим. формула | Li2S |
| Рац. формула | Li2S |
| Состояние | твёрдое |
| Молярная масса | 46,95 г/моль |
| Плотность | 1,66 |
| Температура | |
| • плавления | 950 |
| • кипения | 1527 °C |
| Энтальпия | |
| • образования | −447 кДж/моль |
| Рег. номер CAS | 12136-58-2 |
| PubChem | 10290727 |
| Рег. номер EINECS | 235-228-1 |
| SMILES | |
| RTECS | OJ6439500 |
| ChemSpider | 8466196 |
| Токсичность | ирритант |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид лития, сернистый литий — Li2S, неорганическое бинарное соединение, литиевая соль сероводородной кислоты.
Содержание
Физические свойства
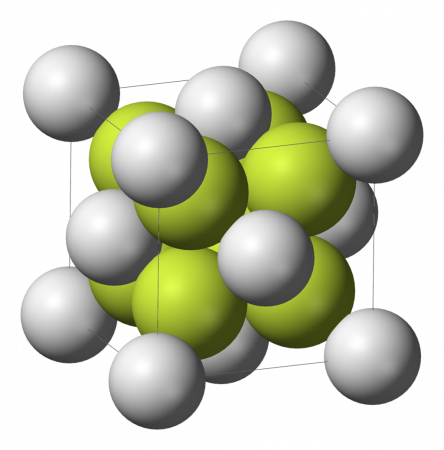
Сульфид лития представляет собой светло-жёлтое или бесцветное кристаллическое вещество, характеризующееся гранецентрированной кубической решёткой типа флюорита (a = 0,571 нм, z = 4, пространственная группа Fm3m), хорошо растворимое в воде, растворимое в спирте. Не образует кристаллогидратов.
Основные термодинамические характеристики:
Химические свойства
Получение
Одна из потенциальных проблем при получении сульфида лития заключается в легкости его окисления, особенно в присутствии воды. Кроме того, вследствие гидролиза препаративные методы, основанные на реакциях обмена в водных растворах, обычно непригодны.
Так как сульфид лития не встречается в природе в виде минерального сырья, существуют следующие промышленные способы его получения:
Среди прочих возможных методов производства можно отметить:
Полисульфиды лития
Для лития, в отличие от других щелочных металлов, полисульфиды не являются характерными соединениями и их получение требует особых условий.
Наиболее изучены:
Li2S2 — дисульфид лития, жёлтый порошок, получаемый кипячением спиртового раствора гидросульфида лития с избытком серы в токе водорода:
Li2S4 — тетрасульфид лития, неустойчивое вещество, получаемое реакцией лития с серой в жидком аммиаке:
Применение
Сульфид лития входит в состав анодов и твёрдого электролита для литиевых элементов питания (батареек и аккумуляторов). Также используется как депиляционный агент в косметических средствах.
Может использоваться как компонент в производства стёкол с высокой ионной проводимостью.
В современной органической химии сульфид лития иногда используется в качестве сульфидирующего агента, например, в следующей реакции:
Также имеются данные об использовании этого вещества в качестве катализатора при защите гидроксильных групп через получение триметилсилилового эфира.
Потенциальная опасность для здоровья
Опасность для здоровья сульфида лития Li2S определяется как токсичностью ионов лития (Li + ) из-за хорошей растворимости соединения в воде, так и токсичностью сероводорода, образующегося вследствие гидролиза этой соли.
Сероводород H2S в больших дозах вызывает раздражение слизистых оболочек глаз и дыхательных путей.
Сульфид лития какая среда
Установите соответствие между названием соли и отношением её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Соль сильного основания и сильной кислоты гидролизу не подвергается; соль слабого основания и сильной кислоты — гидролиз по катиону; соль сильного основания и слабой кислоты — гидролиз по аниону; соль слабого основания и слабой кислоты — гидролиз по катиону и аниону.
А) хлорид кальция — соль сильного основания и сильной кислоты гидролизу не подвергается (4).
Б) сульфит калия — соль сильного основания и слабой кислоты — гидролиз по аниону (2).
В) хлорид хрома (III) — соль слабого основания и сильной кислоты — гидролиз по катиону (1).
Г) нитрат лития — соль сильного основания и сильной кислоты гидролизу не подвергается (4).
Щелочную среду имеет раствор
4) сульфата аммония
Установите соответствие между названием соли и способностью её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | СПОСОБНОСТЬ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Соль сильного основания и сильной кислоты гидролизу не подвергается; соль слабого основания и сильной кислоты — гидролиз по катиону; соль сильного основания и слабой кислоты — гидролиз по аниону; соль слабого основания и слабой кислоты — гидролиз по катиону и аниону.
A) карбонат калия — соль сильного основания и слабой кислоты — гидролиз по аниону (3).
Б) иодид лития — соль сильного основания и сильной кислоты гидролизу не подвергается (1).
В) сульфид аммония — соль слабого основания и слабой кислоты — гидролиз по катиону и аниону (4).
Г) пропионат бария — соль сильного основания и слабой кислоты — гидролиз по аниону (3).
Установите соответствие между названием соли и способностью ее к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | СПОСОБНОСТЬ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Соль сильного основания и сильной кислоты гидролизу не подвергается; соль слабого основания и сильной кислоты — гидролиз по катиону; соль сильного основания и слабой кислоты — гидролиз по аниону; соль слабого основания и слабой кислоты — гидролиз по катиону и аниону.
A) ацетат калия — соль сильного основания и слабой кислоты — гидролиз по аниону (3).
Б) хлорид лития — соль сильного основания и сильной кислоты гидролизу не подвергается (1).
B) сульфид алюминия — соль слабого основания и слабой кислоты — гидролиз по катиону и аниону (4).
Г) нитрит кальция — соль сильного основания и слабой кислоты — гидролиз по аниону (3).
Олово из раствора его соли можно вытеснить
Более активный металл (стоящий левее катиона соли в ряду напряжений металлов) вытеснит его. Поскольку и медь и свинец находятся правее олова, они его из раствора солей вытеснять не будут, литий, хоть и находится левее олова, из-за своей высокой химической активности будет в первую очередь реагировать с водой. Таким образом, правильный ответ марганец.
Автор, указывайте что раствор водный. А то ведь есть и далеко не водные растворы, скажем в жидком аммиаке, или ещё в сотнях тысячах органических и неорганических растворителей.
Если не указано особо, то всегда подразумевается, что раствор водный.
Но ведь свинец находится ниже олова, следовательно активнее и тоже может вытеснять
Для реакций в водном растворе пользуйтесь рядом напряжений металлов
А литий же самый сильный,нет?
да, и поэтому он будет реагировать с водой, а не с ионами олова
Ионное строение имеет
Ионное строение характерно для веществ которые образуются из атомов металла и неметалла, это будет оксид лития.
Доброго времени суток
Оксид кремния и оксид лития имею ионное строение (по электроотрицательности связей)
Установите соответствие между формулой соли и окраской лакмуса в её водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОКРАСКА ЛАКМУСА | ||||||
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) сульфит калия — соль сильного основания и слабой кислоты, гидролиз по аниону (2).
Б) хлорид лития — соль сильного основания и сильной кислоты, гидролизу не подвергается (4).
В) нитрат железа (II) — соль слабого основания и сильной кислоты, гидролиз по катиону (1).
Г) сульфат меди (II) — соль слабого основания и сильной кислоты, гидролиз по катиону (1).
К веществам немолекулярного строения относится
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) сульфит калия — cоль, образованная сильным основанием и слабой кислотой гидролизуется по аниону (2).
Б) сульфат алюминия — cоль, образованная слабым основанием и сильной кислотой гидролизуется по катиону (1).
В) нитрат лития — cоль, образованная сильным основанием и сильной кислотой не гидролизуется (4).
Г) гидрофосфат аммония — cоль, образованная слабым основанием и слабой кислотой гидролизуется и по катиону и по аниону (3).
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) бромид цинка — cоль, образованная слабым основанием и сильной кислотой гидролизуется по катиону (1).
Б) нитрат бария — cоль, образованная сильным основанием и сильной кислотой не гидролизуется (4).
В) сульфид лития — cоль, образованная сильным основанием и слабой кислотой гидролизуется по аниону (2).
Г) ацетат аммония — cоль, образованная слабым основанием и слабой кислотой гидролизуется и по катиону и по аниону (3).
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) реагирует с кальцием, кислородом, серой, гидроксидом натрия, бромом, серной кислотой. Значит, верен вариант ответа № 1.
Б) реагирует с кальцием, серой, водой, аммиаком, гидроксидом натрия, оксидом лития, гидроксидом кальция. Значит, верен вариант ответа № 5.
В) реагирует с фосфорной кислотой, бромоводородом, гидроксидом натрия, бромом, серной кислотой, оксидом лития, гидроксидом кальция. Значит, верен вариант ответа № 3.
Г) реагирует с кислородом, серой, бромоводородом, бромом, ацетатом свинца, серной кислотой. Значит, верен вариант ответа № 4.
Гидролиз
По катиону, по аниону или нет гидролиза?
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Сульфит лития
Сульфи́т ли́тия — неорганическое вещество с формулой 
Содержание
Физические свойства
Химические свойства
Сульфит лития проявляет общие химические свойства, характерные для сульфитов щелочных металлов, а именно:
в водном растворе диссоциирует с образованием сульфит-аниона, который, гидролизуясь, создаёт осно́вную среду (pKb = 7,09)
при взаимодействии с сильными кислотами выделяется диоксид серы
при пропускании через раствор сульфита лития диоксида серы образуется гидросульфит лития
за счёт сульфит-аниона является восстановителем, например в реакции
Получение
Сульфит лития может быть получен пропусканием диоксида серы через насыщенный раствор гидроксида лития:
Применение
Примечания
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Сульфит лития» в других словарях:
Алюмогидрид лития — Алюмогидрид лития … Википедия
Карбонат лития — Эта статья о химическом соединении. О его применении в медицине см. Препараты лития. Карбонат лития Общие Химическая форм … Википедия
Фторид лития — Общие … Википедия
Гидроксид лития — Гидроксид лития … Википедия
Ортофосфат лития — Общие Систематическое наименование Ортофосфат лития Химическая формула Li3PO4 Физические свойства Состояние (ст. усл.) бел … Википедия
Пероксид лития — Общие Систематическое наименование Пероксид лития Химическая формула Li2O2 Физические свойства Молярная масса 45,881 г/моль … Википедия
Перхлорат лития — Общие … Википедия
Гидрид лития — Общие … Википедия
Нитрат лития — Нитрат лития … Википедия
Оксид лития — Оксид лития … Википедия













