Suvmax что это такое
Suvmax что это такое
Единый центр записи на ПЭТ/КТ в городах РФ.
Платно или по ОМС (только в Москве).
Все виды: глюкоза, холин, метионин, галлий.
ЕДИНЫЙ ЦЕНТР ЗАПИСИ НА ПЭТ/КТ
+7 (499) 753-77-85
ПЭТ/КТ с глюкозой делается в 15 городах России на платной основе и СРОЧНО!
ПЭТ с метионином делается только на платной основе и только в Санкт-Петербурге.
ПЭТ с тирозином делается только на платной основе и только в Уфе.
Помимо ПЭТ, всем нашим пациентам мы можем предложить эффективное лечение: пересмотр гистологии, лечение в ведущих клиниках Москвы и за границей.
20 интересных фактов о ПЭТ/КТ
1. Первые упоминания о ПЭТ появились в 50-х годах XX века.
2. Уже в 1972 году этот вид диагностики получил широкое распространение в США.
3. В России первое обследование ПЭТ было проведено в 1997 году.
20 интересных фактов о ПЭТ/КТ
4. Точность полученной при сканировании информации достигает 99%, тогда как при КТ и МРТ этот показатель в среднем составляет 70-85%.
5. В Европе лидер по ПЭТ/КТ исследованиям — Германия, где свыше 100 клиники имеет соответствующее оборудование, тогда как в России их число не превышает 30.
20 интересных фактов о ПЭТ/КТ
6. Результаты ПЭТ/КТ используют три отрасли медицины — онкология, кардиология, неврология.
7. Доза радиации при ПЭТ/КТ обследовании не превышает облучения при обычном рентгене.
8. Некоторые виды ПЭТ/КТ в России не проводятся. Например, обследование с галлием 68.
20 интересных фактов о ПЭТ/КТ
9. Диагностика ПЭТ/КТ выявляет опухоли на более ранних стадиях, чем КТ или МРТ, потому что метаболические нарушения можно зафиксировать тогда, когда структурные изменения еще отсутствуют.
10. В большинстве случаев информативность полученных снимков оказывается выше, чем у проведенной биопсии пораженного болезнью органа. Особенно это справедливо для обследования головного мозга с метионином.
20 интересных фактов о ПЭТ/КТ
11. ПЭТ/КТ — единственная возможность обнаружить метастазы при онкологии. При обследованиях с помощью КТ и МРТ метастазы выглядят только как затемнения на снимках. Врач может лишь предполагать о наличии онко-маркеров, тогда как при ПЭТ/КТ удается «увидеть» метастазы, получить исчерпывающую информацию об их расположении и качестве.
12. Методика позволяет обнаружить патологии размером до 1 мм.
20 интересных фактов о ПЭТ/КТ
13. В России ПЭТ/КТ есть только в 9 городах: Москве, Санкт-Петербурге, Воронеже, Екатеринбурге, Уфе, Курске, Орле, Тамбове, Липецке. Стоимость такого обследования в нашей стране намного дешевле, чем в Европе. Поэтому нет смысла ехать в Германию и Израиль где процедура стоит намного дороже.
14. с 2016 года в России ПЭТ КТ можно сделать бесплатно по полису ОМС. Для этого нужно получить соответствующее направление от врача и записаться на обследование в одной из клиник, где доступна эта услуга.
20 интересных фактов о ПЭТ/КТ
15. После ПЭТ/КТ нет необходимости в других видах диагностики — обычно это исследование дает ответы на все вопросы.
16. Ошибки при ПЭТ/КТ связаны только с человеческим фактором: неверной трактовкой результатов, неправильной подготовкой к обследованию, нарушением технологии сканирования и др.
20 интересных фактов о ПЭТ/КТ
17. Большинство опухолей активно питается глюкозой, поэтому для обследования чаще всего используют РФП 18F-фтордезоксиглюкозу — она накапливается в онкологическом очаге. Однако этот РФП не подходит для исследования головного мозга, который всегда активно поглощает это вещество.
18. Единственное абсолютное противопоказание для обследования — беременность. Остальные входят в разряд относительных.
20 интересных фактов о ПЭТ/КТ
19. В некоторых случаях проводят ПЭТ/КТ с контрастом — помимо радиоферментов пациенту вводят контрастное йодсодержащее вещество, повышающее точность и информативность обследования.
20. От качества подготовки к ПЭТ/КТ зависит и точность полученных данных. Пациенту предписывают соблюдать специальную диету и не перенапрягаться за 2-3 дня до сканирования.
Соотношение SUVmax с патологическими характеристиками первичной опухоли и значение отношения SUVmax к опухолевому / лимфатическому узлу для прогнозирования метастазов в лимфатические узлы у пациентов с резецированным НМРЛ
Мы стремились исследовать корреляцию максимального стандартизированного значения поглощения (SUVmax) с патологическими характеристиками первичной опухоли и определить отношение SUVmax опухолевого / лимфатического узла (T / LN), предсказывающее метастазы в лимфатические узлы у пациентов с НМРЛ.
Ретроспективно оценивали 80 пациентов с НМРЛ, у которых была проведено ПЭТ / КТ-исследование при начальной постановке, а затем была проведена хирургическая резекция. Было 100 ПЭТ / КТ позитивных медиастинальных или внутригрудных лимфатических узлов. Патологические характеристики опухоли, такие как наибольший диаметр опухоли, гистология опухолей, дифференцировка, число митозов, степень воспаления стромы, некроз; этиология PET / CT положительных станций лимфатических узлов; Было зарегистрировано SUVmax первичных опухолей и положительных станций лимфатических узлов. Для каждой станции лимфатических узлов рассчитывали отношение SUV max к T / LN.
SUVmax первичной опухоли положительно коррелировал с наибольшим диаметром опухоли (p = 0,001, r = 0,374), количеством митозов (p 0,05).
Отношение T / LN SUVmax 5 или ниже указывает на наличие злокачественного лимфатического узла с чувствительностью 92,8% и спецификой 47% (p = 0,01) (рисунок 2).
Кривая рабочих характеристик приемника (ROC) для оптимального значения обрезания для отношения SUVmax опухолевого / лимфатического узла. Площадь под кривой: 0,716; 95% доверительный интервал: 0,584-0,847; р = 0,01. Отношение T / LN SUVmax 5 или ниже указывает на то, что лимфатический узел является злокачественным с чувствительностью 92,8% и специфичностью 47%.
Настоящее исследование показало, что SUVmax первичной опухоли положительно коррелирует с наибольшим диаметром опухоли, количеством митозов и патологической стадией заболевания. Среднее значение SUVmax и количество митозов были выше в SCC по сравнению с AC. N ступеней были продвинуты в ГТК. Реактивная гиперплазия и антракоз были основной этиологией для положительных лимфатических узлов на ПЭТ / КТ. Отношение T / LN SUVmax 5 или ниже указывает на злокачественный лимфатический узел с высокой чувствительностью (92,8%), но с низкой специфичностью (47%).
Деятельность FDG, другими словами, SUVmax, измеренная на PET / CT, является полуколичественным значением, которое указывает на степень поглощения глюкозы при поражении. Точный механизм поглощения ФДГ остается неизвестным. Большинство раковых опухолей легких накапливают ФДГ преимущественно, что SUVmax может широко варьироваться [11,18]. SUVmax опухоли является продуктом нескольких фундаментальных факторов, включая метаболизм глюкозы и тип / количество клеток, присутствующих в опухоли. Более высокий SUVmax может быть результатом либо более высокой митотической активности опухолевых клеток, либо большего количества воспалительных клеток (лимфоцитов, макрофагов), которые конкурируют с использованием ФДГ-глюкозы. Альтернативно, может быть большое количество опухолевых клеток с низкой метаболической активностью или с низким числом опухолевых клеток с высокой метаболической активностью [11]. В настоящем исследовании мы обнаружили положительную корреляцию между опухолевым SUVmax и числом митозов, поддерживающим роль более высокой митотической активности в механизме поглощения ФДГ. Не было корреляции между опухолевым SUVmax и степенью воспаления стромы.
Размер опухоли и наличие некроза являются другими факторами, которые влияют на SUVmax опухоли. Предыдущие исследования продемонстрировали положительную корреляцию между диаметром опухоли и SUVmax 20. Увеличение диаметра опухоли также коррелировало с увеличением экспрессии глюкозы-транспортера-1 (Glut-1) на поверхности опухолевых клеток, что привело к увеличению поглощения ФДГ [23]. В этом исследовании наибольший диаметр опухоли был положительно коррелирован с SUVmax в AC, SCC и всей исследуемой группе. Как и ожидалось, более крупные опухоли были более некротическими. Вопреки общепринятой мудрости, что некроз опухоли разбавляет стандартную величину поглощения, больше некроза не связано с более низким SUVmax. Не было никакой корреляции между SUVmax и степенью некроза. Это условие можно объяснить тем, что SUVmax рассчитывается из самых высоких областей поглощения ФДГ опухоли.
В соответствии с предыдущими исследованиями [6,19,21,22,24] это исследование показало, что SCC имеет более высокие значения SUVmax по сравнению с AC. Это можно объяснить двумя способами. Во-первых, ГТК являются быстро растущими опухолями с более коротким периодом удвоения, что приводит к более высоким уровням метаболизма глюкозы [18]. Во-вторых, экспрессия Glut-1 выше в SCC. Локализация Glut-1 также важна в процессе поглощения FDG. Хотя Glut-1 в основном находится в цитоплазме опухолевых клеток в AC, он в основном расположен на клеточных мембранах опухолевых клеток в SCC. Локализация клеточной мембраны более важна в процессе поглощения ФДГ [25, 26].
Связь между опухолевым SUVmax и дифференцировкой противоречива в литературе. Некоторые исследования показали, что опухоль SUVmax была выше в слабо дифференцированных НМРЛ [22,28]. В другом исследовании не было обнаружено корреляции между SUVmax и степенью дифференцировки в SCC [19]. В настоящем исследовании не было никакой связи между опухолевым SUVmax и дифференцировкой в SCC. Но степень стромального воспаления была выше при плохо дифференцированных опухолях.
Установлено, что более высокий SUVmax первичной опухоли является сильным предиктором инвазии лимфатических сосудов и метастазирования лимфатических узлов в исследованиях, состоящих из ранних пациентов с НМРЛ раннего периода [21,29]. В исследовании, проведенном на небольшой группе резецированных пациентов с раком легких, авторы исследовали корреляцию SUVmax с вероятностью метастазирования лимфатических узлов и сообщили, что, когда SUVmax первичной опухоли больше 12, вероятность метастазирования лимфатических узлов была высокой, достигая 70%, независимо от степени активности ФДГ в узлах лимфатических узлов [6]. В настоящем исследовании опухоль SUVmax коррелировала с патологическим T-этапом, стадией заболевания, но не с N-стадией. Средняя опухоль SUVmax не отличалась у пациентов с метастатическими лимфатическими узлами и без них (таблица 6). В отличие от текущей литературы, в которой сообщается о гистологии AC как фактор риска для оккультных метастазов лимфатических узлов N2 [12,13], в этом исследовании N-этапы были продвинуты в SCC, которые имеют более высокий SUVmax по сравнению с AC.
В настоящее время ПЭТ / КТ считается наиболее точным методом визуализации в N-постановке рака легких. Однако существует значительное количество ложной позитивности и ложной негативности. Основной причиной ложной негативности является микроскопический метастаз вне пространственного разрешения ПЭТ / КТ. Основными причинами ложной положительности являются вовлечение лимфатических узлов подстилающим воспалительным заболеванием (туберкулез, гистоплазмоз), лимфаденопатиями, вторичными по отношению к обструктивной пневмонии, иммунной реакцией из-за наличия опухоли легкого, антракоза и силикотических узлов [6,8]. Основная причина ложной позитивности может варьироваться от региона к региону. В исследовании из Алабамы инфекция гистоплазмоза была наиболее распространенной причиной ложной позитивности [7]. Было установлено, что силикоз является причиной ложной позитивности в исследовании из Германии [30]. В настоящем исследовании, в 40% случаев положительных лимфоузлов ПЭТ / КТ наблюдался антракоз, вероятно, из-за интенсивного загрязнения воздуха внутри помещений или воздействия биомассы. Гранулематозное воспаление (4%) и силикоз (3%) были низкими.
В настоящем исследовании, отличном от литературы, мы рассматривали станцию лимфатических узлов как положительную, если было обнаружено поглощение ФДГ выше, чем окружающая средостенная ткань, в связи с идеей о том, что опухоль с низкой активностью ФДГ может иметь метастатический лимфатический узел с низкая активность FDG. Таким образом, мы устанавливаем низкий порог (любое поглощение ФДГ выше, чем окружающий медиастинальный пул крови), чтобы избежать ложноотрицательных лимфатических узлов и принимать более высокую частоту ложных срабатываний. Все метастатические лимфатические узлы имели SUVmax выше 2,5. Чувствительность (63,6%) и специфичность (72,4%) ПЭТ / КТ была ниже, чем текущая литература, из-за более низкого порога, который мы выбираем для позитивности ПЭТ / КТ.
В настоящем исследовании мы предположили, что отношение T / LN SUVmax может быть предиктором метастазирования лимфатических узлов. Эта гипотеза была основана на клиническом наблюдении, что значение отсечки 2,5 для прогнозирования метастазов слишком низкое в странах, где воспалительные реакции более предрасположены. Кроме того, в клинической практике мы поняли, что некоторые опухоли с низкими значениями SUVmax имеют метастатические лимфатические узлы после резекции, несмотря на более низкие значения SUVmax, чем 2,5 на PET / CT, полученные до операции. Настоящее исследование одобряет эту гипотезу. Как показано в таблице 6, в то время как средние значения SUVmax не различались между метастатическими и неметастатическими лимфатическими узлами, отношение T / LN было значительно ниже в метастатических. Отношение T / LN SUVmax было сходным в антракотических и реактивных лимфатических узлах. Отношение T / LN SUVmax 5 или ниже указывает на злокачественный лимфатический узел с высокой чувствительностью, но с низкой специфичностью. Поскольку это исследование проводится в популяции, где распространенность воспалительных заболеваний высока, отношение T / LN SUVmax может демонстрировать вариации в разных популяциях пациентов.
В литературе Cerfolio et al также определили отношение LN / T SUVmax как универсального предиктора метастазирования лимфатических узлов, чтобы исключить изменение SUVmax среди разных сканеров ПЭТ, и задокументировали, что, когда отношение составляет 0,56 или выше, существует 94% вероятность того, что узел злокачественный [31].
Существуют некоторые ограничения настоящего исследования. Во-первых, это ретроспективное исследование с ограниченным числом пациентов. Исследовательская популяция состоит из пациентов, которые подверглись хирургическому вмешательству только, что может привести к смещению выбора. Поскольку во всех случаях были ранние раковые заболевания легких, которые были кандидатами на лечебную хирургию, количество метастатических лимфатических узлов было низким. Проспективные исследования, в том числе больше станций лимфатических узлов, необходимы для проверки валидации отношения SU / MAX T / LN для прогнозирования метастазов.
В заключение, SUVmax первичной опухоли связан с некоторыми патологическими характеристиками, такими как наибольший диаметр, гистология и число митозов. Коэффициент SUVmax T / LN ниже 5 предсказывает метастаз в лимфатические узлы с высокой чувствительностью.
SUVmax: максимальное стандартизированное значение поглощения; ПЭТ / КТ: позитронно-эмиссионная томография с компьютерной томографией; T / LN: опухоль / лимфатический узел; ФДГ: фтордезокси глюкоза; НМРЛ: немелкоклеточный рак легких; AC: аденокарцинома; SCC: Плоскоклеточная карцинома.
Все авторы раскрывают, что не существует какого-либо фактического или потенциального конфликта интересов, включая любые финансовые, личные или иные отношения с другими людьми или организациями, которые могут ненадлежащим образом влиять (предвзято) на их работу.
DK разработало исследование, собрало данные, интерпретировало результаты и разработало статью. FD провела патологическую оценку. HB задумал исследование, участвовал в его разработке и координации и помог разработать рукопись. OO провела интерпретацию изображений PET / CT. ET провела интерпретацию изображений PET / CT. BB участвовал в разработке исследования и проводил статистический анализ. КА участвовала в разработке исследования и координации. EY участвовала в разработке исследования и координации. Все авторы прочитали и утвердили окончательную рукопись.
Радионуклидная диагностика в онкологии
ГУ – Медицинский радиологический научный центр РАМН,
Обнинск, ул. Королева 4, 249036 г., Калужская область, Российская Федерация
Адрес для переписки: Герман Анатольевич Давыдов; e-mail:
Ключевые слова: онкология, диагностика, радионуклиды.
Ранняя диагностика злокачественных новообразований остается одной из наиболее актуальных задач современной медицины. Возможности методов ядерной медицины в онкологии основаны в первую очередь на выявлении метаболических нарушений в опухолях и окружающих тканях. Принцип функциональной визуализации опухолей отличает методы ядерной медицины от анатомо-топографических методов лучевой диагностики (ультразвуковой томографии, рентгеновской компьютерной томографии и магнитно-резонансной томографии), которые оценивают динамику новообразований по изменению их размеров и структуры. Особенности радионуклидных методов позволяют использовать их для выявления опухолевых поражений в ситуациях, когда структурные изменения не определяются или неспецифичны, а также для оценки раннего ответа опухоли на специфическую терапию, в целях прогнозирования результатов лечения.
Наряду с однофотонной эмиссионной компьютерной томографией (ОФЭКТ), основанной на использовании гамма-излучающих радионуклидов, все большую диагностическую роль в онкологии играет позитронная эмиссионная томография (ПЭТ). Использование в качестве метки биологически важных ультракороткоживущих позитрон-излучающих радионуклидов ( 11 C, 13 N, 15 O, 18 F), позволило создать радиофармпрепараты, обладающие уникальными свойствами (РФП). ПЭТ обеспечивает лучшие возможности для дифференциальной диагностики злокачественных и доброкачественных новообразований, определения распространенности опухолевого процесса, раннего выявления рецидивов и оценки эффективности проводимого лечения.
Основными задачами радионуклидной диагностики при исследовании онкологических больных являются следующие:
РФП для сцинтиграфической диагностики опухолевого процесса
Применяемые для диагностики опухолей РФП разделяют на следующие группы:
РФП, способные накапливаться в интактных тканях, окружающих опухоль
РФП этой группы отличаются тропностью к той или иной ткани организма, что позволяет выявить наличие опухоли как область пониженного накопления индикатора – «дефект накопления». К ним относятся: 99m Тс-коллоид, который аккумулируется в купферовских клетках печени. 99m Тс-пертехнетат и изотопы йода ( 123 I или 131 I), использующиеся для диагностики опухолей щитовидной железы. Недостатком методик с использованием этих препаратов является невысокая специфичность, так как любое объемное поражение (например, киста) визуализируется аналогичным образом.
РФП, способные накапливаться в тканях, подверженных неспецифическим изменениям со стороны опухоли
Использование РФП данной группы основано на свойстве их повышенного включения в участки ткани, окружающие новообразование. Так, окружающие костную опухоль ткани реагируют на ее рост повышенной остеобластической активностью. Фосфатные комплексы 99m Тс, накапливаясь в остеобластах этих участков, позволяют визуализировать костные метастазы и первичные опухоли костей на самой ранней стадии их развития как очаги гиперфиксации РФП. Метод остеосцинтиграфии обладает высокой чувствительностью, однако специфичность его невысока. Высокое накопление указанных РФП в костной ткани может наблюдаться также при травмах, воспалительных и дистрофических заболеваниях.
С целью паллиативной терапии метастазов в кости применяются меченный самарием-153 этилендиаминтетраэтиленфосфонат и меченный рением-186 этидронат, накапливающиеся в участках с повышенной остеобластической активностью.
РФП, тропные к мембранам опухолевых
клеток по реакции «антиген-антитело»
В основе диагностического применения РФП данной группы в онкологии лежит реакция связывания меченых моноклональных антител с антигенами мембран раковых клеток. В радионуклидной диагностике нашли применение как целые антитела типа IgG, так и их фрагменты (Fab-fragments of antibody). Для диагностики колоректального рака применяется препарат на основе целых антител – 111 In-Онкосцинт, а также фрагментов антител – 99m Tc-КЭА-Скан. Преимуществом фрагментов меченых антител является более высокая онкоспецифичность. Однако ускоренный клиренс фрагментов антител из крови за счет более быстрого, по сравнению с большими молекулами иммуноглобулинов, выведения почками может снижать соотношение «опухоль/фон» в злокачественных новообразованиях с обедненным кровотоком. Кроме того, технология получения Fab является достаточно трудоемкой и дорогостоящей.
РФП, тропные к мембранам опухолевых
клеток по механизму клеточной рецепции
Применение таких РФП для сцинтиграфической диагностики основано на их тропности к некоторым рецепторам мембран опухолевых клеток.
Из индикаторов такого типа наиболее часто используются аналоги соматостатина – окреотид, меченный 111 In, и 99m Тс-депреотид (NeoSpect). Соматостатин представляет собой тетрадекапептид, секретируемый гипоталамусом, который подавляет выделение нейроэндокринных гормонов (гормон роста, глюкагон, инсулин и гастрин). Во многих злокачественных опухолях и при некоторых воспалительных заболеваниях плотность рецепторов соматостатина значительно повышается. Гиперэкспрессия рецепторов соматостатина наблюдается в большинстве нейроэндокринных опухолей, включая мелкоклеточный рак легкого, а также в перитуморальных венах некоторых опухолей человека.
Меченые аналоги соматостатина нашли применение для диагностики ряда нейроэндокринных опухолей (карциноид, феохромацитома, параганглиома, меланома), мелкоклеточного рака легких, новообразований центральной нервной системы и лимфом. Чувствительность и специфичность сцинтиграфического выявления таких злокачественных новообразований с применением 111 In-окреотида превышает 80%. Вместе с тем, диагностика онкологических поражений печени и селезенки с этим РФП существенно затруднена по причине высокого уровня неспецифической аккумуляции данного индикатора в указанных органах. Депреотид, меченный 99m Тс, используется преимущественно для выявления рака легкого. При этом чувствительность диагностики злокачественных солитарных легочных новообразований в комбинации сцинтиграфии с КТ или рентгенографией грудной клетки достигает 97% при специфичности 73% [1].
В последние годы в онкологической практике нашли применение меченные 123 I пептиды, которые также способны связываться с мембранами опухолевых клеток. Среди них следует отметить 123 I-вазоактивные кишечные пептиды для визуализации злокачественных новообразований желудочно-кишечного тракта и поджелудочной железы; 123 I-ά-меланоцитостимулирующий гормон для диагностики меланом; 123 I-инсулин, накапливающийся в гепатомах, и 123 I-нейропептиды для выявления мелкоклеточного рака легкого.
Специфические РФП, проникающие в опухолевые клетки
Радиофармпрепараты указанной группы включаются в специфический метаболизм опухолей. К ним относятся изотопы йода 123 I и 131 I, 123 I-метайод-бензил-гуанидин ( 123 I-МИБГ) и пятивалентный 99m Тс (V)-ДМСА.
Йод-131 уже более 50 лет успешно используется для диагностики метастазов фолликулярного и папиллярного рака щитовидной железы, поскольку дифференцированные опухоли щитовидной железы сохраняют способность захватывать йод и включать его в синтез тиреоидных гормонов. Метастазы раковой опухоли обнаруживаются в виде участков экстратиреоидного эктопического накопления.
В последние годы для выполнения радиодиагностических процедур все чаще вместо 131 I используют 123 I, который имеет ряд преимуществ: оптимальный для регистрации спектр энергетического излучения (159 кэВ) и короткий период полураспада (13,2 часа), способствующий уменьшению лучевой нагрузки на пациента.
К специфическим опухолетропным препаратам относится также 123 I-МИБГ, который через норэпинефриновый механизм поглощения превращается в катехоламины адренергических нервных окончаний и клеток мозгового слоя надпочечников, позволяя тем самым визуализировать надпочечники. Наряду с этим была показана высокая эффективность использования указанного РФП для диагностики и терапии нейроэндокринных опухолей, особенно феохромоцитом, нейробластом, карциноида, медуллярного рака щитовидной железы и параганглиом. Для радиотерапевтических целей используется МИБГ, меченный 131 I.
К РФП этой группы также относят пятивалентный 99m Тс(V)-ДМСА, специфично накапливающимся в клетках медуллярного рака щитовидной железы. Однако механизм аккумуляции 99m Тс(V)-ДМСА в опухоли остается неизученным [1, 7].
Неспецифические РФП, проникающие в опухолевые клетки
Цитрат галлия-67 ( 67 Ga-цитрат) уже много лет успешно используется как туморотропный радиофармпрепарат. 67 Ga после внутривенного введения образует комплекс с трансферрином крови, который связывается с рецепторами некоторых опухолевых клеток. Посредством инвагинации целлюлярной мембраны 67 Gа-трансферрин попадает внутрь клетки и, образовав комплекс с лактоферрином, остается в ней [1, 7].
67 Ga-цитрат хорошо зарекомендовал себя в качестве РФП для радионуклидной диагностики лимфом и мелкоклеточного рака легких. В литературе описаны случаи применения этого РФП и для выявления других злокачественных образований. В то же время, неспецифическая аккумуляция 67 Ga-цитрата в печени и экскреция в желудочно-кишечный тракт ограничивают его использование для диагностики опухолей брюшной полости. Специфичность метода снижает также аккумуляция 67 Ga-цитрат в зонах инфекции и воспаления. Сцинтиграфия с этим РФП особенно эффективна для динамического наблюдения за больными с верифицированными злокачественными новообразованиями в динамике химио- или лучевой терапии.
Изотопы таллия ( 201 Тl и 199 Тl), являясь биологическим аналогом калия, поступают внутрь клетки с помощью натрий-калиевого АТФ-зависимого насоса и локализуются в митохондриях. Эти РФП аккумулируются преимущественно в тканях с интенсивным энергетическим обменом (к числу которых относятся атипичные клетки) и широко используются для диагностики самых разнообразных опухолей, включая новообразования бронхов, лимфомы, рак щитовидной железы, костей и головного мозга. Как и цитрат 67 Ga, изотопы таллия успешно применяют для динамической оценки противоопухолевой терапии.
В последнее время в ядерной онкологии стали активно использоваться комплексы технеция-99m с метокси-изобутил-изонитрилом ( 99m Тс-МИБИ) и тетрофосмином (миовью), благодаря способности этих РФП к усиленной аккумуляции в митохондриях злокачественных клеток. Наиболее активно эти индикаторы используют для выявления рака молочной железы, опухолей легких, лимфом и миеломной болезни [1, 7].
РФП для позитронно-эмиссионной томографии
Позитронно-излучающий РФП 18 F-фтордезоксиглюкоза ( 18 F-ФДГ) позволяет с высокой чувствительностью выявлять самые разнообразные злокачественные новообразования.
Аккумуляция этого индикатора в клетке прямо пропорциональна эффективности функционирования белкового переносчика глюкозы и коррелирует с активностью гексокиназы II – фермента, реализующего обмен гидроксильной группы глюкозы на фосфатный комплекс АТФ. Фосфорилированный метаболит 18 F-фтордезоксиглюкозы теряет способность к транспорту через мембрану клетки и остается интрацеллюлярно. Таким образом, ФДГ в отличие от обычной глюкозы, попадая внутрь клетки, участвует только в начальных этапах гликолиза, поэтому не распадается, за счет чего и происходит ее прогрессивное накопление в клетке (феномен «метаболической ловушки»). Высокое соотношение концентрации РФП «опухоль/фон» достигается, таким образом, за счет заметно более высокой активности гексокиназы II в малигнизированных клетках. Визуализация опухолей осуществляется за счет повышенной гликолитической активности клеток опухолевой ткани и повышенной активности глюкозных транспортеров на мембранах опухолевых клеток, осуществляющих захват глюкозы внутрь клетки. При этом биологическая активность опухоли прямо пропорциональна степени метаболического захвата глюкозы 2.
Применение другого неспецифического позитронно-излучающего РФП 11 С-метионина для диагностики опухолей базируется на высоком уровне аминокислотного обмена в активно пролиферирующих клетках злокачественных опухолей. Этот индикатор используется при выявлении лимфом, злокачественных новообразований шеи и головы.
Для диагностики новообразований методом ПЭТ применяется ряд туморотропных РФП, визуализирующих злокачественные опухоли как очаги нарушения метаболизма. Для изучения нарушений углеводного обмена (клеточная энергетика) применяется 18F-фтордеоксиглюкоза (18F-ФДГ); клеточного транспорта аминокислот – 11С-метионин; процессов клеточного синтеза белков – 11С-тирозин, 11С-лейцин; скорости клеточной пролиферации – 11С-тимидин (как маркер синтеза ДНК) и 11С-холин (участвующий в биосинтезе клеточной мембраны); синтеза липидов – (11С-ацетат); степени гипоксии опухолевой ткани – 18F-фтормизонидазол [4].
Индикаторы гипоксии являются перспективными РФП для сцинтиграфической диагностики злокачественных новообразований. Визуализация малигнизированных тканей в этом случае становится возможной потому, что в центральных областях опухоли имеют место обеднение кровотока и сопутствующая гипоксия. Нитроимидазол путем диффузии проникает внутрь клетки за счет липофильности своей молекулы, образуя в условиях гипоксии ряд недоокисленных продуктов своего превращения. Эти метаболиты связываются с компонентами клетки и, в отличие от нормы, фиксируются интрацеллюлярно [2, 8].
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПЭТ В ОНКОЛОГИИ
ПЭТ в настоящее время нашла широкое применение во многих областях медицины. Первый опыт использования этого метода был посвящен функциональным исследованиям головного мозга. В дальнейшем ПЭТ стала успешно использоваться для диагностики различных форм деменции, очаговых форм эпилепсии.
В кардиологии ПЭТ-исследования сердца дают уникальную информацию о жизнеспособности миокарда, таким образом определяя целесообразность кардиохирургических вмешательств. Однако самым востребованным метод ПЭТ оказался в онкологии. Этому способствовало появление и начало серийного изготовления установок для ПЭТ «всего тела», а также разработка большого ассортимента позитронно-излучающих туморотропных РФП. Ценнейшая информация, получаемая при исследованиях больных злокачественными новообразованиями, сделала ПЭТ одним из ведущих диагностических методов. Это обстоятельство привело к резкому возрастанию относительной доли онкологических ПЭТ-исследований, которая в настоящее время составляет около 90%.
Самой распространенной и наиболее освоенной методикой является ПЭТ с 18F-фтордеоксиглюкозой (18F-ФДГ). Количество этих исследований приобрело такой размах, что, по мнению ведущих специалистов ядерной медицины, 18F-ФДГ завоевала в 1990-х гг. номинацию «молекулы века» [4, 6].
Применение ПЭТ в диагностике рака легких
ПЭТ c ФДГ высоко эффективна в дифференциальной диагностике первичных опухолей у больных с солитарными легочными узлами: прогностическая ценность положительного результата – 90%, отрицательного результата – до 100%.
Ложноотрицательный результат может наблюдаться при поражениях менее 1 см, опухолях с низкой метаболической активностью (например, карциноидных), бронхоальвеолярном раке. Повышенное включение ФДГ возможно при различных воспалительных заболеваниях. В сомнительных случаях поражения с повышенным захватом ФДГ должны считаться злокачественными, пока не будет доказано обратное.
Оценка региональных лимфоузлов средостения у потенциально операбельных больных немелкоклеточным раком легкого превышает результаты КТ и составляет: чувствительность 89%, специфичность 92% и точность 90%. Лучшие результаты ПЭТ объясняются тем, что размеры лимфоузлов являются относительным критерием метастатического поражения. Лимфоузлы могут быть увеличены вследствие воспаления или инфекции, а мелкие узлы могут содержать метастазы.
При выявлении внутригрудных метастазов ПЭТ несколько точнее КТ. По сравнению со стандартной остеосцинтиграфией с 99m Tc-метилендифосфонатом, ПЭТ имеет большую специфичность (98% против 61%) при аналогичной чувствительности (до 90%) при визуализации метастазов в кости. Интерпретация сцинтиграфии костей с МДФ затруднена из-за ложноположительных результатов при воспалительных и дистрофических изменениях костей и суставов.
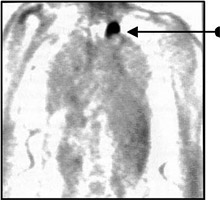
Отмечается высокая эффективность ФДГ-ПЭТ в выявлении рецидивов немелкоклеточного рака легкого. При подозрении КТ на рецидив ПЭТ способна дифференцировать посттерапевтические рубцы и опухоли с чувствительностью 97-100%, специфичностью 62-100% и точностью 78-98% (Рис.1). Чтобы избежать ложноположительных результатов ПЭТ вследствие лучевого пневмонита или гликолиза макрофагов внутри опухолевого некроза, исследование рекомендуется проводить через 4-6 месяцев по окончании лечения.
Показаниями к проведению ПЭТ с ФДГ у больных немелкоклеточным раком легкого являются: дифференциальная диагностика первичной опухоли, определение распространенности опухолевого процесса, выявление рецидивов.
Рис. 1. Результат ПЭТ-исследования. Выявление рецидивной опухоли верхушки левого легкого.
Применение ПЭТ в диагностике рака толстой кишки
Основными задачами ПЭТ с ФДГ при исследовании больных раком толстой кишки являются:
Метод ПЭТ недостаточно эффективен при диагностике регионарных лимфоузлов. Причина низкой чувствительности объясняется расположением большинства лимфоузлов вблизи первичной опухоли или наличием в них микрометастазов. Однако отсутствие вовлечения лимфоузлов не вызывает изменения в лечении, поскольку удаление брыжейки без первичного поражения является частью лечебной процедуры. ПЭТ является наиболее чувствительным (90-95%) методом выявления метастазов в печень колоректального рака, в чем превосходит КТ, при специфичности 88-100%. Исключение отдаленных метастазов до операции и повторных резекциях является важным показанием ФДГ-ПЭТ у больных колоректальным раком.
Показаниями к ПЭТ у больных с выявленным или подозреваемым рецидивом являются: увеличение опухолевых маркеров, аномальное поражение при стандартной визуализации (КТ и МРТ), дифференциальная диагностика местных рецидивов и посттерапевтических (хирургических, лучевых и химиотерапевтических) изменений. ПЭТ позволяет дифференцировать рецидив опухоли от захвата ФДГ вследствие лучевой терапии (спустя 6 месяцев после лечения). По данным ПЭТ выявляется больше поражений, чем при КТ, что приводит к серьезным изменениям в лечении у 48% больных.
Примером успешной дифференциальной диагностики между рецидивом опухоли и послеоперационной рубцовой тканью является выявление, по данным ПЭТ, рецидива рака прямой кишки после брюшно-промежностной экстирпации прямой кишки, когда эндоскопия оказалась невозможной, а УЗИ и КТ не позволяли дифференцировать рецидив и послеоперационные рубцовые изменения (Рис.2).
Рис. 2. ПЭТ с 18F-ФДГ. Визуализация рецидива рака прямой кишки (а) на фоне физиологического накопления
радиофармпрепарата в головном мозге и почках.
Применение ПЭТ в диагностике гемобластозов
При исследовании больных злокачественными лимфомами перед ФДГ-ПЭТ ставятся задачи по определению стадии опухолевого процесса, оценке эффективности лечения, выявлению рецидивов заболевания. Диагностическое обследование больных злокачественными лимфомами является одним из наиболее значимых показаний для проведения ПЭТ с ФДГ.
При стадировании злокачественной лимфомы ФДГ-ПЭТ имеет одинаковую специфичность с РКТ (90%), однако превосходит ее в чувствительности (92% и 65% соответственно). Точность оценки состояния селезенки при первичном стадировании злокачественной лимфомы для ФДГ-ПЭТ составляет около 100% (для КТ –57%), а точность диагностики поражения костного мозга посредством ФДГ-ПЭТ сопоставима с таковой при биопсии костного мозга.
ПЭТ с ФДГ успешно применяется для оценки эффективности проводимого лечения. Контроль ответа на химиотерапию обычно проводится через 3-4 цикла лечения. По данным некоторых исследователей, прогностическая информация может быть получена уже после первого цикла химиотерапии (Рис.3).
Рис. 3. ПЭТ-исследование при злокачественной лимфоме:
а) до лечения (поражение правых шейно-надключичных и медиастинальных лимфоузлов);
б) после эффективного лечения (отсутствие активных очагов специфической ткани).
Применение ПЭТ в диагностике метастазов меланомы
Меланома относится к опухолям с наиболее выраженным гликолизом, высоким захватом ФДГ и соотношением «опухоль-кровь». Основными задачами ПЭТ с ФДГ при обследовании больных меланомой являются: диагностика местной и региональной распространенности опухолевого процесса у больных меланомой высокого риска (толщина первичной опухоли больше 4,0 мм с прорастанием в подкожные ткани), выявление отдаленных метастазов и рецидивов опухоли.
В диагностике первичной опухоли и пораженных регионарных лимфоузлов в стадиях 1-2 метод ПЭТ с ФДГ обладает низкой чувствительностью, большая по величине опухоль выявляется отчетливо. В стадии 3 визуализируются практически все метастазы в регионарные лимфоузлы размерами более 10 мм, 83% метастазов размерами 6-10 мм и 13% метастазов меньших размеров.
В диагностике метастазов во внутренние органы общая чувствительность ПЭТ с ФДГ составляет 80-100%. Наиболее полезна ПЭТ у больных с наличием метастазов в брюшной полости (чувствительность – до 100%). По сравнению со стандартной КТ, ПЭТ более чувствительна и специфична в визуализации метастазов в кости, тонкую кишку и лимфоузлы, в то время как метастазы в легкие выявляются хуже. В диагностике метастазов в печень ПЭТ более чувствительна, чем УЗИ, КТ и МРТ.
Применение ПЭТ в диагностике
распространенности рака пищевода и желудка
Основными задачами исследования ПЭТ с ФДГ у больных раком пищевода и желудка являются: стадирование лимфоузлов и выявление отдаленных метастазов у больных с резектабельной опухолью.
Первичные опухоли пищевода и желудка, ограниченные слизистой оболочкой, с помощью ФДГ-ПЭТ визуализируются плохо. Их выявление становится возможным только при инвазии опухоли в подслизистый слой. Специфичность ПЭТ в стадировании лимфоузлов выше, чем у других методов лучевой диагностики (КТ, эндоскопической сонографии). В оценке отдаленных метастазов (в лимфоузлах, печени, плевре, грудной клетке и костях) ПЭТ с ФДГ имеет большую точность по сравнению со стандартным использованием СКТ и УЗИ. ПЭТ обладает высокой диагностической эффективностью в выявлении рецидивов рака пищевода, однако в диагностике перианастомотических рецидивов часто дает ложноположительные результаты из-за накопления ФДГ в участках воспаления. Отмечается высокая эффективность ПЭТ с ФДГ в оценке ответа на лучевую и химиотерапию опухолей пищевода и желудка.
Применение ПЭТ в диагностике
распространенности опухолей головы и шеи
Эффективность лечения больных раком органов головы и шеи в существенной мере зависит от точности оценки местной и регионарной распространенности опухолевого процесса.
Первичные опухоли, региональные и отдаленные метастазы характеризуются интенсивным захватом ФДГ. Метастазы в лимфоузлы характеризуются высоким захватом ФДГ и хорошо контрастируются. Установлено, что в выявлении метастатического поражения шейных лимфатических узлов у больных раком органов головы и шеи чувствительность и специфичность ПЭТ с ФДГ составили 90 и 94%, в то время как аналогичные показатели для КТ были 82 и 85%, МРТ – 80 и 79%.
ПЭТ с ФДГ также является эффективным и объективным инструментом оценки эффективности химиотерапии и лучевого лечения злокачественных опухолей головы и шеи. Метод позволяет дифференцировать жизнеспособную опухолевую ткань от фиброзно-склеротического процесса после лучевой терапии (Рис.4).
Рис. 4. ФДГ-ПЭТ и МРТ при плоскоклеточном раке слизистой левой щеки: А, B – до лечения; С, Д – после химиорадиотерапии.
При ФДГ-ПЭТ констатирован полный эффект в виде исчезновения гиперметаболического очага (истинно отрицательный результат), хотя на МРТ визуализируется остаточный субстрат (ложноположительный результат).
ФДГ позволяет эффективно выявить пораженные ЛУ средостения, а также отдаленные метастазы в легкие, печень, кости. Отсутствие захвата ФДГ обычно исключает остаточную или рецидивную опухоль.
При обследовании больных дифференцированным раком щитовидной железы наиболее важной задачей ФДГ-ПЭТ является выявление рецидивов у больных с повышенным уровнем опухолевого маркера (тиреоглобулина) на фоне отрицательного скана «всего тела» с 131 I. По мнению большинства исследователей, ФДГ-ПЭТ является эффективным методом выявления йод-негативного метастатического поражения шейно-надключичных, медиастинальных лимфоузлов и легких.
Применение ПЭТ в диагностике
распространенности рака молочной железы
Основной задачей ФДГ-ПЭТ при исследовании больных раком молочной железы является прогностическая оценка биологической активности первичной опухоли, диагностика регионарных и отдаленных метастазов, оценка эффективности проводимого противоопухолевого лечения и выявление местных рецидивов заболевания. Некоторые исследователи при наблюдении за группой больных местно-распространенным раком молочной железы отметили, что при высокой метаболической активности первичной опухоли, определяемой ФДГ-ПЭТ, можно прогнозировать низкую эффективность неоадъювантной химиотерапии. Что касается предоперационного стадирования рака молочной железы, то, по данным ряда зарубежных авторов, чувствительность ФДГ-ПЭТ при диагностике мультифокального поражения оказалась вдвое выше, чем при комбинированном применении маммографии и ультразвукового метода (63 и 32% соответственно). Чувствительность и специфичность ФДГ-ПЭТ при диагностике метастатического поражения аксиллярных лимфатических узлов составили 79 и 92% соответственно.
Влияние результатов ФДГ-ПЭТ на установление стадии заболевания и выбор тактики лечения рака молочной железы проанализировано в ряде зарубежных работ. Авторы указывают, что с учетом находок ФДГ-ПЭТ клиническая стадия была изменена в 36% наблюдений (28% – в сторону увеличения, 8% – в сторону уменьшения), вид лечения был скорректирован у 28%, а объем лечения – у 30% больных. Диагностическая чувствительность и специфичность ФДГ-ПЭТ при обследовании пациентов с подозрением на рецидив рака молочной железы, имеющих асимптоматическое повышение уровня опухолевых маркеров, составляют 96 и 90% соответственно [2, 4, 5].
Позитронные томографы обладают сравнительно невысоким пространственным разрешением, что затрудняет визуальный анализ ПЭТ-изображений. В связи с этим ПЭТ-сканеры производятся в конфигурации со сканерами рентгеновской компьютерной томографии (КТ), совмещенными в одной установке. Совмещение метаболических (ПЭТ) и анатомо-топографических (КТ) данных позволяет повысить точность локализации опухоли и определения распространенности заболевания. Совмещенная ПЭТ/КТ-технология позволяет получать более информативные изображения по сравнению с изображениями, получаемыми КТ- и ПЭТ-методами (Рис.5).
Рис. 5. КТ-изображение (А) и ПЭТ-изображение (В) плоскоклеточного рака левого легкого с метастазами в лимфоузлы средостения. Совмещенное КТ-ПЭТ-изображение (С) позволяет констатировать в рентгенологически выявленном очаге в легком наличие активной опухолевой ткани по периферии образования и очаг некроза в центре опухоли (помечено стрелкой).
Проблемы применения ПЭТ c ФДГ в онкологии
Клиническое применение ПЭТ с ФДГ выявило ряд ограничений, обусловленных, в частности, неспособностью эффективно выявлять опухоли малых размеров (до 10 мм), визуализировать некоторые опухоли мозга и опухоли мочеполовой системы, а также неспособностью дифференцировать злокачественные заболевания от воспалительных изменений. Поэтому задача разработки новых альтернативных ФДГ радиофармпрепаратов с более высокой туморотропностью и специфичностью является актуальной.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.