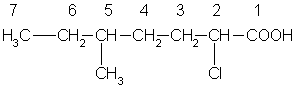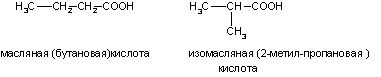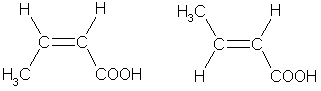у какой кислоты 2 функциональные группы
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Ангидриды
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Строение карбоновых кислот
Виды карбоновых кислот
Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.
Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия
Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.
Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
Из гомологов бензола получают бензойную кислоту.
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
Реакция замещения гидроксильной группы карбоновой кислоты
Для проведения реакции необходима минеральная кислота.
Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.
Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.
Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.
Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.
Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.
Функциональные группы
Функциональные группы образуются атомами или их группами, которые замещают атом водорода в углеродной основе.
Функциональные группы обладают общими химическими свойствами, которые принадлежат к одному и тому же классу производных углеводородов, что позволяет проще классифицировать свойства соединений (например, спирты обладают общими свойствами) и облегчает изучение всей органической химии.
Спирты: R-OH
Спирты являются производными предельных и непредельных углеводородов, в молекулах которых атом (атомы) водорода заменены гидроксильной группой (группами) -OH, которая определяет общие свойства всех спиртов. По этой причине, во многих случаях не имеет значения, какой будет остальная часть молекулы спирта, т.к. функциональная группа определяет общее поведение спиртов во многих химических реакциях.
Метанол (метиловый или древесный спирт) получают при помощи реакции синтеза из оксида углерода и водорода в присутствии катализатора при высоких значениях давления и температуры:
Этанол (этиловый или винный спирт) получают из различных сахаристых веществ при помощи реакции брожения, вызываемой действием ферментов, которые вырабатывают дрожжевые грибки (данный способ получения спирта применяют для приготовления алкогольных напитков):
Карбоновые кислоты: R-COOH
Функциональную группу в карбоновых кислотах составляет карбоксильная группа -COOH.
Названия карбоновых кислот заканчиваются на -овая кислота.
Карбоновые кислоты получают при помощи реакций окисления спиртов. Ниже приведена реакция окисления этанола на воздухе, в результате которой образуется уксусная (этановая) кислота (не оставляйте на длительное время открытой бутылку с вином):
Многие карбоновые кислоты имеют резкий неприятный запах.
Сложные эфиры: R-COO-R
Сложные эфиры получают из карбоновых кислот при их взаимодействии со спиртами (реакция этерификации), при этом, в отличие от карбоновых кислот, получаемые сложные эфиры обладают приятным запахом (сложные эфиры придают аромат цветам, запах плодам и ягодам):
Простые эфиры: R-O-R
Функциональную группу простых эфиров представляет один атом кислорода, связанный с двумя углеводородными группами.
Простые эфиры в химическом плане достаточно инертны, используются в качестве растворителей в органических реакциях. Вступая (медленно) в реакцию с атмосферным кислородом, простые эфиры образуют пироксиды, являющиеся взрывоопасными соединениями (именно по этой причине медики отказались от использования диэтилового эфира в качестве наркоза).
Получают простые эфиры с помощью реакции дегидратации спиртов. Например диэтиловый эфир синтезируют дегидратацией этилового спирта в присутствии серной кислоты:
Альдегиды и кетоны
Амиды и амины
Функциональная группа аминов:
Функциональная группа амидов:
Амиды и амины являются производными аммиака, поэтому, относятся к слабым основаниям. Нашли широкое применение в производстве синтетических красителей, лекарственных препаратов, пластмасс, взрывчатых веществ.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
У какой кислоты 2 функциональные группы
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункционапьными. Среди них различают галогенкарбоновые (например, CH2Cl—COOH), нитро-кислоты (например, NO2—С6Н4СООН), аминокислоты, оксикислоты (например, молочная СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название «жирные» эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
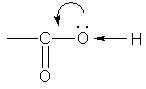
В свою очередь, группа ОН «гасит» положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Углеводородную цепь нумеруют начиная с атома углерода карбоксильной группы, например:
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание «карбоновая кислота» и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
Гептадецен-8-карбоновая (олеиновая) кислота
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса «диовая» и слова «кислота». Например, этандиовая (щавелевая) кислота (НООС-СООН).
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания «дикарбоновая кислота». Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
2. Изомерия положения кратной связи, например:
СН2=СН—СН2—СООН СН3—СН=СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кретоновая кислота)
3. Цис-транс- изомерия, например:
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—СН2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СН3) и этиловый эфир уксусной кислоты (СН3—СО—О—СН2—СН3).
5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
СН3—СН2—СНСl—СООН СН3—СНСl—СН2—СООН
2-хлорбутановая кислота 3-хлорбутановая кислота
Для гетерофункциональных кислот возможна также оптическая изомерия.
Кислоты, содержащие 1-3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
В жидком состоянии и в неводных растворах молекулы монокарбоновых кислот димеризуются в результате образования между ними водородных связей. Это объясняет гораздо более высокие температуры кипения карбоновых кислот по сравнению со спиртами и альдегидами с тем же числом атомов углерода; температуры плавления и кипения с ростом молекулярной массы возрастают.
У какой кислоты 2 функциональные группы
Огромное разнообразие органических соединений выдвигает на первый план проблемы систематизации и классификации. Каждое органическое соединение должно быть названо, причём следует помнить, что ему можно было поставить в соответствие только одну структуру.
Номенклатура органических соединений правила, по которым образованы названия органических соединений.
Все органические соединения рассматриваются как производные углеводородов, в молекулах которых часть водородных атомов заменена на функциональные группы или углеводородные радикалы.
1. В молекуле выбирают наиболее длинную углеродную цепь (главную). Главная цепь содержит максимальное число функциональных групп. Название углеводорода, соответствующего главной цепи, и будет корнем составляемого названия.
2. Атомы углерода в главной цепи нумеруются таким образом, чтобы атом, к которому присоединён заместитель (углеводородный радикал или функциональная группа), получил меньший номер.
4. Органическое вещество причисляется к тому или иному классу в зависимости от того, какая функциональная группа присутствует в его молекуле. Если в соединении присутствует только одна функциональная группа, то она всегда обозначается суффиксом. Такая группа называется старшей (главной), и главную цепь выбирают таким образом, чтобы к ней обязательно была прикреплена основная группа. Если в соединении присутствуют несколько функциональных групп, то выбор и нумерацию главной цепи определяет старшая из них (старшинство группы тем выше, чем выше она расположена в нижеприведённой таблице):