В чем заключается суть fish метода
В чем заключается суть fish метода
Подобно тому, как в ходе Саузерн-блоттинга нуклеотидные зонды используют для идентификации фрагментов ДНК, цитогенетики могут применять подобные зонды для анализа хромосомных аберраций. Для этого гибридизируют меченные флюоресцентным красителем зонды с ДНК, содержащейся в фиксированных хромосомах на предметных стеклах.
Эта техника называется Fluorescence In Situ Hybridisation (FISH), поскольку ДНК, содержащаяся в интерфазном хроматине или в метафазных хромосомах, фиксирована и денатурируется на стекле в одном месте (т.е. in situ), для обработки меченым зондом, гибридизирующимся с хромосомной ДНК. Зонд флюоресцирует при освещении хромосом светом с длиной волны, возбуждающей флюоресцентный краситель. Положение гибридизационного сигнала и, таким образом, позицию сегмента ДНК с гибридизированным зондом определяют микроскопически.
Обычно для FISH-анализа используют зонды — фрагменты ДНК, имеющие уникальное положение в хромосоме. Такие зонды проходят гибридизацию и помечают место в каждой гомологичной хромосоме, соответствующее нормальному положению последовательности зонда. FISH-зонд также может быть сложной смесью ДНК, полученной из всего плеча или даже целой хромосомы. В зависимости от состава зонда, при гибридизации с ним помечается вся хромосома или ее часть.
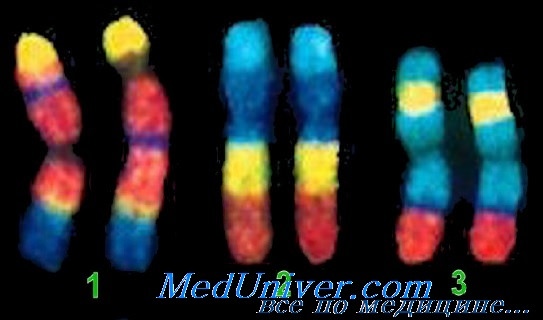
Такие смеси зондов известны как хромосомные зонды. Наконец, можно объединить 24 различных хромосомных зонда, меченных различными комбинациями флюоресцентных красителей, испускающих свечение разной длины волны, для каждой из 24 хромосом человека. Каждая хромосома помечается зондом с собственной характерной комбинацией длин световой волны. Все 24 хромосомных зонда объединяют и используют для FISH-анализа метафазных хромосом. Эта техника известна как спектральное кариотипирование (SKY).
Поскольку каждый хромосомоспецифичный зонд имеет флюоресценцию с собственной комбинацией длин волн, мутантные хромосомы, состоящие из частей различных хромосом, при SKY-анализе хорошо различаются, а хромосомы, включенные в перестройку, могут быть легко идентифицированы. FISH, использующий единичную непрерывную последовательность нуклеотидов, хромосомоспецифические зонды и SKY-метод с комбинацией зондов для всех хромосом, широко применяют в клинической цитогенетике для обнаружения хромосомных аберраций, таких как делеции, инсерции и транслокализации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В чем заключается суть fish метода
Традиционная цитогенетика при изучении кариотипа всегда была ограничена бэндовым уровнем разрешения. Даже при использовании высокоразрешающих методов дифференциального окрашивания хромосом мы всего лишь выявляли большее количество бэндов на хромосоме, но не были уверены, что добираемся до молекулярного уровня разрешения. Последние достижения ДНК-технологий и цитогенетики сделали возможным использование методов FISH для анализа изменений хромосомной ДНК на молекулярном уровне. Молекулярная цитогенетика обеспечила революционный прорыв в цитогенетике, позволив:
• осуществлять анализ структуры ДНК хромосом в диапазоне 10-100 килобаз;
• проводить диагностику неделящихся интерфазных клеток, что оказало огромное влияние на пренатальную диагностику и преимплантационную генетическую диагностику (ПГД).
Технология FISH использует ДНК-зонд, который связывается или ренатурирует специфические последовательности ДНК внутри хромосомы. Денатурированный зонд инкубируется с нативной ДНК клетки, также денатурированной до одноцепочечного состояния. Зонд замещает биотин-дезоксиуридинтрифосфат или дигоксигенин-уридинтрифосфат на тимидин. После ренатурации зондом нативной ДНК комплекс «зонд-ДНК» можно обнаружить при добавлении меченного флюорохромом авидина, связывающегося с биотином, или меченного флюорохромом антидигоксигенина. Дополнительное усиление сигнала можно получить, добавив антиавидин и изучив получившийся комплекс с помощью флюоресцентной микроскопии. Пометив несколькими различными флюорохромами разные ДНК-зонды, можно одновременно визуализировать несколько хромосом или хромосомных сегментов внутри одной клетки в виде разноцветных сигналов.
Возможность определения специфических генных сегментов, имеющихся или отсутствующих на хромосомах, позволила диагностировать синдромы генных последовательностей на уровне ДНК, как, впрочем, и транслокации в интерфазных ядрах, зачастую — в отдельных клетках.
Материалом для FISH могут служить или метафазные хромосомы, полученные из делящихся клеток, или интерфазные ядра из клеток, не находящихся в стадии деления. Срезы предварительно обрабатывают РНКазой и протеиназой для удаления РНК, которая может вступать в перекрестную гибридизацию с зондом и хроматином. Затем их нагревают в формамиде, чтобы денатурировать ДНК, и фиксируют ледяным спиртом. Затем зонд подготавливают к гибридизации путем нагревания. После этого зонд и хромосомный препарат смешивают и герметизируют покровным стеклом при 37 °С для гибридизации. Изменяя температуру инкубации или солевой состав раствора для гибридизации, можно повысить специфичность связывания и уменьшить фоновую маркировку.
Эффективность технологии FISH впервые была продемонстрирована при локализации генов на хромосомах. С внедрением метода флюоресцентного мечения, гибридизация in situ оказалась незаменимой для диагностики хромосомных аномалий, не выявляемых традиционными методами бэндинга. FISH также сыграла ключевую роль в совершении одного из самых необычных открытий современной генетики — геномного импринтинга.
Свое развитие технология FISH получила в трех формах. Центромерные, или альфа-сателлитные, зонды характеризуются относительной хромосомной специфичностью, их использовали чаще всего в генетике интерфазных клеток. Эти зонды генерируют в некоторой степени диффузные сигналы адекватной силы в области центромеры, но не вступают в перекрестную гибридизацию с хромосомами, имеющими аналогичные центромерные последовательности. В настоящее время разработаны однокопийные зонды, дающие дискретный сигнал от специфического бэнда хромосомы и позволяющие избежать феномена перекрестной гибридизации. Эти зонды также можно использовать для определения копийности и специфичных регионов хромосомы, предположительно связанных с тем или иным синдромом. Однокопийные и центромерные зонды, разработанные для хромосом 13, 18, 21, X и Y, используют для пренатальной диагностики.
Возможно также «окрашивание» целых хромосом с помощью FISH. Благодаря технологии спектрального кариотипирования, при которой используют смесь различных флюорохромов, теперь стало возможным создание уникального флюоресцентного паттерна для каждой отдельной хромосомы с 24 отдельными цветами. Эта технология позволяет определять сложные хромосомные перестройки, не видимые при использовании традиционных цитогенетических методик.
Метод FISH в пренатальной диагностике. Для женщин старшего репродуктивного возраста беременность может оказаться поводом не столько для радости, сколько для беспокойства. С возрастом женщины связан риск развития хромосомных аномалий плода. Амниоцентез, осуществляемый на 16-й неделе беременности, с последующим анализом кариотипа занимает 10-14 дней. Использование FISH в предварительном обследовании позволяет ускорить диагностику и уменьшить время ожидания. Большинство генетиков и лабораторий придерживаются мнения, что метод FISH не следует использовать изолированно для принятия решения о дальнейшем ведении беременности. Метод FISH обязательно следует дополнять кариотипическим анализом, и его результаты как минимум должны коррелировать с патологической картиной ультразвукового исследования (УЗИ) или биохимического скрининга по крови матери.
Синдромы генных последовательностей известны также под названием синдромов микроделеции, или сегментарной анеусомии. Это делеции смежных фрагментов хромосомы, вовлекающие, как правило, многие гены. Синдромы генных последовательностей были впервые описаны в 1986 г. с использованием классических методик цитогенетики. Теперь, благодаря FISH, возможна идентификация субмикроскопических делеции на уровне ДНК, что позволило выявлять наименьший делецированный регион, связанный с развитием того или иного синдрома, получивший название критического региона. После определения критического региона для синдрома зачастую становится возможным идентифицировать специфические гены, отсутствие которых признают ассоциированным с этим синдромом. В недавно вышедшем руководстве по синдромам генных последовательностей сообщают о 18 синдромах делеции и микроделеции, ассоциированных с 14 хромосомами. Некоторые наиболее часто встречающиеся синдромы генных последовательностей и их клинические проявления приведены в табл. 5-2.
Теломеры — образования, прикрывающие с концов длинные и короткие плечи хромосом. Они состоят из повторяющихся последовательностей TTAGGG и предотвращают слияние концевых участков хромосом между собой. Теломерные зонды играют важную роль в распознавании комплексных транслокаций, которые невозможно определить традиционными цитогенетическими методами. Кроме того, одним из открытий Проекта «Геном человека» был тот факт, что регионы хромосом, прилежащие к теломерам, богаты генами. В настоящее время показано, что субмикроскопические субтеломерные делеции ответственны за возникновение многих генетически обусловленных заболеваний.
— Вернуться в оглавление раздела «физиология человека»
FISH и NGS
FISH и NGS
Преимплантационная генетическая диагностика (тестирование)
Преимплантационная генетическая диагностика (тестирование) эмбрионов — определение генетической патологии эмбрионов на стадии доимплантационного развития. На сегодняшний день репродуктивная медицина и эмбриология предоставляют несколько технологий генетической диагностики эмбрионов до переноса в полость матки. В Клинике МАМА представлен спектр программ преимплантационной генетической диагностики. Какая именно технология оптимальна для Вашей семьи — зависит от целого ряда факторов, которые учитывают наши специалисты: репродуктолог, андролог, генетик и, конечно же, эмбриологи.
Наши пациенты всегда получают полную информацию о технологиях, применяемых в Клинике, каждом этапе проводимого протокола экстракорпорального оплодотворения. Если Вы только планируете лечение у нас — знакомим Вас с возможностями преимплантационной генетической диагностики в Клинике МАМА:
преимплантационный генетический скрининг (ПГС) — определение спонтанной генетической патологии у эмбрионов;
преимплантационная генетическая диагностика (ПГД) — определение конкретного наследственного синдрома или заболевания, которое эмбрион может унаследовать от родителя с известной генетической патологией.
ВАЖНО: часто термин «ПГД» используют, обобщая различные методики: преимплантационный генетический скрининг (ПГС) и непосредственно ПГД эмбрионов.
Показания к проведению генетической диагностики эмбрионов
Преимплантационный генетический скрининг эмбрионов в программе экстракорпорального оплодотворения может быть рекомендован как оптимальная технология оценки генетического статуса эмбрионов в следующих случаях:
возраст женщины старше 36 лет (по данным ВОЗ риск рождения ребенка с анеуплоидией — аномальным набором хромосом, например, трисомией по 21 хромосоме, что приводит к рождению ребенка с синдромом Дауна, составляет 1/385 в возрасте 30 лет, 1/63 в возрасте 40 лет и 1/19 в возрасте 45 лет);
неудачные протоколы ЭКО в анамнезе;
привычное невынашивание беременности;
рождение ребенка (или беременность) с хромосомной патологией при нормальных кариотипах у родителей;
наличие негативных факторов внешней среды в условиях работы или проживания;
прием некоторых лекарственных препаратов в анамнезе;
аномалия половых хромосом;
ВАЖНО: в каждом случае генетической патологии у родителей необходим индивидуальный подход при выборе алгоритма ПГД.
Преимплантационная генетическая диагностика в Клинике МАМА
Скрининг методом FISH:
скрининг наиболее часто встречающихся численных хромосомных аномалий методом FISH (Fluorescence In Situ Hybridization) — флуоресцентная in situ гибридизация — «золотой стандарт» генетической диагностики во всем мире на сегодняшний день.
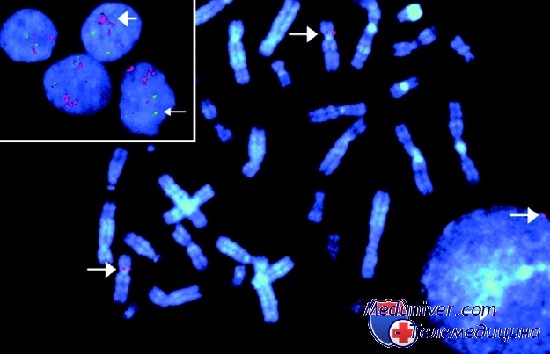
Суть метода заключается в том, что в ядро эмбриональной клетки внедряют специально подобранные для каждой хромосомы ДНК-зонды, окрашенные различными флуоресцентными (светящимися) красителями. Происходит гибридизация ДНК-зонда со «своей» хромосомой. Результат этой гибридизации обнаруживают с помощью люминесцентного микроскопа, а при использовании регистрирующей оптики и специального программного обеспечения получают изображение ядра с флуоресцентными сигналами — «фотографию» исследуемых хромосом. Анализ полученного изображения позволяет выявить возможные хромосомные нарушения.
В скрининговую панель включено определение 5 хромосом: половые (X, Y), 13, 18 и 21. Исследование именно этих хромосом позволяет исключить наиболее частые генетические синдромы новорожденных — Дауна, Патау и Эдвардса, а также анеуплоидии половых хромосом, которые занимают первое место по частоте встречаемости.
Для данной FISH диагностики мы проводим биопсию эмбриональных клеток (4 сутки развития эмбриона). Сама процедура выполняется в интервале от 12 до 48 часов после биопсии и к моменту переноса эмбрионов, на 5-6 сутки развития уже известен результат генетического скрининга.
Полногеномный скрининг методом NGS (Next Generation Sequencing):
новейшая молекулярно-генетическая технология, пришедшая на смену технологиям с использованием ДНК-микрочипов. В основе метода NGS полное геномное секвенирование нового поколения, буквенное прочтение ДНК-кода.
Метод является высокочувствительным и позволяет определить численные, а в ряде случаев и структурные аномалии всех 24 хромосом.
Для диагностики методом NGS мы также проводим биопсию эмбриональных клеток, которые служат материалом для анализа. После биопсии эмбрионы необходимо криоконсервировать до следующего цикла, когда будет известен результат генетического скрининга.
NGS при робертсоновской транслокации:
транслокация происходит только между двумя любыми хромосомами из группы D (акроцентрические хромосомы) — 13, 14, 15, 21 и 22.
Эмбрионы от родителя с робертсоновской транслокацией могут иметь нормальный набор хромосом (здоровы), могут нести сбалансированную робертсоновскую транслокацию (здоровы, но являются носителями), могут нести несбалансированную реципрокную транслокацию (больны или нежизнеспособны).
Ярким примером несбалансированной транслокации является так называемый семейный синдром Дауна, когда в семье из поколения в поколение могут быть частыми случаи рождения ребенка с трисомией 21 хромосомы. Такое бывает, когда у членов семьи присутствует сбалансированная робертсоновская транслокация с участием хромосомы 21.
Еще одна серьезная патология — синдром Патау, трисомия хромосомы 13, может быть следствием носительства родителем транслокации с участием хромосомы 13.
Эмбрионы с моносомией нежизнеспособны, поэтому в паре, где один из родителей является носителем робертсоновской транслокации, часто наблюдаются трудности в достижении беременности или привычное невынашивание.
Целью генетической диагностики при робертсоновской транслокации является выявление эмбрионов с несбалансированной транслокацией, которая является причиной моносомии или трисомии. Наличие транслокации является пусковым механизмом для формирования анеуплоидий по любой другой хромосоме, в связи с этим при наличии транслокации оптимальным является метод NGS.
FISH при аномалии половых хромосом:
в большинстве случаев аномалии половых хромосом эта генетическая патология является причиной абсолютного бесплодия и таким пациентам рекомендовано ЭКО с использованием донорских половых клеток.
Бывают случаи, когда собственные половые клетки созревают, но генетическая аномалия в том или ином виде может быть передана ребенку. Это касается синдрома Клайнфельтера (одна и более дополнительных X хромосом у мужчины), а также дополнительные Х хромосомы у женщины.
Целью преимплантационной генетической диагностики при численной аномалии половых хромосом является выявление эмбрионов с анеуплоидией половых хромосом. Для этой цели оптимальным и достаточным является метод FISH.
NGS при реципрокной транслокации:
транслокация происходит между любыми хромосомами спонтанно, размер и положение транслоцированных фрагментов также являются случайными.
Носитель сбалансированной реципрокной транслокации является здоровым человеком, поскольку общее количество генетического материала не нарушено, изменено лишь его положение на хромосомах.
Но при созревании половых клеток у пациента генетический материал наследуется таким образом, что сперматозоиды или яйцеклетки, в большинстве случаев, несут несбалансированный набор — избыток или недостаток жизненно важных генов. Если в оплодотворении участвует такой сперматозоид или яйцеклетка, то эмбрион будет нежизнеспособный или может родиться тяжело больной ребенок.
Целью ПГД при реципрокной транслокации является определение эмбрионов с несбалансированным, аномальным генетическим набором. Поскольку транслокация может затрагивать небольшие участки хромосом, для проведения точной диагностики необходим высокочувствительный молекулярно-генетический метод. На сегодняшний день таким является метод NGS. Для каждого случая реципрокной транслокации специалисты подбирают оптимальные параметры секвенирования, с учетом величины транслоцированных участков и характера транслокации.
Для диагностики методом NGS мы также проводим биопсию эмбриональных клеток, которые служат материалом для анализа. После биопсии эмбрионы необходимо криоконсервировать до следующего цикла, когда будет известен результат генетической диагностики.
FISH и NGS при моногенном заболевании:
моногенное заболевание вызвано нарушением (мутацией) в определенном гене. На сегодняшний день описано около 4000 моногенных заболеваний, большинство из которых встречаются редко — 1/6000.
Принципы наследования моногенных заболеваний подчиняются классическим законам генетики, сами заболевания классифицируются по типу наследования:
Аутосомно-доминантный тип — носитель мутантного гена всегда болен, поэтому о риске рождения больного ребенка в семье известно заранее. Вероятность рождения ребенка с патологией составляет 50%.
В этом случае необходимо обследование носителя заболевания с целью точного определения мутации. После получения исчерпывающей информации о характере и положении мутации, молекулярные генетики создают индивидуальную тест-систему для диагностики заболевания у эмбрионов, или же предлагают уже известную тест-систему, если таковая описана и имеется в особых базах данных (генетических библиотеках). Диагностику проводят методом NGS.
Аутосомно-рецессивный тип — носитель мутантного гена здоров, но может передать его ребенку. Если оба родителя являются носителями одного заболевания, то ребенок, получивший две копии мутантного гена — по одной от каждого из родителей, будет болен. Как правило о носительстве моногенного заболевания с таким типом наследования супруги узнают уже после рождения в семье ребенка с патологией. Риск рождения больного ребенка составляет 25%.
В данном случае необходимо доскональное обследование семьи — родителей, рожденного ребенка (если есть), дедушек и бабушек, братьев и сестер — чем больше членов семьи будет обследовано, тем достовернее будет результат. Обследование включает в себя генетическую диагностику возможных носителей заболевания, составление генеалогической истории заболевания.
После получения исчерпывающей информации о характере и положении мутаций со стороны обоих родителей молекулярные генетики создают индивидуальную для данной семьи тест-систему, которую используют для проведения ПГД. Диагностику проводят методом NGS.
Моногенное заболевание, сцепленное с полом — мутантный ген расположен на половой хромосоме, заболевание проявляется у людей определенного пола.
Поскольку заболевание передается только людям определенного пола, необходимым и достаточным в данном случае является выбор эмбрионов нужного пола, которому не передается заболевание. Определить пол эмбриона можно методом FISH.
Если Вам рекомендовано генетическое обследование, Вы планируете посетить врача-генетика, Вам необходимо проведение преимплантационной генетической диагностики в программе ЭКО — в Клинике МАМА Вам окажут экспертную медицинскую помощь. Задать интересующие Вас вопросы и записаться на прием можно по телефону +7 495 921 43 26, оставив заявку на обратный звонок, а также воспользовавшись нашим онлайн-сервисом «Бесплатная консультация».
Исследование гоносом FISH-методом у преимплантационных эмбрионов
Данная статья описывает исследование преимплантационных эмбрионов с помощью FISH-метода (fluorescent in situ hybridization) у супружеских пар, проходящих лечение бесплодия методом экстракорпорального оплодотворения (ЭКО).
Суть исследования
Проводили определение пола у 360 эмбрионов, полученных у 42 супружеских пар в 60 циклах стимуляции суперовуляции в программе ЭКО. После биопсии и фиксации бластомеров пригодным к проведению диагностики оказалось 281 ядро, из них 217 (77,2%) не несли хромосомной патологии. 104 ядра содержали женский набор хромосом, 113 –мужской. В 64 ядрах (22,8%) были выявлены различные виды анеуплоидии гоносом. Дальнейшее развитие эмбрионов после проведения биопсии бластомера наблюдалось в 79%.
В 10 циклах стимуляции из 60 перенос не производился в связи с отсутствием эмбрионов нужного пола. Беременность наступила в 17 циклах (28% на цикл стимуляции и 34% на перенос эмбрионов). Из 13 клинически подтвержденных беременностей 4 прервались в 1-ом триместре, 1 –во 2-ом. 8 беременностей закончились рождением 10 (2 двойни) здоровых детей желаемого пола.
Из 64 ядер, содержащих хромосомную патологию, 19 (29,7%) имели моносомию X-хромосомы, 8 (12,5%) – моносомию Y-хромосомы. Трисомия была отмечена в 28 случаях (43,8%), полисомия в 8 (12,5%). Таким образом, полученные данные показали, что моносомия и трисомия являются наиболее частой хромосомной патологией гоносом.
Преимплантационная генетическая диагностика (ПД) возникла более 40 лет назад. Впервые R.Edwards и R.Gardner применили ее в 1967 г. для определения пола эмбрионов кролика. Уже тогда возникла идея использования данной технологии у человека для предотвращения передачи наследственных заболеваний от родителей детям. Однако такая возможность появилась только спустя 20 лет, когда в начале 90-х годов была разработана техника полимеразной цепной реакции (ПЦР), позволяющей выявлять мутации в единичных клетках [2]. Впервые ПЦР для проведения ПД в клинической практике применили A.Handyside и соавторы в 1990 г., выявив специфические последовательности для Y-хромосомы при определении пола эмбрионов у супружеских пар с X-сцепленными заболеваниями. С развитием науки от проведения ПЦР постепенно стали отказываться в пользу другого метода — флюоресцентной (нерадиоактивной) гибридизации in situ (FISH). Преимущество данного метода состояло в возможности одновременного определения как X-, так и Y-хромосомы. Кроме того, стало возможным определять не только пол эмбрионов, но и выявлять анеуплоидии половых хромосом (гоносом).
Молекулярно-цитогенетическое исследование FISH
На современном этапе развития медицины для определения пола преимплантационных эмбрионов используют молекулярно-цитогенетический метод FISH. Данный метод имеет ряд преимуществ перед другими способами молекулярной гибридизации: для генетического исследования методом FISH не требуется получения большого количества биологического материала, выделения ДНК из клеток, а также использования радиоизотопа P32. С помощью этого метода можно анализировать хромосомы на всех стадиях клеточного цикла, в том числе в интерфазе. Его принцип основан на специфической гибридизации определенных участков хромосом с флюоресцентно-меченными зондами. Метод позволяет определить структурные перестройки хромосом и выявить число их копий в интерфазных ядрах по флюоресценции зондов.
ПД молекулярно-цитогенетическим FISH-методом с определением пола, выявлением анеуплоидии и различных транслокаций в эмбрионах занимает большую часть от общего числа проводимой диагностики в рамках программ ВРТ. В большинстве клиник основными показаниями для определения пола эмбрионов являются: наличие рецессивного Х-сцепленного заболевания, наличие делеций в Y хромосоме, а также желание родителей.
Исследуя пол у эмбрионов, все авторы отметили у них высокий уровень анеуплоидии гоносом и мозаицизм. По данным разных авторов, клеточный мозаицизм у преимплантационных эмбрионов может наблюдаться до 50% случаев. Эти исследования подтвердили, что высокая доля хромосомных нарушений, выявленная у эмбрионов, не связана с недостатками методики FISH, а соответствует истинному кариотипу исследуемых клеток. Полученные результаты указывают на то, что при проведении преимплантационной генетической диагностики супружеским парам с целью определения пола эмбрионов необходимо одновременно исследовать их на наиболее распространенные трисомии.
Цель исследования
Определение пола эмбрионов и выявление патологии в комплексе гоносом.
Материалы и методы
В отделении вспомогательных технологий в лечении бесплодия НЦ АГиП им.академика В.И.Кулакова были проанализированы результаты проведения преимплантационной генетической диагностики (ПГД) с определением пола эмбрионов 42 супружеских пар по желанию пациентов. На момент исследования 2 пары были фертильны, остальные проходили лечение по программе ЭКО и ПЭ в связи с первичным или вторичным бесплодием. Средний возраст пациенток составил 32 года (от 23 до 43 лет). Исследование эмбрионов проводили с помощью FISH-метода.
Определение пола эмбриона проводили на ядрах бластомеров. Биопсия бластомера осуществлялась с помощью микроманипулятора. Для получения биологического материала прежде всего проводили пенетрацию наружной оболочки эмбриона (zona pellucida) до размера, достаточного для аспирации бластомера аспирационной микроиглой (20-40 мкм). Вскрытие zona pellucida осуществляли с помощью лазерного луча. Бластомер, содержащий четко видимое ядро, аспирировали в просвет микроиглы, соединенной с микрошприцем (50-100 мкл). Биопсированный бластомер помещали на предметное стекло, фиксировали и выполняли процесс гибридизации ДНК хромосом, содержащихся в ядре, и ДНК-зонда. Использовали зонды к X- и Y- хромосомам (фирма ABBOTT). Готовый препарат анализировали с помощью люминесцентного микроскопа (фирма Zeiss), при использовании которого каждая хромосома имеет свой, отличный от других, цвет свечения.
Результаты
Всего в 60 циклах стимуляции суперовуляции у 42 женщин было получено 520 ооцитов, после оплодотворения которых развился 371 эмбрион (71,3%). Биопсия бластомеров была проведена у 360 эмбрионов (11 эмбрионов были разрушены в ходе биопсии).
Среди выявленной патологии по изучаемым хромосомам наибольшая доля принадлежала моносомии X-хромосомы –29,7% (в 19 наблюдениях из 64). Моносомия Y-хромосомы была отмечена в 8 случаях (12,5%). Таким образом, общий уровень моносомии составил 42,2% (в 27 случаях из 64). Трисомия гоносом среди случаев выявленной анеуплоидии была отмечена в 28 наблюдениях, что составило 43,8%. Полисомия гоносом составила 12,5% (в 8 наблюдениях из 64).
После проведения процедуры забора бластомера дальнейшее развитие среди пригодных для биопсии эмбрионов наблюдали в 79% случаев. Из 60 случаев проведенной диагностики отмена переноса в связи с отсутствием нужного пола была в 10 случаях. Всего беременность наступила в 17 проведенных циклах, что составило 28% на цикл стимуляции и 34% на перенос эмбрионов. Из 13 клинических беременностей 4 остановились в развитии в 1-ом триместре беременности, 1 прервалась во 2-ом. 8 беременностей завершились родами, родилось 10 здоровых детей нужного пола (в 2-х случаях –двойни).
Выводы
Полученные нами данные показали, что проведение ПГД FISH-методом может успешно использоваться с целью определения пола эмбрионов и дальнейшего переноса в полость матки эмбриона желаемого пола. Кроме того, определение пола FISH-методом позволяет выявить патологию гоносом, что предотвращает перенос эмбриона с хромосомной патологией в полость матки пациентки, раннюю гибель эмбриона или рождение больного ребенка. Однако, учитывая наличие мозаицизма в эмбрионе, даже после проведения ПГД рекомендована пренатальная диагностика для исключения рождения ребенка с хромосомными нарушениями.